Кристална структура
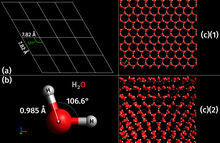


Кристална структура је карактеристика чврстих тела, која је одређена правилном структуром честица од којих је тело грађено.[3] Оваква чврста тела чији су атоми или атомске групе правилно просторно распоређени називају се кристалима. Правилности просторне распоређености атома се изражавају и код екстерних особина кристала, нпр. код кристала натријум хлорида (кухињске соли). Видљиво је да сваки кристал натријум хлорида представља готово савршену коцку. У овом случају се та правилност протеже на велики део, односно на цели комад испитиваног материјала, па се та особина назива макрокристалношћу, а материјал - монокристал. У противном случају тј. када се правилност протеже на малу област материјала, тада кристалност постоји у малим размерама па се особина назива поликристалношћу, а материјал - поликристал. Кристална структура даје чврстим материјалима већу механичку чврстину, док са друге стране неправилна (аморфна) структура утиче на жилавост. Процес промене агрегатног стања супстанце, из течног у чврсто, при чему долази до формирања кристала који имају правилну структуру се назива кристализација.
Према врсти честица и њихових веза разликују се атомске, јонске и молекуларне кристалне решетке. Тако на пример решетка је натријум хлорида (кухињска со) јонска (грађена од натријумових и хлорових јона), решетка дијаманта је атомска с ковалентном везом између угљеникових атома, решетка бензена је молекуларна и тако даље. Основне градивне честице кристала налазе се на тачно одређеним и сталним положајима у јединичној ћелији, основној, најмањој запремини просторне решетке, који садржи најмањи могући број структурних јединица. Периодичким понављањем јединичне ћелије дуж 3 некопланарна рационална смера изграђена је цела кристална решетка, то јест цели кристал. Свака јединична ћелија има облик паралелопипеда и одређена је с помоћу смера и дужине три брида, те са три угла међу бридовима, а облик ћелије мора имати највећу (максималну) симетрију некога кристалног система.
Основно је начело (принцип) просторне решетке: сваки чвор решетке има једнак број суседних чворова на једнакој удаљености и једнако распоређених, то јест чворови се ни по чему међусобно не разликују. С обзиром на могуће јединичне ћелије, постоји 14 међусобно различитих просторних решетки, које носе назив Бравеове решетке (према А. Бравеу). Њих седам (триклинска, моноклинска, ромпска, тригонска, тетрагонска, хексагонска и кубна) називају се примитивним, јер имају чворове (места у кристалу с идентичном околином у истом смеру) само у угловима јединичне ћелије. Осталих седам су центриране решетке с додатним чворовима у средини ћелије, на супротним паровима плоча или у средини тих плоча. У Бравеовим решеткама постоји само транслацијска симетрија кристалне решетке. Потпуна симетрија неке кристалне решетке, то јест кристалне структуре, описана је једном од 230 просторних, Федоровових групе симетрије (према Ј. С. Федорову). Бравесове решетке и Федорове групе представљају унутрашњу симетрију (микросиметрију) кристала.[4]
Подела
[уреди | уреди извор]Према врсти везе и распореду градивних елемената разликују се:
- метална кристална решетка
- атомска кристална решетка
- молекуларна кристална решетка
- јонска кристална решетка
| тип кристала | Примери | Енергија везе kJ/mol | Тип хемијске везе | Структурне јединице | Карактеристике кристала |
| јонски | NaCl
LiF |
753,624
1004,832 |
јонска (хетерополарна) | позитивни и негативни јони | Тврди и крти, висока тачка топљења, јака инфрацрвена апсорпција, мала електрична проводност на ниским температурама, добра јонска проводност на високим температурама. Топљиви у растварачима типа воде. Раствори и растопи су су јонски проводници. |
| ковалентни | дијамант
SiC |
~711,756
1184,8644 |
ковалентна (хомополарна) | атоми | Велика тврдоћа, висока тачка топљења, ниска електрична проводност, практично нерастворни у свим растварачима. |
| метални | Na
Fe |
108,8568
3935592 |
метална | јони метала | Тврди и ковни, висока тачка топљења, метални сјај, висока електрична и топлотна проводност, растворни само у текућим металима. |
| молекуларни | Ar
CH4 |
7,53624
10,04832 |
ван дер Валсове силе | атоми или молекули | Мекани, ниска тачка топљења, релативно велика компресибилност, ниска електрична проводљивост, растворни у органским растварачима. |
| с водичним везама | H2O (лед)
HF |
50,2416
29,3076 |
водонична | атоми или молекули | У односу на молекуларне кристале већа енергија везе, виша тачка топљења, помак карактеристичних трака у инфрацрвеним спектрима према нижим фреквенцијама, веће диелектричне константе; тенденција ка полимеризацији. |
Просторна решетка кристала
[уреди | уреди извор]Просторна решетка кристала или транслациона група је скуп тачака дефинисаних са вектором транслације решетке. Пошто су атоми, односно атомске решетке група атома правилно распоређене, могуће је у простору дефинисати три вектора елементарне транслације:
, , . Ови вектори представљају периоде кристалне решетке у три различита правца, називају се ортовима решетке или ортовима вектора транслације решетке који је дат следећом формулом:
Елементарна ћелија
[уреди | уреди извор]Просторна решетка кристала се сада уз помоћ вектора транслације добија узимајући све вредности целих бројева за , и , док се паралелопипед који се добија узимајући вредности , и = 1, назива елементарном ћелијом. Треба напоменути да чворови кристала у којима се налазе атоми се не поклапају у општем случају са врховима ортова , и . Оваква нотација дефинисана вектором транслације указује на правилност, али нам не говори у где се налазе атоми. Само у посебним случајевима могу се чворовима решетке приписати и атоми или атомске групе[5].
Кристални системи
[уреди | уреди извор]Кристални систем представља категорију карактерисану на основу врсте просторне решетке кристала. Елементарна ћелија је дефинисана као најмања просторна јединица кристала, њеним правилним померањем у простору за удаљености које су једнака њеним димензијама добијамо просторну решетку. Кристални систем за случај када су ортови и када између себе граде праве углове од 90° се назива кубични, и он има највише елемената симетрије. У општем случају ортови нису једнаки и могу чинити међусобне произвољне углове α, β и γ. У зависности од ових вредности извршена је подела на 7 кристалних система за којих има 14 комбинација елементарних ћелија које се другачије називају и Бравеове ћелије.
Класификација
[уреди | уреди извор]| Назив система | a | b | c | α | β | γ | тип решетке | |||
| Триклински (T) | a | ≥a | ≤a | ≠90° | ≠90° | ≠90° | 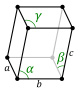
| |||
| Моноклински (М) | a | b | ≤a | ≠90° | 90° | 90° | проста | базноцентрична | ||

|

| |||||||||
| Орторомбни (ОР) | a | <a | >a | 90° | 90° | 90° | проста | базноцентрична | просторноцентрична | површинскицентрична |

|

|
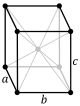
|

| |||||||
| Тетрагонални (ТЕ) | a | a | ≠a | 90° | 90° | 90° | проста | просторноцентрична | ||

|

| |||||||||
| Ромбни (Р) | a | a | a | α = β = γ ≠ 90° | 
| |||||
| Хексагонални (Х) | a | a | c | 90° | 90° | 120° | 
| |||
| Кубични (К) | a | a | a | 90° | 90° | 90° | Проста | просторноцентрична | површинскицентрична | |
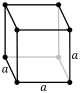
|

|

| ||||||||
Неке структуре
[уреди | уреди извор]Кубични кристални систем
[уреди | уреди извор]Кухињска со
[уреди | уреди извор]
Структура кухињске соли или натријум хлорида је таква структура код које одвојено атоми натријума и хлора чине површински центричну кубичну структуру. У овој решетки сваки јон је окружен са шест јона другог елемента; ти јони се налазе у теменима коцке. Ова иста структура се налази код многих других минерала у скоро свим алкалним халогенидима као и многим двовалентним металним оксидима, сулфидима, селенидима и телуридима. Уопштено, у природи постоји велика вероватноћа да се формира оваква структура. Кристалографска група ове структуре се зове "Fm3m" у Херман-Мугиновој нотацији или "225" у Међународној табели за Кристалографију. Координација број сваког атома у овој структури је 6: сваки катјон координира са 6 анјона у теменима октаедра, и слично, сваки анјон је координиран са 6 катјона.
Дијамант
[уреди | уреди извор]
Кристална структура дијаманта је нешто сложенија структура која потпада под Кубични кристални систем. Кад се каже сложенија, мисли се на то да не потпада под једноставне комбинације: прости, базноцентрични, просторноцентрични нити површинскицентрични, већ се представља као модификација једне од ових, тј. површинскицентричне кубичне решетке. Структура дијаманта је важна јер се по њој, осим самог дијаманта, кристалишу полупроводници германијум и силицијум, као и сива модификација калаја која је стабилна на температури нижој од 13 °C. Основну улогу у овој структури играју тетраедричне валентне везе којима је сваки атом угљеника везан са четири најближа суседа распоређена у тетраедар. Чврстина и способност дијаманта да прелама светлост су последица његове структуре.
Сфалерит
[уреди | уреди извор]
Кристална структура сфалерита (енгл. Zincblende structure) заједно са структуром решетке дијаманта чине две најважније структуре решетки полупроводнчких материјала. Дијамантска структура код силицијума и германијума (Si, Ge), а структура код галијум арсенида (GaAs) се кристализује у структуру сфалерита. Обе имају под два атома у основи, док атоми заузимају тетраедарску структуру, тј. сваки атом је окружен са четири најближа суседа који леже у теменима тетраедра. Структура сфалерита се као и структура дијаманта може сматрати модификацијом површинско центричне кубичне структуре. Разлика између њих је то што су у дијамантској решетки сви атоми су истог елемента, рецимо силицијума, док код структуре сфалерита на пр. код галијум арсенида (GaAs) у центру тетраедра се налази један елемент који је окружен са четири атома другог елемента. Галијум арсенида припада једињењима елемената III и V групе у периодном систему елемената и већина ових једињења се кристализује у структура сфалерита. Међутим велик број полупроводничких материјала укључујући и нека једињења из III-V групе се кристалишу у структуру натријум хлорида.
Хексагонални кристални систем
[уреди | уреди извор]Графит
[уреди | уреди извор]Графит је друга алотропска модификација угљеника која има специфичну кристалну структуру. Угљеникови атоми образују шесточлане прстенове који су распоређени у паралелним равнима (слојевима). Веза између C атома у слојевима је јака ковалентна веза, са растојањем између суседних угљеникових атома од 0,145 nm и енергијом везе од 4,3 електрон волти. Између слојева, међутим, делују слабе Ван дер Валсове силе, тако да је растојање између њих 0,341 nm, а енергија везе само 0,07 електрон волти. Овај тип решетке представља слојевиту решетку која графиту даје специфичне особине. Графит је веома мек и служи за подмазивање, за разлику од дијаманта који има атомску кристалну решетку[6].
Вурцит
[уреди | уреди извор]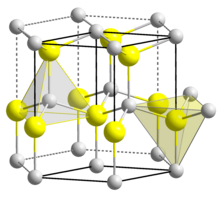
Вурцит је сулфидни минерал хемијског састава (Zn,Fe)S; цинка или гвожђе са анјоном сулфида. Сфалерит је истог хемијског састава, док се Вурцит доста ређе јавља у природном облику. Вурцит је хексагоналне (шестоугаоне) структуре у којој атоми праве везе са тетраедарски распоређеним подједнако удаљеним суседним атомима, слично структури сфалерита. Нека полупроводничка једињења, као што су цинксулфид ZnS и кадмијумсулфид CdS се могу кристализовати у обе структуре; структуру сфалерита и вурцита. Код структуре вурцита дуж C - осе, тј. оптичке осе за разлику од структуре дијаманта јавља се двојно преламање, дихроизам. Другим речима, за CdS је анизотропан материјал, док је рецимо силицијум изотропан.
Види још
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ Petrenko, V. F.; Whitworth, R. W. (1999). Physics of Ice. Oxford University Press. ISBN 9780198518945.
- ^ Bernal, J. D.; Fowler, R. H. (1933). „A Theory of Water and Ionic Solution, with Particular Reference to Hydrogen and Hydroxyl Ions”. The Journal of Chemical Physics. 1 (8): 515. Bibcode:1933JChPh...1..515B. doi:10.1063/1.1749327.
- ^ Hook, J.R.; Hall, H.E. (2010). Solid State Physics. Manchester Physics Series (2nd изд.). John Wiley & Sons. ISBN 9780471928041.
- ^ Kristalna rešetka, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2019.
- ^ Др Димитрије Тјапкин:Физичка електроника и електронска физика чврстог тела, Научна књига, Београд, 1988.
- ^ „Материјали са Рударско-геолошког факултета”. Архивирано из оригинала 10. 09. 2015. г. Приступљено 9. 4. 2013.
Спољашње везе
[уреди | уреди извор]- The internal structure of crystals... Crystallography for beginners
- Basic types of crystal structures
- Appendix A from the manual for Atoms, software for XAFS
- Intro to Minerals: Crystal Class and System
- Introduction to Crystallography and Mineral Crystal Systems
- Crystal planes and Miller indices
- Interactive 3D Crystal models
- Specific Crystal 3D models










