Нитрит
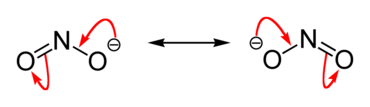
Нитрити су једињења која садрже NO2-. јон
Грађа нитрита[уреди | уреди извор]
Сви нитрити морају да садрже јон NO2-. Овај јон има исту количину и распоред електрона као и молекул озона. Од анјона NO3- који се јавља у w нитратима разликује се по томе што трећа од хибридизованих орбитала sp2 не гради везу са атомом кисеоника; молекул има облик троугла.
У процесу примања катјона метала или водоника од стране јона NO2- за грађење везе користи се један од слободних електронских парова неког атома кисеоника. У случају реакције јона NO2- нпр са атомом угљеника постоји могућност грађења везе преко слободног електронског пара азота.
Особине[уреди | уреди извор]
Неоргански нитрити су супстанције кристалног облика. Растварају се у води.[1][2] Могу да показују редукционе особине нпр:
- 2KMnO4 + 5KNO2 + 3H2SO4 → 2MnSO4 + 5KNO3 + K2SO4 + 3H2O
јонске:
- 2MnO4- + 5NO2- + 6H+ → 2Mn2+ + 5NO3- + 3H2O,
као и оксидационе, нпр према угљоводоницима метала.
Добијање[уреди | уреди извор]
Нитрити се добијају убацивањем смеше азот(II) оксида и азот(IV) оксида у растворе хидроксида или карбоната алкалних метала, нпр.
- 2NaOH + NO + NO2 → 2NaNO2 + H2O
Друга метода је редукција растопљених нитрата оловом, нпр.
- NaNO3 + Pb → NaNO2 + PbO
Неки нитрати (V) се редукују до нитрита (III) под утицајем загревања, нпр.
- 2KNO3 → 2KNO2 + O2
Извори[уреди | уреди извор]
- ^ Lide David R., ур. (2006). CRC Handbook of Chemistry and Physics (87th изд.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ Susan Budavari, ур. (2001). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (13th изд.). Merck Publishing. ISBN 0911910131.
