Карбонат
| |
| Називи | |
|---|---|
| Преферисани IUPAC назив
Карбонат | |
| Системски IUPAC назив
Триоксидокарбонат[1]:127 | |
| Идентификација | |
3Д модел (Jmol)
|
|
| ChemSpider | |
| UNII | |
| |
| |
| Својства | |
| CO2− 3 | |
| Моларна маса | 60,01 g·mol−1 |
| Конјугована киселина | Бикарбонат |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |
Карбонат је анјон (CO32-) који настаје јонизацијом карбонатне киселине (H2CO3).[4] Овај назив такође означава и сваку со која потиче од ове киселине. Карбонатни анјони врше важну функцију у физиологији живих ћелија (од регулације ацидо-базне равнотеже - хидрогенкарбонатни пуфер, преко размене гасова и других битних функција). Најпознатији карбонат у природи је калцијум карбонат, познат и као креда, кречњак и мермер. Не раствара се у води, али се зато добро раствара у киселим воденим растворима.
Термин се такође користи у глаголском облику да се опише карбонација: процес повећања концентрације карбонатних и бикарбонатних јона у води за производњу газиране воде и других газираних пића – било додавањем гаса угљен-диоксида под притиском, или растварањем карбоната или бикарбонатне соли у води.
У геологији и [mineralogy[|минералогији]], термин „карбонат” се може односити и на карбонатне минерале и на карбонатне стене (које се састоје углавном од карбонатних минерала), а у оба доминира карбонатни јон, CO2−
3. Карбонатни минерали су изузетно разноврсни и свеприсутни у хемијски преципитираним седиментним стенама. Најчешћи су калцит или калцијум карбонат, CaCO3, главни састојак кречњака (као и главна компонента шкољки мекушаца и скелета корала); доломит, калцијум-магнезијум карбонат CaMg(CO3)2; и сидерит, или гвожђе(II) карбонат, FeCO3, важна руда гвожђа. Натријум карбонат („сода” или „натрон”) и калијум карбонат („поташа”) коришћени су од антике за чишћење и конзервацију, као и за производњу стакла. Карбонати се широко користе у индустрији, као што је топљење гвожђа, као сировина за производњу портланд цемента и креча, у саставу керамичких глазура и друго.
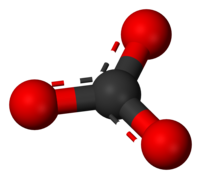
Структура и везивање
[уреди | уреди извор]Карбонатни јон је најједноставнији оксоугљенични анјон. Састоји се од једног атома угљеника окруженог са три атома кисеоника, у тригоналном планарном распореду, са D3h молекуларном симетријом. Он има молекулску масу од 60,01 g/mol и носи укупно формално наелектрисање од -2. То је конјугована база хидрогенкарбонатног (бикарбонатног)[5] јона, HCO−
3, која је конјугирана база H
2CO
3, карбоксилне киселине.
Луисова структура карбонатног јона има две (дуге) једноструке везе са негативним атомима кисеоника и једну кратку двоструку везу са неутралним кисеоником.
Ова структура је некомпатибилна са уоченом симетријом јона, што имплицира да су три везе подједнако дугачке и да су три атома кисеоника еквивалентна. Као и у случају изоелектронског нитратног јона, симетрија се може постићи резонанцом између три структуре:
Ова резонанца се може сумирати моделом са фракционим везама и делокализованим наелектрисањем:
Хемијска својства
[уреди | уреди извор]Метални карбонати се генерално разлажу при загревању, ослобађајући угљен-диоксид из дуготрајног циклуса угљеника у краткорочни циклус угљеника и остављајући за собом оксид метала.[4] Овај процес се назива калцинација, по calx, латинском називу живог креча или калцијум оксида, CaO, који се добија печењем кречњака у пећи за креч.
Карбонатна со се формира када позитивно наелектрисани јон, M+
, M2+
, или M3+
, повезује се са негативно наелектрисаним атомима јона кисеоника формирајући са њима електростатичку привлачност, формирајући јонско једињење:
- 2 M+
+ CO2−
3 → M
2CO
3
- M2+
+ CO2−
3 → MCO
3
- 2 M3+
+ 3 CO2−
3 → M
2(CO
3)
3
Већина карбонатних соли је нерастворљива у води на стандардној температури и притиску, са константом растворљивости мањим од 1×10−8. Изузеци су литијум, натријум, калијум и амонијум карбонати, као и многи уранијум карбонати.
У воденом раствору, карбонат, бикарбонат, угљен-диоксид и угљена киселина постоје заједно у динамичкој равнотежи. У јако базним условима преовладава карбонатни јон, док у слабо базним условима преовладава бикарбонатни јон. У киселијим условима, водени угљен-диоксид, CO2(aq), је главни облик, који је са водом, H2O, у равнотежи са угљен-диоксидом – равнотежа лежи снажно према угљен-диоксиду. Тако је натријум карбонат базан, натријум бикарбонат је слабо базан, док је сам угљен-диоксид слаба киселина.
Газирана вода настаје растварањем CO2 у води под притиском. Када се парцијални притисак CO2 смањи, на пример када се отвори конзерва газираног пића, равнотежа за сваки од облика карбоната (карбонат, бикарбонат, угљен-диоксид и угљена киселина) се помера све док концентрација CO2 у раствору не буде једнака растворљивости CO2 на тој температури и притиску. У живим системима ензим, карбонска анхидраза, убрзава међуконверзију CO2 и угљене киселине.
Иако су карбонатне соли већине метала нерастворљиве у води, исто не важи и за соли бикарбоната. У раствору ова равнотежа између карбоната, бикарбоната, угљен-диоксида и угљене киселине се стално мења у складу са променљивим условима температуре и притиска. У случају јона метала са нерастворљивим карбонатима, као што је CaCO3, долази до формирања нерастворљивих једињења. Ово је објашњење за накупљање каменца унутар цеви узроковано тврдом водом.
Карбонат у неорганској номенклатури
[уреди | уреди извор]Систематски адитивни IUPAC назив за карбонат анјон је триоксидокарбонат(2−).[1]:127 Слично, цијанидни анјон CN− се назива нитридокарбонат(1−).[1]:291 Међутим, пратећи исту логику за карбонат(4−) (ортокарбонска киселина), по сличности са силикатом(4−) (ортосилицијумска киселина), у систематској номенклатури адитива нема смисла јер та материја никада није идентификована под нормалним условима температуре и притиска. Ортокарбонска киселина је енергетски много мање стабилна од ортосилицијумске киселине и не може постојати у нормалним условима због енергетски неповољне орбиталне конфигурације једног централног атома угљеника везаног за четири атома кисеоника.[1]:287[6]
Органски карбонати
[уреди | уреди извор]У органској хемији карбонат се такође може односити на функционалну групу унутар већег молекула који садржи атом угљеника везан за три атома кисеоника, од којих је један двоструко везан. Ова једињења су такође позната као органокарбонати или карбонатни естри и имају општу формулу ROCOOR′, или RR′CO3. Важни органокарбонати укључују диметил карбонат, циклична једињења етилен карбонат и пропилен карбонат и замену за фосген, трифосген.[7]
Пуфер
[уреди | уреди извор]Карбонат делује као пуфер у крви на следећи начин: када је pH ниско, концентрација водоникових јона је превисока, те се издише CO2. Ово доводи до померања једначине улево, суштинског смањења концентрације H+ јона, што производи базичнији pH.
Када је pH превисоко, концентрација водоникових јона у крви је прениска, те бубрези излучују бикарбонат (HCO−
3). Ово доводи до померања једначине удесно, у суштини повећавајући концентрацију водоничних јона, узрокујући киселији pH.
Три важне реверзибилне реакције контролишу горњи pH баланс:[8]
- H2CO3 ⇌ H+ + HCO−
3 - H2CO3 ⇌ CO2 + H2O
- CO2(aq) ⇌ CO2(g)
Издахнути CO2(g) исцрпљује CO2(aq), што заузврат доводи до утрошка H2CO3, изазивајући горе поменути помак улево у првој реакцији по Ле Шатељеовом принципу. По истом принципу, када је pH превисоко, бубрези излучују бикарбонат (HCO−
3) у урин као уреа преко циклуса урее (или Кребс-Хенселејт орнитинског циклуса). Уклањањем бикарбоната, више H+ се генерише из угљене киселине (H2CO3), која долази од CO2(g) произведеног ћелијским дисањем.
Важно је нагласити да овај исти пуфер делује у океанима. Он је главни фактор климатских промена и дуготрајног циклуса угљеника, због великог броја морских организама (посебно корала) који се формирају од калцијум карбоната. Повећана растворљивост карбоната кроз повишене температуре резултира мањом производњом морског калцита и повећаном концентрацијом атмосферског угљен-диоксида. Ово, заузврат, повећава температуру Земље. Тонажа CO2−
3 је на геолошкој скали и сав може бити поново растворен у мору и испуштен у атмосферу, повећавајући нивое CO2 још више.
Присуство ван Земље
[уреди | уреди извор]Уопштено се сматра да је присуство карбоната у стени јак доказ за присуство течне воде. Недавна посматрања планетарне маглине NGC 6302 произвела су доказе о постојању карбоната у свемиру,[9] где је промена воде слична оној на Земљи мало вероватна. Предложени су и други минерали који би одговарали тим запажањима.
До недавно карбонатни депозити нису били пронађени на Марсу путем даљинског истраживања или ин ситу мисија, иако марсовски метеорити садрже мале количине. Подземне воде су можда постојале у Гусеву[10] и Меридијани Планум.[11]
Референце
[уреди | уреди извор]- ^ а б в г Међународна унија за чисту и примењену хемију (2005). Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). Cambridge (UK): Royal Society of Chemistry – IUPAC. ISBN 0-85404-438-8. Electronic version.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б Chisholm, Hugh, ур. (1911). „Carbonates”. Encyclopædia Britannica (на језику: енглески) (11 изд.). Cambridge University Press.
- ^ Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005 (PDF), IUPAC, стр. 137, Архивирано (PDF) из оригинала 2017-05-18. г.
- ^ Al-Shemali Musstafa; Boldyre Alexander I (2002). „Search for ionic orthocarbonates: Ab initio study of Na4CO4”. J. Phys. Chem. A. 106 (38): 8951—8954. Bibcode:2002JPCA..106.8951A. doi:10.1021/jp020207+.
- ^ Dr. Heiner Eckert; Dr. Barbara Forster (1987). „Triphosgene, a Crystalline Phosgene Substitute”. Angew. Chem. Int. Ed. Engl. 26 (9): 894—895. doi:10.1002/anie.198708941.
- ^ „Archived copy”. Архивирано из оригинала 2011-07-21. г. Приступљено 2010-09-05.
- ^ Kemper, F., Molster, F.J., Jager, C. and Waters, L.B.F.M. (2001) The mineral composition and spatial distribution of the dust ejecta of NGC 6302. Astronomy & Astrophysics 394, 679–690.
- ^ Squyres, S. W.; et al. (2007). „Pyroclastic Activity at Home Plate in Gusev Crater, Mars” (PDF). Science. 316 (5825): 738—742. Bibcode:2007Sci...316..738S. PMID 17478719. S2CID 9687521. doi:10.1126/science.1139045. hdl:2060/20070016011
 .
.
- ^ Squyres, S. W.; et al. (2006). „Overview of the Opportunity Mars Exploration Rover Mission to Meridiani Planum: Eagle Crater to Purgatory Ripple” (PDF). Journal of Geophysical Research: Planets. 111 (E12): n/a. Bibcode:2006JGRE..11112S12S. doi:10.1029/2006JE002771
 . hdl:1893/17165.
. hdl:1893/17165.
Спољашње везе
[уреди | уреди извор]- Carbonate/bicarbonate/carbonic acid equilibrium in water: pH of solutions, buffer capacity, titration and species distribution vs. pH computed with a free spreadsheet
- „Carbonate”. Dictionary.com. Приступљено 5. 4. 2014.
- „Carbonate”. Dictionary.com. Приступљено 5. 4. 2014.




