Degradacija masnih kiselina
Degradacija masnih kiselina je proces kojim se masne kiseline razlažu u njihove metabolite, i na kraju se formira acetil-KoA, koji je ulazni molekul za ciklus limunske kiseline, glavni izvor snabdevanja energijom kod životinja. Proces se sastoji iz tri glavna koraka:
- Lipoliza i oslobađanje iz adispoznog tkiva
- Aktivacija i transport u mitohondrije
- β-oksidacija
Lipoliza i oslobađanje[уреди | уреди извор]
Inicijalno u procesu degradacije, masne kiseline su uskladištene u masnom tkivu (adipocitima). Razlaganje te masti se naziva lipoliza.[1][2] Produkti lipolize, slobodne masne kiseline, se oslobađaju u krvotok i cirkulišu kroz telo. Tokom razlaganja triacilglicerola u masne kiseline, više od 75% masnih kiseline se konvertuje nazad triacilglicerol, što je prirodni mehanizam konzervacije energije, čak i u slučajevima gladovanja i vežbanja.
Aktivacija i transport u mitohondrije[уреди | уреди извор]
Masne kiseline moraju da budu aktivirane pre nego što se mogu preneti u mitohondrije, gde dolazi do oksidacije masnih kiselina. Ovaj proces se odvija u dva stupnja koji su katalizovani enzimom sintetaza masnokiselinskog acil-KoA.[3][4][5]
Formiranje aktivirane tioesterske veze[уреди | уреди извор]
Enzim prvo katalizuje nukleofilni napad na α-fosfat ATP molekul čime se formira pirofosfat i acilni lanac vezan za AMP. Sledeći korak je formiranje aktivirane tioestarske veze između masnokiselinskog lanca i konezima A.
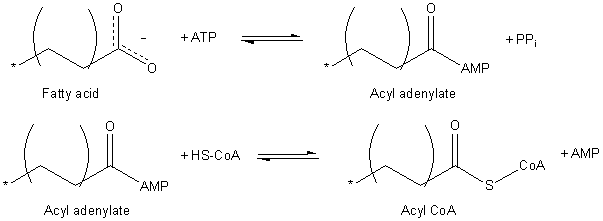
Balansirana jednačina je:
- RCOO− + CoA + ATP → RCO-CoA + AMP + PPi + 2H+
Ova dvostupna reakcija je slobodno reverzibilna i njen ekvilibrijum leži u blizini 1. Da bi reakcija napredovala, ona mora da bude spregnuta sa reakcijom jake egzergonske hidrolize: enzim neorganska pirofosfataza odvaja pirofosfat sa ATP, nastaju dva fosfatna jona, i konzumira se jedan molekul vode. Neto reakcija je:
- RCOO− + CoA + ATP + H2O → RCO-CoA + AMP + 2Pi + 2H+
Transport u mitohondrijsku matricu[уреди | уреди извор]
Unutrašnja mitohondrijska membrana je nepropusna za masne kiseline i specijalizovani karnitinski prenosni sistem obavlja operaciju transporta aktiviranih masnih kiselina iz citozola u mitohondrije.
Nakon aktivacije, acil KoA se transportuju u mitohondrijsku matricu. To se odvija putem serije jednostavnih koraka:
- Acil KoA se konjuguje sa karnitinom posredstvom karnitin aciltransferaze I (palmitoiltransferaze I) locirane na spoljašnjoj mitohondrijskoj membrani
- Acil karnitin prenosi na unutrašnju starnu translokaza
- Acil karnitin (kao što je palmitoilkarnitin) se konvertuje u acil KoA posredstvom karnitin aciltransferaze (palmitoiltransferaze II) locirane na unutrašnjoj mitohondrijskoj membrani. Oslobođeni karnitin se vraća u citozol.
Važno je da se napomene da karnitin aciltransferaze I podleže alosternoj inhibiciji dejstvom malonil-KoA, jednim od intermedijera biosinteze masne kiseline, čime se sprečava bespotrebno cirkulisanje između beta oksidacije i sinteze masnih kiselina.
Mitohondrijska oksidacija masnih kiselina se odvija u tri stupnja: 1. β-oksidacija: konverzija masnih kiselina u dvougljenične acetil KoA jedinice. 2. ulaz acetil KoA u TCA ciklus radi oslobađanja energije. 3. elektronski transportni lanac u mitohondrijama.
β-oksidacija[уреди | уреди извор]
β-oksidacija masnih kiselina se odvija u mitohondrijama u pet ponavljajućih koraka:
- Aktivacija pomoću ATP
- Oksidacija pomoću FAD,
- Hidracija,
- Oksidacija pomoću NAD+,
- Tioliza,
- Finalni produkat je acetil-KoA, koji je ulazni molekul za ciklus limunske kiseline.
Vidi još[уреди | уреди извор]
Reference[уреди | уреди извор]
- ^ Duncan, Robin E.; Ahmadian, Maryam; Jaworski, Kathy; Sarkadi-Nagy, Eszter; Sul, Hei Sook (avgust 2007). „Regulation of Lipolysis in Adipocytes”. Annual Review of Nutrition. 27 (1): 79—101. doi:10.1146/annurev.nutr.27.061406.093734.
- ^ Nielsen, TS; Jessen, N; Jørgensen, JO; Møller, N; Lund, S (jun 2014). „Dissecting adipose tissue lipolysis: molecular regulation and implications for metabolic disease.”. Journal of molecular endocrinology. 52 (3): R199—222. PMID 24577718. doi:10.1530/JME-13-0277.
- ^ PDB: 1V26; Hisanaga Y, Ago H, Nakagawa N, Hamada K, Ida K, Yamamoto M, Hori T, Arii Y, Sugahara M, Kuramitsu S, Yokoyama S, Miyano M (jul 2004). „Structural basis of the substrate-specific two-step catalysis of long chain fatty acyl-CoA synthetase dimer”. J. Biol. Chem. 279 (30): 31717—26. PMID 15145952. doi:10.1074/jbc.M400100200.
- ^ Soupene E, Kuypers FA (maj 2008). „Mammalian long-chain acyl-CoA synthetases”. Exp. Biol. Med. (Maywood). 233 (5): 507—21. PMC 3377585
 . PMID 18375835. doi:10.3181/0710-MR-287.
. PMID 18375835. doi:10.3181/0710-MR-287.
- ^ Bækdal T, Schjerling CK, Hansen JK, Knudsen J (1997). „Analysis of long-chain acyl-Coenzyme A esters”. Ур.: Christie W. Advances in Lipid Methodology (Three изд.). Ayr, Scotland: Oily Press. стр. 109—131. ISBN 978-0-9514171-7-1.
