Гликолиза

Гликолиза је процес који се састоји од низа реакција и којим се глукоза конвертује у пирогрожђану киселину и при чему се производи релативно мала количина молекула АТП-а.[1][2][3] У аеробним организмима гликолиза је праћена Кребсовим циклусом и ланцем електронског трансфера, којим се и производи највећа количина молекула АТП-а, (АТП је извор енергије коју ћелије користе). У аеробним условима, тј. у присуству кисеоника, пирогрожђана киселина улази у митохондрију, где се потпуно оксидише у угљен-диоксид и воду. Ако је количина кисеоника неадекватна, на пример као у мишићима током интезивне активности (трчање, интензивни физички рад, итд.) пирогрожђана киселина бива конвертована у млечну киселину. У анаеробним условима, у условима где кисеоник није присутан, пирогрођжана киселина се конвертује у етанол. Ова трансформације пирогрожђане киселине у етанол је пример ферментације. Алтернативни катаболички пут разградње глукозе је фосфоглуконатни пут у којем настају редукциони еквиваленти кључни за бројне анаболичке процесе.
Гликолиза је одређена секвенцом од десет реакција посредованих ензимима. Интермедијери представљају улазне тачке у гликолизу. На пример, већина моносахарида, као што су фруктоза и галактоза, могу да буду конвертовани у један о тих интермедијера. Интермедијери исто тако могу да буду директно корисни. На пример, интермедијер дихидроксиацетон фосфат (DHAP) је извор глицерола, који се комбинује са масним киселинама и формира масти.
Гликолиза је од кисеоника независтан метаболички пут. Dругим речима у њој се не користи молекуларни кисеоник (тј. атмосферски кисеоник) за било коју од њених реакција. Међутим продукти гликолизе (пируват NADH + H+) у неким случајевима бивају метаболизовани користећи атмосферски кисеоник.[4] Кад се молекулски кисеоник користи за метаболизам продуката гликолизе процес се обично сматра аеробним, док ако се кисеоник не користи, онда се за процес каже да је анаеробан.[5] Нека од варијанти гликолизе се јавља у скори свим организмима, аеробним и анаеробним. Широка заступљеност гликолизе је индикација да је она један од најстаријих метаболичких путева.[6] У ствари, реакције које сачињавају гликолизу и њен паралелни пут, пут пентоза фосфата, су се одвијале у посредству метала под бескисеоничним условима Архејских океана.[7] Могуће је да је гликолиза проистекла из хемијских ограничења пребиотичког света.
Гликолиза се одвија у већини организама у цитосолу ћелија. Најзаступљенији тип гликолизе је Ембден–Мејерхофов–Парнасов (ЕМП) пут, који су открили Густав Ембден, Ото Мајерхоф, и Јакуб Карол Парнас. Гликолиза се исто тако односи на друге путеве, као што је Ентнер-Доудорофов пут и разни хетероферментативни и хомоферментативни путеви.[8]
Целокупни гликолизни пут се може раздвојити у две фазе:[2]
- Препараторна фаза – у којој се ATP конзумира
- Фаза исплате – у којој се ATP производи.
Преглед
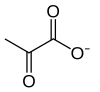
[уреди | уреди извор]Свеукупна реакција гликолизе је:
Као полазни материјал у процесу дисања, полисахариди се могу се користити тек након претходне разградње на простије шећере. Тако се скроб у ткивима за нагмнилавање енергетских резерви најпре разлаже до простих шећера, у присуству воде и ензима амилазе: скроб + n H2O → амилаза + n глукоза.
У другим ткивима, где се скроб налази само привреремено, његова хидролиза се одвија помоћу ензима фосфорилазе:
- скроб + n H3P04 → фосфорилаза + n глукозо-1-фосфат.
Топлотна енергија која се ослобађа у разградњи скроба путем фосфорилације остаје везана у фосфат-естарској вези глукоза-1-фосфата. Да би се тај спој могао укључити у гликолизу, мора се претходно претворити у пирогрожђану киселину.[9] Настала пирогрожђана киселина у анаеробнитн условима, при фементацији, подвргава се алкохолном или млечном врењу, а у аеробним условима, након активације улази у тзв. Кребсов циклус. У младим ткивима биљака глукоза се претежно разграђује у процесу гликолизе. Са старењем ткива, постепено се повећава разградња глукозе, путем њене директне оксидације.
Основни типови реакција гликолизе
[уреди | уреди извор]Гликолиза је веома важан процес без којег ћелије не би могле да функционишу. Гликолиза је такође веома сложен процес, али упознавањем основних типова рекација, и сам процес бива јаснији. Типови рекација које чине гликолизу, заједно са ензимима који катализују реакције, су:
Премештање фосфорил групе
[уреди | уреди извор]
У овој реакција, фосфорил група бива премештена са једног атома кисеоника на други у самом молекулу. Катализатор ове реакције је ензим који припада породици мутаза.
Трансфер фосфорил групе
[уреди | уреди извор]
У овој реакцији фосфорил група бива премештена са АТП молекула на међучлан гликолизе или са међучлана на АТП. Катализатор реакције припада породоци аензима киназа.
Изомеризација
[уреди | уреди извор]
При изомеризацији кетоза се конвертује у алдозу, и обрнуто, ензимом изомераза.
Дехидрација
[уреди | уреди извор]При дехидрацији молекуле воде се елиминише. Реакција је катализована од стране ензима дехидратаза.
Кидање алдол везе
[уреди | уреди извор]Веза између два угљеникова атома се кида при овој реакцији, која је катализована ензимом типа алдолазе.
Реакције гликолизе
[уреди | уреди извор]Глукоза 6-фосфат
[уреди | уреди извор]
Глукоза улази у ћелију помоћу специјалних транспортних протеина процесом олакшане дифузије и бива конвертована у глукозу-6-фосфат. Ово је могуће фосфорилацијом помоћу молекула АТП-а, тако што се врши трансфер фосфорил групе са молекула АТП-а на хидроксилну групу С-6 атома глукозе. Ова реакција је катализована ензимом хексокиназа. У хепатоцитама пак, концентрација хексокиназе није од каталитичког значаја, а у јетри ову реакцију катализује глукокиназа. Кинетика реакције је таква да се значајнији степен фосфорилације одиграва само у присуству велике концентрације супстрата што је од посебног значаја са расподелу глукозе између ћелија јетре и других ћелија организма.
Фруктоза 6-фосфат
[уреди | уреди извор]Следећи корак у гликолизи је изомеризација глукозе 6-фосфата у фруктозу 6-фосфат. Алдехид на С-1 атому реагује са хидроксил групом на С-5 атому и ствара прстен фурана. Ова изомеризација претвара молекул алдозе у кетозу, и реакција је катализована ензимом фосфоглукоза изомераза.
Фруктоза 1,6-бифосфат
[уреди | уреди извор]Још једном фосфорилацијом молекула АТП-ом, фруктоза-6-фосфат се конвертује у фруктозу-1,6-бифосфат. Ова реакција је катализована ензимом фосфофруктокиназа-1, алостерним ензимом. Фосфофруктокиназа-1 је главни регулаторни ензим гликолитичког пута па брзина остатка реакција гликолизе директно зависи од активности овог ензима, односно брзине реакције коју катализује.
Глицералдехид 3-фосфат
[уреди | уреди извор]
Цепањем фруктозе-1,6-дифосфата добијају се два једињења са по 3 угљникова атома: глицералдехид-3-фосфат и дихидроксиацетон фосфат. Цепање фруктозе 1,6-фосфата је постигнуто реакцијом коју катализује ензим алдолаза. Глицералдехид-3-фосфат је у облику који је потребан да би се наставио процес гликолизе, док дихидроксиацетон-фосфат није.
Дихидроксиацетон фосфат
[уреди | уреди извор]Дихидроксиацетон-фосфат не може да настави гликолитичку разградњу у облику у којем је, већ се мора преобратити у глицералдехид-3-фосфат. Ова два једињења, дихидроксиацетон-фосфат и глицералдехид-3-фосфат представљају изомере. Реакција изомеризације је катализована од стране ензима триоза-фосфат изомеразе, веома је брза и повратна. Под нормалним условима, равнотежа је значајно померена ка дихидроксиацетон-фосфату (његов удео у равнотежи је око 90%) али се при повећаним концентрација сусптрата односно смањеној концентрацији глицералдехид-3-фосфата, равнотежа лако помера удесно (према Ле Шатељеовом принципу).
1,3-бифосфоглицерат
[уреди | уреди извор]До овог корака, у гликолизу је већ уложена енергија у виду два молекула АТП-а. Реакције које следе су прве у гликолизи при којима се производе молекули АТП-а, и уложено враћа (тзв. pay-off фаза). Прва реакција представља конверзију глицералдехид-3-фосфата у 1,3-бифосфоглицерат, коју катализује глицералдехид-3-фосфат дехидрогеназа (скраћено GAPDH). Овом оксидо-редукцијом алдехидна група на првом угњениковом атому (С1) трансформише се у ацил-фосфат, енергетски веома богато једињење. Да би се реакција одиграла потребно је и присуство оксидационог еквивалента — NAD+ који прихвата електронски пар.
3-Фосфоглицерат
[уреди | уреди извор]Високи потенцијал трансфера фосфорил групе са 1,3-бифосфоглицерата је извор енергије за настанак молекула АТП. Фосфоглицерат киназа[10][11][12] катализује трансфер фосфорил групе са ацил-фосфата 1,3-бифосфоглицерата на АДП при чему се ослобођена енергија користи за формирање енергетски богате фосфоанхидридне везе молекула АТП. У овој реакцији фосфорилације на нивоу супстрата као производи настају 3-фосфоглицерат и први молекул АТП.
2-фосфоглицерат
[уреди | уреди извор]Реакцијом премештања фосфорил-групе конверзијом 3-фосфоглицерата добија се 2-фосфоглицерат. Реакцију катализује ензим фосфоглицерат мутаза. Механизам премештања је следећи: 2-фосфоглицерат се везује за активно место ензима при чему долази до премештања фосфорил-групе са активног места на положај 2 супстрата. Настали 2,3-дифосфоглицерат остаје у комплексу са ензимом до тренутка регенерације активног места преласком фосфорил-групе са положаја 3 назад на ензим, након чега долази до ослобађања производа конверзије — 2-фосфоглицерата. Интермедијерни 2,3-дифосфоглицерат је важан регулаторни фактор у еритроцитима (који су гликолитички активни) јер утиче на афинитет хемоглобина ка везивању кисеоника.
Фосфоенол пирогрожђане киселине
[уреди | уреди извор]Дехидрацијом 2-фосфоглицерата формира се енол. Енолаза катализује ову реакцију и за продукат има фосфоенолпируват (фосфоенол пирогрожђане киселине).
Пирогрожђана киселина
[уреди | уреди извор]У последњој реакцији гликолизе, формира се пирогрожђана киселина и истовремено се добија још један молекул АТП-а. Пируват киназа катализује ову реакцију и уједно представља последњи регулаторни ензим гликолитичког пута. За нормално одвијање реакције потребно је присуство K+ и Mg2+ јона као кофактора.
Референце
[уреди | уреди извор]- ^ Donald Voet; Judith G. Voet (2005). „Chapter 17 Glycolysis”. Biochemistry (3 изд.). Wiley. ISBN 9780471193500.
- ^ а б „Glycolysis – Animation and Notes”. Архивирано из оригинала 25. 03. 2012. г. Приступљено 18. 04. 2018.
- ^ Bailey, Regina. „10 Steps of Glycolysis”. Архивирано из оригинала 15. 05. 2013. г. Приступљено 18. 04. 2018.
- ^ Stryer, Lubert (1995). „Glycolysis.”. In: Biochemistry. (Fourth изд.). New York: W.H. Freeman and Company. стр. 483-508. ISBN 978-0-7167-2009-6.
- ^ Anderson, Douglas M., ур. (2003). Dorland’s Illustrated Medical Dictionary (30th изд.). Philadelphia, PA: Saunders. стр. 35, 71. ISBN 978-0-8089-2288-9.
- ^ Romano, AH; Conway, T (1996). „Evolution of carbohydrate metabolic pathways”. Res Microbiol. 147 (6–7): 448—55. PMID 9084754. doi:10.1016/0923-2508(96)83998-2.
- ^ Keller; Ralser; Turchyn (април 2014). „Non-enzymatic glycolysis and pentose phosphate pathway-like reactions in a plausible Archean ocean”. Mol Syst Biol. 10 (4): 725. PMC 4023395
 . PMID 24771084. doi:10.1002/msb.20145228.
. PMID 24771084. doi:10.1002/msb.20145228.
- ^ Kim BH, Gadd GM. (2011) Bacterial Physiology and Metabolism, 3rd edition.
- ^ Međedović S., Maslić E., Hadžiselimović R. (2000): Biologija 2. Svjetlost, Sarajevo, ISBN 978-9958-10-222-6.
- ^ Watson HC, Walker NP, Shaw PJ, Bryant TN, Wendell PL, Fothergill LA, Perkins RE, Conroy SC, Dobson MJ, Tuite MF (1982). „Sequence and structure of yeast phosphoglycerate kinase”. The EMBO Journal. 1 (12): 1635—40. PMC 553262
 . PMID 6765200. doi:10.1002/j.1460-2075.1982.tb01366.x.
. PMID 6765200. doi:10.1002/j.1460-2075.1982.tb01366.x.
- ^ Lay AJ, Jiang XM, Kisker O, Flynn E, Underwood A, Condron R, Hogg PJ (децембар 2000). „Phosphoglycerate kinase acts in tumour angiogenesis as a disulphide reductase”. Nature. 408 (6814): 869—73. Bibcode:2000Natur.408..869L. PMID 11130727. S2CID 4340557. doi:10.1038/35048596.
- ^ Danshina PV, Geyer CB, Dai Q, Goulding EH, Willis WD, Kitto GB, McCarrey JR, Eddy EM, O'Brien DA (јануар 2010). „Phosphoglycerate kinase 2 (PGK2) is essential for sperm function and male fertility in mice”. Biology of Reproduction. 82 (1): 136—45. PMC 2802118
 . PMID 19759366. doi:10.1095/biolreprod.109.079699.
. PMID 19759366. doi:10.1095/biolreprod.109.079699.
Спољашње везе
[уреди | уреди извор]- A Detailed Glycolysis Animation provided by IUBMB (Adobe Flash Required)
- The Glycolytic enzymes in Glycolysis at RCSB PDB
- Glycolytic cycle with animations at wdv.com
- Metabolism, Cellular Respiration and Photosynthesis - The Virtual Library of Biochemistry, Molecular Biology and Cell Biology Архивирано на сајту Wayback Machine (19. октобар 2019) at biochemweb.net
- The chemical logic behind glycolysis at ufp.pt
- Expasy biochemical pathways poster at ExPASy
- metpath: Interactive representation of glycolysis