Nervno-mišićna veza
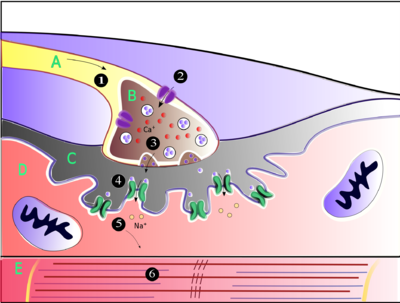
(1) akcijski potencijal stiže na vrh aksona.
(2) Prekidač koji zavisi od kalcijuma otvara „vrata“, omogućavajući kalcijumu ulazak u aksonski terminal.
(3) Osigurač neurotransmiterske vezikule sa presinapsne membrane omogućava da i acetilholin (ACh) uđe u sinapsnu pukotinu putem egzocitoze.
(4) ACh se veže za postsinapsne receptore na sarkolemi.
(5) Ova veza uzrokuje izmenu jona i otvaranje jonskih kanala i omogućava natrijevim jonima da teku kroz membranu u mišićnu ćeliju. (6) Protok natrijumovih jona kroz membranu u mišićnu ćeliju generiše akcijski potencijal koji putuje u miofibrile i rezultatira u kontrakciji mišića.
Oznake: A - Akson motornog neurona; B - Aksonski terminal. C - Sinapsna pukotina. D - Mišićne ćelije. E - Dio miofibrila
Nervno-mišićna veza (ili mionervna veza / neuromišićna veza / neuromišićni spoj) je hemijska sinapsa koja se formira u kontaktu između motornog neurona i mišićnih vlakana. To je neuromišićna spojnica koja motornom neuronu omogućava prenos signala do mišićnih vlakana, uzrokujući mišićnu kontrakciju.[1][2]
Pregled
[уреди | уреди извор]Za normalnu funkciju, mišićima je potreban odgovarajući signal, čak i za samo održavanje tonusa mišića, izbjegavajući atrofiju. Sinapsne transmisije na neuromišićnoj vezi počinju kada akcioni potencijal dostigne presinapsni terminal motornog neurona, čije aktiviranje napona zavisi od kalcijumovog kanala kako bi se jonima kalcijuma omogućio ulazak u neuron. Kalcijumovi joni se vezuju za proteine senzora (sinaptotagmin) na sinaptičkim vezikulama, što je izaziva da se one spoje sa ćelijskom membranom i naknadno oslobađaju neurotransmitere iz motornog neurona u sinapsnu pukotinu. Kod kičmenjaka, motorni neuroni otpuštaju acetilholin (ACh), malo-molekulski neurotransmiter, koji se raspršuje preko sinapsne pukotina i vezuje za nikotinski acetilholski receptor (nAChRs) na ćelijskoj membrani mišićnih vlakana, poznatoj kao sarkolema. Jonotropni receptori su nAChRs, što znači da služe kao ligand-kontrolisani jonski kanali. Vezivanje ACH za receptor može depolarizirati mišićna vlakna, uzrokujući kaskadu koja na kraju rezultira u mišićnoj kontrakciji.[3][4][1][5]
Bolesti neuromišićnih veza mogu biti genetičkog i autoimunog porijekla. Genetički poremećaja, kao što je Duchenne mišićna distrofija, mogu nastati zbog prisustva mutiranih strukturnih proteina koji čine neuromišićne veze, a autoimunske bolesti, kao što je ‘’miastenija gravis’’, nastaju kada se proizvode antitela protiv nikotinskih receptora acetilkolina na sarkolemi.
Struktura i funkcija
[уреди | уреди извор]
Neuromišićna veza ili spojnica se razlikuje od hemijskih sinapsi između neurona. Presinaptički motorni akson se završava na 30 nanometara od sarkoleme, ćelijske membrane mišićne ćelije. Ovaj 30-nanometarski prostor čini sinapsnu pukotinu kroz koju se oslobađaju signalne molekule. Sarkolema ima ulegnuće (invaginaciju) pod nazivom postsinapsni nabor, koji povećava površinu membrane izložene sinaptičke pukotina. Ovi nabori čine ono što se naziva motorna (krajnja) ploča, koji poseduju receptore nikotinskog acetilholina (nAChRs), gustoće od 10.000 receptora / mikrometar2 (u skeletnim mišićima).
Presinapsni akson ima ispupčenja zvana terminalna dugmad (ili presinapsni terminal) koji se projektuju u postveznim naborima sarkoleme. Presinapsni terminali imaju aktivne zone koje sadrže vezikule, kvanti, pune molekula acetilkolina. Ove vezikule mogu biti presinapsni osigurač membrane i ispuštati molekule ACh u sinapsnu pukotinu putem egzocitoze nakon depolarizacije. AChRs su lokalizovane na suprotnoj strani presinaptičkih terminala proteinske skele na postveznim naborima sarkoleme. Distrofin, strukturni protein, povezuje sarkomeru, sarkolemu i komponente vanćelijskog matriksa. Rapsin je još jedan protein koji prihvata AChRs i strukturne proteine u citoskeletu. Takođe je prisutan receptor tirozinske kinaze, proteina MuSK, signalni protein uključen u razvoj neuromišićnog spoja, koja se takođe održava u mestu pri rapsinu.[6][7]
Mehanizam delovanja
[уреди | уреди извор]Neuromišićne veze su onde gde neuron aktivira kontrakciju mišića. Po dolasku na akcioni potencijal u presinapsnom neuronskom terminalu, od napona zavisni kalcijumovi kanali se otvaraju i Ca2+ joni iz vanćelijske tečnosti i protiču u presinapsni neuron u citosolu. Ovaj priliv jona Ca2+ uzrokuje da sinapsne vezikule koje sadrže neurotransmiter omoguće da i osigurač dopusti prolaz kroz ćelijsku membranu presinapsnog neurona putem SNARE proteina. Fuzija mehurastih membrana rezultatira u pražnjenju presinapsne ćelijske membrane, odnosno sadržaja vezikule (sa acetilholinom) u sinapsnu pukotinu, u procesu poznatom kao egzocitoza. Acetilholin difundira u sinapsnu pukotinu i može se, na motornoj ploči, vezati za receptore nikotinskog acetilholina.
Receptori acetilholina i neuromišićna veza
[уреди | уреди извор]
2. Joni
3. Ligand (acetilholin)
Kada se ligand veže za receptor, jonski kanal receptora se otvara, što omogućava prolaz kroz ćelijsku membranu.
Acetilholin je neurotransmiter koji se sintetiše iz hrane, odnosno holina i acetil-CoA (ACoA), a učestvuje u stimulaciji mišićnog tkiva kod kičmenjaka, kao i u nekih beskičmenjaka. Kod kičmenjaka, podtip receptora acetilholina koji se nalazi na neuromišićnoj vezi skeletnih mišića je receptor nikotinskog acetilkolina (nAChR), koji je ligandom kontrolisani jonski kanal. Svaka podjedinica ovog receptora ima karakterističnu "Cis-petlju", koja se sastoji od cisteinskog ostatka u nizu od 13 aminokiselinskih i drugih cisteinskih ostataka. Dva cisteinska ostataka formiraju disulfidnu vezu, što rezultira u receptoru "Cis-petlje" koji ima sposobnost vezivanja acetilkolina i drugih liganda. Receptori Cis-petlje se mogu naći samo kod eukariota, mada prokariote poseduju ACh receptore sa sličnim svojstvima.
AChRs na skeletnim neuromišićnim vezama heteromernog oblika sastoje se od dve α, jedne β, jedne ɛ i jedne δ podjedinice. Kada se jednan ACh ligand veže za jednu od α podjedinica ACH receptora, to izaziva konformacione promene na granici s drugom ACHR α podjedinicama. Ova konformaciona promena dovodi do povećanja afiniteta druge α podjedinice za drugi ACh ligand. AChR receptori stoga ispoljavaju sigmoidnu krivu disocijacije usled združenog vezivanja. Prisustvo neaktivne, intermedijarne strukture receptora sa jednostruko vezanim ligandom drži ACh u sinapsi koji bi inače mogao biti izgubljen hidrolizom posredstvo holinesteraze ili difuzije. Zadržavanje ovih ACh liganda u sinapsi može da izazove produženi post-sinapsni odgovor.
Ne deluju sve neuromišićne veze na bazi acetilholina; činjenica je da rakovi imaju glutamatne neuromišićne veze.[8]
Razvoj neuromišićnih veza
[уреди | уреди извор]Razvoj neuromišićne veze zahteva signalizaciju iz terminala motornog neurona i iz centralne regije mišićne ćelije. Tokom razvoja, mišićne ćelije proizvode receptore acetilholina (AChRs) i ispoljavaju ih u centralnim regijama u procesu koji se zove preobrazba. Smatra se da agrin, heparinski proteoglikan, i MuSK kinaza pomažu u stabilizaciji akumulacije ACHR u centralnim delovima miocita. MuSK je receptorska tirozinska kinaza – što znači da pokreće ćelijsku signalizaciju vezivanjem molekula fosfata. Nakon aktivacije svojom ligandom agrinom, MuSK prenosi signal pomoću dva proteina pod nazivom "Dok-7" i "rapsin". Oni izazivaju grupisanje receptora acetilholina.[9]
Oslobađanjem ACh u razvoju motornih neurona dolazi do formiranja postsinapsnog potencijal u mišićnim ćelijama koje pozitivno ojačavaju lokalizaciju i stabilizaciju razvoja neuromišićne veze.[10][11]
Ovi nalazi su delom demonstrirani na miševima, putem "transgenetičkih nokaut" istraživanja. Miševi koji su deficitarni za bilo AGRIN i MuSk, ne formiraju neuromišićne veze. Nadalje, miševi s Dok-7 manjkom nisu imali ni klastere acetilholinskih receptora ili neuromišićne sinapse.[12]
Vidi još
[уреди | уреди извор]Reference
[уреди | уреди извор]- ^ а б Hunter G. K. : Vital Forces. The discovery of the molecular basis of life. Academic Press, London 2000. 2000. ISBN 978-0-12-361811-5.
- ^ Nelson D. L., Cox M. M. : Lehninger Principles of Biochemistry. W. H. Freeman and Co. 2013. ISBN 978-1-4641-0962-1.
- ^ Hall J. E., Guyton A. C. : Textbook of medical physiology, 11th edition. Elsevier Saunders, St. Louis, Mo. 2006. ISBN 978-0-7216-0240-0.
- ^ Međedović S., Maslić E., Hadžiselimović R. : Biologija 2. Svjetlost, Sarajevo. 2000. ISBN 978-9958-10-222-6.
- ^ Hadžiselimović R., Maslić E. : Osnovi etologije – Biologija ponašanja životinja i ljudi. Sarajevo Publishing, Sarajevo. 1999. ISBN 978-9958-21-091-4.
- ^ Nicholls, John G.; A. Robert Martin; Fuchs, Paul A.; Brown, David A.; Diamond, Matthew E.; Weisblat, David A. (2012). From Neuron to Brain (5th изд.). Sunderland: Sinauer Associates.
- ^ SM, Sine (2012). „End-plate acetylcholine receptor: structure, mechanism, pharmacology, and disease”. Physiol. Rev. 92 (3): 1189—234. PMC 3489064
 . PMID 22811427. doi:10.1152/physrev.00015.2011. Архивирано из оригинала 14. 12. 2019. г. Приступљено 27. 10. 2016.
. PMID 22811427. doi:10.1152/physrev.00015.2011. Архивирано из оригинала 14. 12. 2019. г. Приступљено 27. 10. 2016.
- ^ Scuka M, Mozrzymas JW (1992). „Postsynaptic potentiation and desensitization at the vertebrate end-plate receptors”. Prog. Neurobiol. 38 (1): 19—33. PMID 1736323. doi:10.1016/0301-0082(92)90033-B.
- ^ Valenzuela D, Stitt T, DiStefano P, Rojas E, Mattsson K, Compton D, Nuñez L, Park J, Stark J, Gies D (1995). „Receptor tyrosine sinase specific for the skeletal muscle lineage: expression in embryonic muscle, at the neuromuscular junction, and after injury”. Neuron. 15 (3): 573—84. PMID 7546737. doi:10.1016/0896-6273(95)90146-9.
- ^ Glass D, Bowen D, Stitt T, Radziejewski C, Bruno J, Ryan T, Gies D, Shah S, Mattsson K, Burden S, DiStefano P, Valenzuela D, DeChiara T, Yancopoulos G (1996). „Agrin acts via a MuSK receptor complex”. Cell. 85 (4): 513—23. PMID 8653787. doi:10.1016/S0092-8674(00)81252-0.
- ^ V, Witzemann (2006). „Development of the neuromuscular junction”. Cell Tissue Res. 326 (2): 263—71. PMID 16819627. doi:10.1007/s00441-006-0237-x.
- ^ Okada K, Inoue A, Okada M, Murata Y, Kakuta S, Jigami T, Kubo S, Shiraishi H, Eguchi K, Motomura M, Akiyama T, Iwakura Y, Higuchi O, Yamanashi Y (2006). „The muscle protein Dok-7 is essential for neuromuscular synaptogenesis”. Science. 312 (5781): 1802—5. PMID 16794080. doi:10.1126/science.1127142.
Literatura
[уреди | уреди извор]- Kandel, ER; JH, Schwartz; Jessell TM. (2000). Principles of Neural Science (4th изд.). New York: McGraw-Hill. ISBN 978-0-8385-7701-1.
- Nicholls, J.G.; A.R. Martin; B.G. Wallace; P.A. Fuchs (2001). From Neuron to Brain (4th изд.). Sunderland, MA.: Sinauer Associates. ISBN 978-0-87893-439-3.
- Engel, A.G. (2004). Myology (3rd изд.). New York: McGraw Hill Professional. ISBN 978-0-07-137180-3.
Spoljašnje veze
[уреди | уреди извор]- Boston University Histology Learning System: 21501lca
