Zakon o održanju mase
Zakon o održanju mase predstavlja eksperimentalno utvrđenu činjenicu da je u hemijskim reakcijama masa reaktanata jednaka masi proizvoda reakcije. S obzirom na to da u nuklearnim reakcijama i pri velikim brzinama (uporedivim sa brzinom svetlosti) dolazi do pretvaranja mase u energiju ili obrnuto, može se smatrati specijalnim slučajem zakona o održanju materije.
Uvod
[уреди | уреди извор]Površnim posmatranjem nekih procesa u prirodi (kao što su rast drveta, sagorevanje sveće ili isparavanje vode) može se doći do ubeđenja da materija može nastati i nestati. Međutim pažljivim posmatranjem može se utvrditi da ovo nije slučaj. Materija može da promeni svoj oblik, agregatno stanje i sl. ali ne može nastati ni iz čega ili nestati.
A. L. Lavoazije (Lavoisier) je 1774. u eksperimentu u kome je zagrevao kalaj sa vazduhom u zatvorenom sudu primetio da je težina celog sistema ista pre i posle kalcinacije. Ovim je dokazano da sistem nije dobio ni izgubio na težini. Ovaj eksperiment je ukazao na činjenicu da nema pre i posle reakcije nema promene količine materije.
Kako je Lomonosov formulisao sličnu pravilnost nešto ranije (1748. ili 1756), zakon se ponekad zove i Lavoazje-Lomonosovljev zakon.
Ovaj zakon može da se definiše:
Ukupna masa supstanci koje ulaze u reakciju jednaka je ukupnoj masi proizvoda reakcije. Ako A i B predstavljaju mase dveju supstanci koje učestvuju u nekoj hemijskoj reakciji pri kojoj nastaju mase C i D drugih dveju (hemijski promenjenih) supstanci, zakon o održanju mase se može izraziti kao:
A+B = C+D
Ovaj zakon se ponekada i naziva zakon o neuništivosti materije.
Eksperimentalna potvrda
[уреди | уреди извор]H. Landolt (1893) i A. Heydweiller (1901) su izvršili eksperimente da bi potvrdili tačnost ovog zakona. Iz ovih eksperimenata su zaključili da postoji malo odstupanje u ukupnim masama ali da su navedena odstupanja u okviru eksperimentalne greške.
J. J. Maley je 1912. godine upotrebio vagu koja je bila znatno usavršena da bi se otklonio nedostatak gore navedenih eksperimenata. On je uspeo da dokaže da u slučaju reakcije između barijumhlorida i natrijumsulfata, svaka promena u masi mora biti manja od jednog milionitog dela.
Masa – energija konverzija
[уреди | уреди извор]Kada se govori o ovom zakonu mora se primetiti da prema teoriji relativiteta materija (kao oblik energije) i energija mogu prelaziti jedna u drugu, u međusobnom odnosu koji je definisan poznatom Ajnštajnovom jednačinom:
E = mc2
gde je
E - oslobođena ili apsorbovana energija
m - gubitak ili dobitak mase
c – brzina svetlosti
Drugim rečima, umesto dva fundamentalna zakona: zakona o održanju mase i zakona o držanju energije, postoji samo jedan princip.
Pri bilo kojoj hemijskoj promeni koja je praćena promenom temperature, vršiće se i odgovarajuća promena mase. To znači da se pri hemijskoj promeni vrši promena mase, ali ako se uzme u obzir visoka vrednost c, gubitak mase izuzetno nizak i prema tame zakon o održanju mase kao što je gore naveden može se uzeti kao tačan za sva eksperimentalna merenja.
Formulacija i primeri
[уреди | уреди извор]Zakon održanja mase može se formulisati samo u klasičnoj mehanici kada su energetske skale povezane sa izolovanim sistemom mnogo manje od , gde je masa tipičnog objekta u sistemu, merena u referentnom okviru gde objekat miruje, a je brzina svetlosti.
Zakon se može matematički formulisati u oblastima mehanike fluida i mehanike kontinuuma, gde se očuvanje mase obično izražava pomoću jednačine kontinuiteta, date u diferencijalnom obliku kao
gde je gustina (masa po jedinici zapremine), je vreme, je divergencija, i je polje brzine protoka. Tumačenje jednačine kontinuiteta za masu je sledeće: Za datu zatvorenu površinu u sistemu, vremenska promena mase zatvorene površinom jednaka je masi koja prelazi preko površine, pozitivna ako materija ulazi i negativna ako materija se izlazi. Za ceo izolovani sistem, ovaj uslov podrazumeva da se ukupna masa , zbir masa svih komponenti u sistemu, ne menja u vremenu, i.e.
,
gde je diferencijal koji definiše integral preko celog vremena sistema.
Jednačina kontinuiteta za masu je deo Ojlerovih jednačina dinamike fluida. Mnoge druge jednačine konvekcije-difuzije opisuju očuvanje i protok mase i materije u datom sistemu.
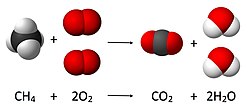
U hemiji, izračunavanje količine reaktanata i proizvoda u hemijskoj reakciji, ili stehiometrija, zasniva se na principu očuvanja mase. Princip podrazumeva da je tokom hemijske reakcije ukupna masa reaktanata jednaka ukupnoj masi proizvoda. Na primer, u sledećoj reakciji
- CH
4 + 2 O
2 → CO
2 + 2 H
2O,
gde se jedan molekul metana (CH
4) i dva molekula kiseonika O
2 pretvaraju u jedan molekul ugljen-dioksida (CO
2) i dva molekula vode (H
2O). Broj molekula kaji je rezultat reakcije može se izvesti iz principa očuvanja mase, pošto su u početku prisutna četiri atoma vodonika, 4 atoma kiseonika i jedan atom ugljenika (kao i u konačnom stanju), zatim broj molekula proizvedene vode mora biti tačno dva po proizvedenom molekulu ugljen-dioksida.
Istorija
[уреди | уреди извор]

Još 520. godine pre nove ere, džainska filozofija, nekreacionistička filozofija zasnovana na učenju Mahavire,[4] navodi da se univerzum i njegovi sastojci kao što je materija ne mogu uništiti ili stvoriti. Džainski tekst Tatvartasutra (2. vek nove ere) navodi da je supstanca trajna, ali njene modove karakteriše stvaranje i uništavanje.[5]
Važna ideja u antičkoj grčkoj filozofiji bila je da „Ništa ne dolazi iz ničega“, tako da je ono što sada postoji uvek postojalo: nijedna nova materija ne može nastati tamo gde je ranije nije bilo. Eksplicitna izjava ovoga, zajedno sa daljim principom da ništa ne može preći u ništa, nalazi se kod Empedokla (oko 4. veka pre nove ere): „Nemoguće je da bilo šta nastane iz onoga što nije, i ne može biti izvedeno ili tvrđeno da ono što jeste može biti potpuno uništeno.“[6]
Dalji princip očuvanja izneo je Epikur oko 3. veka pre nove ere, koji je, opisujući prirodu univerzuma, napisao da je „sveukupnost stvari uvek bila takva kakva je sada, i uvek će biti“.[7]
Princip očuvanja materije takođe je naveo Hadže Nasirudin Tusi (oko 13. veka nove ere). On je napisao da „telo materije ne može potpuno nestati. Ono samo menja svoj oblik, stanje, sastav, boju i druga svojstva i pretvara se u drugu složenu ili elementarnu materiju”.[8]
Otkrića u hemiji
[уреди | уреди извор]Do 18. veka princip očuvanja mase tokom hemijskih reakcija bio je naširoko korišćen i bio je važna pretpostavka tokom eksperimenata, čak i pre nego što je definicija formalno uspostavljena,[9] kao što se može videti u radovima Džozefa Bleka, Henrija Kevendiša i Žana Reja.[10] Prvi koji je izložio princip bio je Mihail Lomonosov 1756. On je to uspeo da demonstrira eksperimentima i vodio je diskusije o principu 1748. u prepisci sa Leonardom Ojlerom,[11] iako se njegov doprinos u ovoj oblasti ponekad osporava.[12][13] Prema rečima sovjetskog fizičara Jakova Dorfmana:
Univerzalni zakon koji je Lomonosov formulisao na osnovu opštih filozofsko-materijalističkih razmatranja, on nikada nije dovodio u pitanje, niti proveravao, već mu je, naprotiv, služio kao solidna polazna pozicija u svim istraživanjima tokom njegovog života.[14]
Rafiniraniju seriju eksperimenata je kasnije izveo Antoan Lavoazje koji je svoj zaključak izneo 1773. i popularizovao princip očuvanja mase. Demonstracije principa su opovrgle tada popularnu teoriju flogistona koja je tvrdila da se masa može dobiti ili izgubiti u procesima sagorevanja i razmene toplote.
Prateći pionirski rad Lavoazjea, iscrpni eksperimenti Žana Stasa podržali su doslednost ovog zakona u hemijskim reakcijama,[15] iako su sprovedeni sa drugim namerama. Njegovo istraživanje[16][17] je pokazalo da u određenim reakcijama gubitak ili dobitak nije mogao biti veći od 2 do 4 dela na 100.000.[18] Razlika u preciznosti koju je imao za cilj i ostvario Lavoazije, s jedne strane, i Morli i Stas, s druge strane, ogromna je.[19]
Reference
[уреди | уреди извор]- ^ Volkenstein, Mikhail V. (2009). Entropy and Information (illustrated изд.). Springer Science & Business Media. стр. 20. ISBN 978-3-0346-0078-1. Extract of page 20
- ^ Okuň, Lev Borisovič (2009). Energy and Mass in Relativity Theory. World Scientific. стр. 253. ISBN 978-981-281-412-8. Extract of page 253
- ^ Lewis, David (2012). Early Russian Organic Chemists and Their Legacy (illustrated изд.). Springer Science & Business Media. стр. 29. ISBN 978-3-642-28219-5. Extract of page 29
- ^ Mahavira is dated 598 BC - 526 BC. See. Dundas, Paul; John Hinnels (2002). The Jains. London: Routledge. ISBN 978-0-415-26606-2. p. 24
- ^ Devendra (Muni.), T. G. Kalghatgi, T. S. Devadoss (1983) A source-book in Jaina philosophy Udaipur:Sri Tarak Guru Jain Gran. p.57. Also see Tattvarthasutra verses 5.29 and 5.37
- ^ Fr. 12; see pp.291–2 of Kirk, G. S.; J. E. Raven; Malcolm Schofield (1983). The Presocratic Philosophers (2 изд.). Cambridge: Cambridge University Press. ISBN 978-0-521-27455-5.
- ^ Long, A. A.; D. N. Sedley (1987). „Epicureanism: The principals of conservation”. The Hellenistic Philosophers. Vol 1: Translations of the principal sources with philosophical commentary. Cambridge: Cambridge University Press. стр. 25—26. ISBN 978-0-521-27556-9.
- ^ Farid Alakbarov (Summer 2001). A 13th-Century Darwin? Tusi's Views on Evolution, Azerbaijan International 9 (2).
- ^ Whitaker, Robert D. (1975-10-01). „An historical note on the conservation of mass”. Journal of Chemical Education. 52 (10): 658. Bibcode:1975JChEd..52..658W. ISSN 0021-9584. doi:10.1021/ed052p658.
- ^ Robert D. Whitaker, "An Historical Note on the Conservation of Mass", Journal of Chemical Education, 52, 10, 658-659, Oct 75
- ^ Pismen, Len (2018). The Swings of Science: From Complexity to Simplicity and Back. Springer. стр. 41. ISBN 978-3-319-99777-3.
- ^ Pomper, Philip (октобар 1962). „Lomonosov and the Discovery of the Law of the Conservation of Matter in Chemical Transformations”. Ambix. 10 (3): 119—127. doi:10.1179/amb.1962.10.3.119.
- ^ Lomonosov, Mikhail Vasil’evich (1970). Mikhail Vasil'evich Lomonosov on the Corpuscular Theory. Henry M. Leicester (trans.). Cambridge, Mass.: Harvard University Press. Introduction, p. 25.
- ^ Дорфман, Яков (1961). Закон сохранения массы при химических реакциях и физические воззрения Ломоносова // Ломоносов М.В. Сборник статей и материалов, T.5. http://gidropraktikum.narod.ru/Lomonosov-Dorfman.djvu: М.-Л.: Издательство АН СССР. стр. 193.
- ^ Matthew Moncrieff Pattison Muir, The Elements of Chemistry (1904)
- ^ Nouv. Recherches sur les lois des proportions chimiques (1865) 152, 171, 189
- ^ "Conservation of Mass in Chemical Changes"Journal - Chemical Society, London, Vol.64, Part 2 Chemical Society (Great Britain)
- ^ William Edwards Henderson, A Course in General Chemistry (1921)
- ^ Ida Freund, The study of Chemical Composition: an account of its method and historical development, with illustrative quotations (1904)
Literatura
[уреди | уреди извор]- Molerova moderna neorganska hemija, popravljeno izdanje G. D. Parkersa, četrvto neizmenjeno izdanje, Naučna knjiga, Beograd 197
- Silagadze, Z. K. (2008), „Relativity without tears”, Acta Physica Polonica B, 39 (4): 811—885, Bibcode:2008AcPPB..39..811S
 , arXiv:0708.0929
, arXiv:0708.0929 
- Oas, Gary (2005), „On the Abuse and Use of Relativistic Mass”, arXiv:physics/0504110

- Max Jammer (1997), Concepts of Mass in Classical and Modern Physics, Courier Dover Publications, стр. 177—178, ISBN 978-0-486-29998-3
Spoljašnje veze
[уреди | уреди извор]- Usenet Physics FAQ
- "Does mass change with velocity?" by Philip Gibbs et al., 2002, retrieved August 10, 2006
- "What is the mass of a photon?" by Matt Austern et al., 1998, retrieved June 27, 2007
- Mass as a Variable Quantity Архивирано на сајту Wayback Machine (16. јул 2015)











