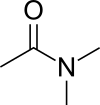
Диметилацетамид
| |

| |
| Nazivi | |
|---|---|
| IUPAC naziv
N,N-Dimetilacetamid[1]
| |
| Identifikacija | |
3D model (Jmol)
|
|
| Abrevijacija | DMAc[2] |
| Bajlštajn | 1737614 |
| ChemSpider | |
| ECHA InfoCard | 100.004.389 |
| EC broj | 204-826-4 |
| MeSH | dimethylacetamide |
| RTECS | AB7700000 |
| UNII | |
| |
| Svojstva | |
| C4H9NO | |
| Molarna masa | 87,12 g·mol−1 |
| Agregatno stanje | Bezbona tečnost |
| Miris | Amoniacal |
| Gustina | 937 mg mL−1 |
| Tačka topljenja | −20 °C (−4 °F; 253 K) |
| Tačka ključanja | 4.109 °C; 7.428 °F; 4.382 K |
| Meša se | |
| log P | −0,253 |
| Napon pare | 300 Pa |
| λmax | 270 nm |
| Apsorbancija | 1,00 |
| Indeks refrakcije (nD) | 1,4375 |
| Viskoznost | 1,956 mPa s |
| Termohemija | |
| Specifični toplotni kapacitet, C | 178,2 J K−1 mol−1 |
Std entalpija
formiranja (ΔfH⦵298) |
−300,1 kJ mol−1 |
| Std entalpija sagorevanja ΔcH |
−2,5835–−2.5805 MJ mol−1 |
| Opasnosti | |
| GHS grafikoni |  
|
| GHS signalna reč | Opasnost |
| H312, H332, H360 | |
| P280, P308+313 | |
EU klasifikacija (DSD)
|
|
| R-oznake | R61, R20/21 |
| S-oznake | S45 |
| NFPA 704 | |
| Tačka paljenja | 63 °C |
| 490 °C (914 °F; 763 K) | |
| Eksplozivni limiti | 1,8–11,5% |
| Letalna doza ili koncentracija (LD, LC): | |
LD50 (LD50)
|
|
| Srodna jedinjenja | |
Srodna jedinjenja
|
|
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Dimetilacetamid (DMA) je organsko jedinjenje sa formulom CH3C(O)N(CH3)2. Ovo bezbojno jedinjenje se meša sa vodom. Ono ima visoku tačku ključanja. Koristi se kao polarni rastvarač u organskoj sintezi. DMA se meša sa većinom drugih rastvarača, mada je slabo rastvoran u alifatičnim ugljovodonicima.
Sinteza, reakcije, primena[уреди | уреди извор]
DMA se priprema reakcijom dimetilamina sa anhidridom sirćetne kiseline i estrima sirćetne kiseline. Dehidracija soli dimetilamina i sirćetne kiseline je alternativni sintetički put:[5]
- CH3CO2-N(CH3)2H2 → H2O + CH3CON(CH3)2
Hemijske reakcije dimetilacetamida su tipične za N,N-disupstituisane amide. On se hidroluje u prisustvu kiselina:
- CH3CON(CH3)2 + H2O + HCl → CH3COOH + (CH3)2NH2+Cl-
On je otporan na baze. Iz tog razloga je DMA koristan rastvarač za reakcije u kojima učestvuju jake baze poput natrijum hidroksida.[6]
Reference[уреди | уреди извор]
- ^ „dimethylacetamide - Compound Summary”. PubChem Compound. USA: National Center for Biotechnology Information. 26. 3. 2005. Identification. Приступљено 19. 4. 2012.
- ^ Munro, D. D.; Stoughto, R. B. (1965). „Dimethylacetamide (DMAC) and Dimethylformamide (DMFA). Effect on Percutaneous Absorption”. Archives of Dermatology. 92 (5): 585—586. PMID 5844405. doi:10.1001/archderm.1965.01600170101020.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Cheung, H.; Tanke, R. S.; Torrence, G. P. (2005). „Acetic Acid”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a01_045.pub2.
- ^ Zen, S.; Kaji, E. (1977). „Dimethyl nitrosuccinate”. Org. Synth. 57: 60.; Coll. Vol., 6, стр. 503

