Estar

Estri (nem. Essig-Äther, što je stari naziv za etil-etanoat) organska su jedinjenja koja u svojim molekulima sadrže ostatak molekula kiseline i ostatak molekula alkohola.[1] Estri daju miris voću, povrću i četinarima. Njihova opšta formula je: CnH2n+1-COO-CnH2n+1. Estri dobijaju nazive u zavisnosti od toga koji je alkohol i koja kiselina izreagovala. Ako je recimo, reagovao etanol i etanska kiselina, dobija se estar koji se naziva etil-etanoat ili etil-acetat. Taj naziv je izveden od etil-grupe alkohola i naziva soli etanske kiseline. Soli etanske kiseline se nazivaju etanoati ili acetati.
- CH3-COOH + CH3-CH2-OH → CH3-COO-CH2-CH3 + H2O
Estri se dobijaju u reakciji esterifikacije. Ta se reakcija odvija u kiseloj sredini. Suprotna reakcija esterifikaciji je hidroliza. U toj reakciji se dobijena voda iz esterifikacije jedini sa estrom koji je dobijen i daje polazne supstance: alkohol i kiselinu.
- CH3-COO-CH2-CH3 + H2O → CH3-COOH + CH3-CH2-OH
Koriste se u prehrambenoj industriji za proizvodnju veštačkih mirisa, kao rastvarači boja, lakova i kao sirovina za dobijanje veštačkih vlakana. Jedan od najpoznatijih estara je nitroglicerin, koji se dobija reakcijom trovalentnog alkohola glicerola i azotne kiseline, uz prisustvo sumporne kiseline.[2][3][4]
Struktura i vezivanje[уреди | уреди извор]
Estri sadrže karbonilni centar, koji ima strukturne motive C-C-O i O-C-O sa uglovima između veza od 120°. Za razliku od amida, estri su strukturno fleksibilne funkcionalne grupe jer rotacija oko C-O-C veza ima nisku barijeru. Njihova fleksibilnost i niska polarnost se manifestuje u njihovim fizičkim osobinama. Oni su manje rigidni (imaju nižu tačku topljenja) i isparljiviji su (niža tačka ključanja) od odgovarajućih amida.[5] pKa vrednosti alfa-vodonika estera je oko 25.[6]
Imenovanje[уреди | уреди извор]
Imenovanje estera se bazira na nazivu alkohola koji je stupio u reakciju tj. prvo ide naziv alkilne skupine alkohola (npr. naziv alkilne skupine propanola je propil). Drugim riječima, umjesto uobičajenog završetka -anol na osnovu imena alkohola doda se nastavak -il. Druga riječ u nazivu estera potiče od kiseline, a tvori se tako da se imenu kiseline oduzme nastavak -ska i doda nastavak -oat (npr., druga riječ u imenu estera butanske kiseline bila bi butanoat). Kod estera sa etanskom kiselinom, često se umjesto etanoata upotrebljava: acetat, kod onih sa metanskom kiselinom: formijat, kod estera sa butanskom kiselinom: butirat, a kod propanske kiseline: propionat. Kod alkohola također postoje drugi nazivi pa se tako umjesto pentil, često nađe i amil: alkohol (-ol → -il) + karboksilne kiseline (-ska → -oat)
IUPAC-ova nomenklatura[уреди | уреди извор]
Esterska imena izvedena su iz naziva matičnog alkohola i roditeljske kiseline, gde ova može biti organska ili neorganska. Estri izvedeni iz najjednostavnijih karboksilnih kiselina se obično zove prema tradicijskim, takozvanim trivijalnim nazivima, npr. kao format, acetat, propionat, i butirat, za razliku od IUPAC-ove nomenklature: metanoat, etanoat, propanoat i butanoat. Estri izvedeni iz kompleksnijih karboksilnih kiselina su, s druge strane, češće pod nazivom koji koristi sistematski naziv po IUPAC-u, na osnovu imena za kiselinu zatim dolazi sufiks –oat. Na primer, ester-heksiloktanoat, poznat i pod trivijalnim imenom heksil-kaprilat, ima formulu CH3(CH2)6CO2(CH2)5CH3.
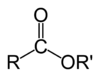
Hemijske formule organskih estera obično imaju oblik RCO2R', gde su R i R' delovi ugljikovodika iz karboksilne kiseline i alkohola. Na primer, butil acetat (sistematski butil-etanoat), izveden iz butanola i acetatne kiseline (sistematski etanska kiselina) se piše kao CH3CO2C4H9. Alternativno prikazivanje obično uključuje BuOAc i CH3COOC4H9. Ciklični estri se zovu laktoni, bez obzira na to da li su izvedeni iz organske ili neorganske kiseline. Jedan primer (organskog) laktona je γ-valerolakton.
Ortoestri[уреди | уреди извор]
Neuobičajena klasa organskih estera su ortoesteri, koji imaju formulu RC(OR′)3. Trietilortoformat (HC(OC2H5)3) je izvedenica, u smislu imena (ali ne i sinteze) iz ortomravlje kiseline (HC(OH)3) i etanola.
Neorganski estri[уреди | уреди извор]

Esteri mogu takođe da budu izvedeni iz neorganskih kiselina i alkohola. Dakle, nomenklatura se proteže na neorganske oksokiseline i njihove odgovarajuće estre: fosforna kiselina i fosfatni ester/organofosfati, sumporna kiselina i sulfatni ester/organosulfati, azotna kiselina i nitrat, borna kiselina i borati. Na primer, trifenil fosfat je ester izveden iz fosforne kiseline i fenola. Organski karbonati su izvedeni iz ugljene kiseline; na primer, etilen karbonat je izveden iz ugljene kiseline i etilen glikola.



Alkohol i neorganska kiselina povezivani su preko atoma kiseonika. Definicija estera neorganske kiseline koji imaju vezu neorganskih hemijskih elemenata između alkohola i neorganske kiseline – vezanje atoma fosfor i tri alkoksi funkcionalne grupe u organofosfatima – može se proširiti na iste elemente u raznim kombinacijama kovalentne veze između ugljenikovih i centralnog neorganskog atoma i vezi ugljenik-kiseonik, sa centralnim neorganski atomima. Na primer, fosforna svojstva tri veze ugljenik-kiseonik-fosfor i jednu dvostruku vezu fosfor-kiseonik u organofosfatima, tri veze ugljenik–kiseonik–fosfor i nijednu dvostruku vezu fosfor–kiseonik u fosfitni esterima ili organofosfitima, dve veze ugljenik–kiseonik–fosfor, nijedna fosfor–kiseonik dvostruka veza, ali jedna veza fosfor–ugljenik u fosfonitima, jedna veza ugljenik–kiseonik–fosfor, nijedna dvostruka veza fosfor–kiseonik, ali dve veze fosfor–ugljenik u fosfonitima.

Kao posledica, funkcije bora je stvaranje bornih estara (n = 2), boronskih estara (n = 1) i borata (n = 0). Kiseonik je hemijski element grupe 16, a atomi sumpora mogu zameniti neke atome kiseonika u ugljenik–kiseonik centralnom neorganskom atomu kovalentnih veza estera. Kao rezultat, stvaraju se tiosulfinati i tiosulfonati, sa centralnin neorganskim atomom sumpora, jasno pokazujući asortiman sumpornih estera, koji uključuju i sulfatne, sulfitne, sulfonatne, sulfinatne i sulfenatne estere.
Triacilglicerol[уреди | уреди извор]

Triacilgliceroli (masti i ulja) su estri koji sadrže tri hidroksilne grupe. Imenuju se slično kao i soli. Nerastvorni su ili slabo rastvorni u vodi (lipidi).
Estri se mogu dobiti reakcijom, obično organskih, kiselina i alkohola, uz katalitsko prisustvo sumporne kiseline, iako ima i drugih načina dobijanja estera. Esterifikacija je reverzibilna reakcija u kojoj se istovremeno događa i hidroliza, pa je potrebno higroskopno sredstvo koje reakciji oduzima vodu.
- Alkoholi + karboksilne kiseline ↔ ester + voda (esterifikacija)
- Ester + voda ↔ alkoholi + karboksilne kiseline (hidroliza)
Mnogi estri imaju specifičan miris, zbog čega se često koriste kao veštačke arome i u proizvodnji mirisa. Na primer:
- metil butanoat – ananas, jabuka;
- metil benzoat – voćni miris jilang-jilang;
- etil formijat – rum;
- etil butanoat – ananas, jagoda;
- etil heptanoat – grožđe;
- etil acetat - staro vino;
- amil acetat - banana, kruška.
Metil formijat[уреди | уреди извор]
Metil metanoat je bezbojna tečnost karakterističnog eterskog mirisa, lako ispariva, sa malim površinskim naponom.
- C2H4O2O=COC
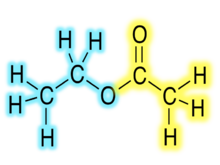
Etil acetat / etil etanoat[уреди | уреди извор]
Ovo je bezbojna, lako zapaljiva tečnost karakterističnog mirisa, poput lepka ili sredstava za skidanje laka za nokte (C4H8O2, CC(=O)OCC ili CH3COOCH2CH3). Etil acetat je zapaljiv i kožni iritant.
Dobijanje estera[уреди | уреди извор]
Esteri se dobijaju pri sintezi sirćetne kiseline i etanola, uz prisustvo jakih kiselina kao što je sumporna kiselina.
- CH3CH2OH + CH3COOH → CH3COOCH2CH3 + H2O
Dobijaju se:
- esterifikacijom metanola i etanoata: HCOOH + CH3OH → HCOOCH3 + H2O
- industrijski kombinacijom metanola i ugljen monoksida: CH3OH + CO → HCOOCH3.
Upotreba[уреди | уреди извор]
Estri se između ostalo koriste:
- kao otrov za ubijanje insekata (za prepariranje u entomologiji: insekt se ubije, ali se ne uništi)
- u lepkovima i odstranjivačima laka za nokte
- kao reagens za određivanje angiotenzin konvertirajućeg enzima (ACE)
Estri se obično upotrebljavaju u prehrambenoj i konditorskoj industriji, proizvodnji rastvarača i plastičnih masa, i proizvodnju parfema. Upotrebljava se i kao insekticid i u proizvodnji nekih lekova.
Esterski mirisi[уреди | уреди извор]
Reference[уреди | уреди извор]
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Hunter G. K. (2000): Vital Forces. The discovery of the molecular basis of life. . London: Academic Press. 2000. ISBN 978-0-12-361811-5.
- ^ Nelson D. L., Cox M. M. (2013): Lehninger Principles of Biochemistry. . W. H. Freeman and Co. ISBN 978-1-4641-0962-1.
- ^ Hall J. E., Guyton A. C. (2006): Textbook of medical physiology, 11th edition. Elsevier Saunders, St. Louis, Mo. ISBN 978-0-7216-0240-0.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ Chemistry of Enols and Enolates - Acidity of alpha-hydrogens