Amid


Amid[1][2] je organsko jedinjenje koje sadrži funkcionalnu grupu RnE(O)xNR′2 (R i R′ se odnose na H ili organske grupe). Najčešći su karboksamidi (organski amidi) (n = 1, E = C, x = 1), mada su poznati mnogi drugi značajni tipovi amida, uključujući fosforamide (n = 2, E = P, x = 1 i mnoge srodne formule) i sulfonamidi (E = S, x = 2).[3] Termin amid se odnosi na klase jedinjenja i na funkcionalne grupe (RnE(O)xNR′2) unutar tih jedinjenja.[4]
Termin amid takođe može da označava deprotonisanu formu amonijaka (NH3) ili amina, često predstavljenih kao anjoni R2N-. Ostatak ovog članka razmatra amid u karbonilno-azotnom smislu.
Zbog dvostruke upotrebe reči amid, raspravlja se o tome kako da se pravilno i nedvosmisleno imenuju izvedene anjoni amida (tj. deprotonisani acilovani amini), od kojih se neki uobičajeno koriste kao nereaktivni konjugovani joni.[5]
Ostatak ovog članka govori amidima u karbonil-azotnom smislu.
Struktura i vezivanje[уреди | уреди извор]
Najjednostavniji amidi su derivati amonijaka u kojima je atom vodonika zamenjen acil grupom (RC(O)NH2). Blisko srodni, i znatno brojniji, su amidi izvedeni iz primarnih amina (R'NH2) sa formulom RC(O)NHR'. Amidi su takođe često izvedeni iz sekundarnih amina (R'RNH) te je njihova formula RC(O)NR'R. Amidi se obično smatraju derivatima karboksilnih kiselina u kojima je hidroksilna grupa zamenjena aminom ili amonijakom.
Slobodni elektronski par azota je delokalizovan na karbonilnu grupu, čime se formira parcijalna dvostruka veza između N i karbonilnog ugljenika. Konsekventno azot u amidima nije piramidan. Procenjuje se da je acetamid opisan rezonantnom strukturom A sa 62% i B sa 28%, (što ne iznosi 100% jer postoje dodatni rezonantni oblici koji nisu prikazani na gornjoj slici). Isto tako treba imati na umu pri posmatranju amidnih veza da postoji i vodonička veza između vodoničnih i azotnih atoma aktivnih grupa.[6]
Nomenklatura[уреди | уреди извор]
U uobičajenoj nomenklaturi, termin „amid” se dodaje na koren imena kiseline. Tako se, najjednostavniji amid sirćetne kiseline naziva acetamid (CH3CONH2). IUPAC preporuka je etanamid, mada se ovo i srodna formalna imena retko koriste. Kad je amid izveden iz primarnog ili sekundarnog amina, supstituenti na azotu se stavljaju na početak imena. Amid formiran od dimetilamina i sirćetne kiseline je N,N-dimetilacetamid (CH3CONMe2, gde je Me = CH3). Uobičajeno je da se ovo ime dalje pojednostavi kao dimetilacetamid. Ciklični amidi se nazivaju laktamima; oni su sekundarni ili tercijarni amidi. Funkcionalne grupe koje sadrže -P(O)NR2 i -SO2NR2 su fosfonamidi i sulfonamidi, respektivno.[7]
Osobine[уреди | уреди извор]
Bazičnost[уреди | уреди извор]
U poređenju sa aminima, amidi su veoma slabe baze. Dok konjugovana kiselina amina ima pKa od oko 9,5, konjugovana kiselina amida ima pKa oko -0,5. Zbog toga amidi nemaju jasno uočljiva kiselo-bazna svojstva u vodi. Ovaj relativni nedostatak baznosti objašnjava se karbonilnom grupom koja povlači elektrone, dok je slobodni par elektrona na azotu delokalizovan rezonancijom. S druge strane, amidi su mnogo jače baze od karboksilnih kiselina, estera, aldehida i ketona (pKa vrednosti njihovih konjugovanih kiselina su između -6 i -10). Procenjuje se da je acetamid predstavljen rezonantnom strukturom A tokom 62% vremena, a B tokom 28%.[6] Rezonanca se u velikoj meri sprečava u vrlo napregnutom kvinuklidonu.
Zbog veće elektronegativnosti kiseonika, karbonil (C=O) je jači dipol od N-C dipola. Prisustvo C=O dipola i u manjoj meri N-C dipola omogućava amidima da deluju kao akceptori H-veze. U primarnim i sekundarnim amidima prisustvo N-H dipola omogućava amidima da funkcionišu i kao donori H-veze. Tako amidi mogu učestvovati u vodoničnom vezivanju sa vodom i drugim protičnim rastvaračima; atom kiseonika može da prihvati vodonične veze iz vode, a N–H atomi vodonika mogu da doniraju H-veze. Kao rezultat interakcija poput ovih, rastvorljivost u amida u vodi je veća nego u odgovarajućim ugljovodonicima.
Proton primarnog ili sekundarnog amida se ne disocira lako pod normalnim uslovima; njegov pKa je obično znatno iznad 15. Nasuprot tome, pod ekstremno kiselim uslovima, karbonilni kiseonik može da bude protonisan sa pKa od oko -1. To nije samo zbog pozitivnog naboja na azotu, već i zbog negativnog naboja kiseonika nastalog rezonancom.
Rastvoriljivost[уреди | уреди извор]
Rastvorljivost amida i estera je slična. Tipično su amidi manje rastvorljivi od uporedivih amina i karboksilnih kiselina, jer ta jedinjenja mogu davati i prihvatiti vodonične veze. Tercijarni amidi, sa važnim izuzetkom N,N-dimetilformamida, pokazuju nisku rastvorljivost u vodi.
Karakterizacija[уреди | уреди извор]
Prisustvo funkcionalne grupe se generalno lako utvrđuje, barem u malim molekulama. Oni su najčešća neobazna funkcionalna grupa. Oni se mogu razlikovati od nitro i cijano grupa po njihovom IR spektru. Amidi pokazuju umereno intenzivan νCO opseg u blizini 1650 cm−1. Pomoću 1H NMR spektroskopije, CONHR signali se javljaju na niskim poljima. U rendgenskoj kristalografiji C(O)N centar zajedno sa tri neposredno susedna atoma karakteristično definiše ravan.
Primena i zastupljenost[уреди | уреди извор]
Amidi su rasprostranjeni u prirodi i tehnologiji kao građevinski materijali. Amidna veza se lako formira, daje strukturnu čvrstinu i odoljeva hidrolizi. Najloni su poliamidi, kao i vrlo otporni materijali aramid, tvaron i kevlar. Amidne veze predstavljaju definišuće molekularno svojstvo proteina, čija je sekundarna struktura delom zaslužna za sposobnost vodoničnog vezanja amida. Amidne veze u biohemijskom kontekstu nazivaju se peptidnim vezama kada se javljaju u glavnom lancu proteina i izopeptidnim vezama kada su prisutne u bočnom lancu proteina. Proteini mogu imati strukturnu ulogu, poput kose ili paukove svile, ali gotovo svi enzimi su proteini. Amidi niske molekularne težine, kao što su dimetilformamid (HC(O)N(CH3)2), su uobičajeni rastvarači. Mnogi lekovi su amidi, uključujući paracetamol, penicilin i LSD. Štaviše, biljni N-alkilamidi imaju širok spektar bioloških funkcionalnosti.[8]
Sinteza amida[уреди | уреди извор]
Postoji mnogo metoda za sintezu amida.[9] Najjednostavniji metod za pravljenje amida je spajanjem karboksilne kiseline sa aminom. Generalno je ova reakcija termodinamički povoljna, ali često ima veliku energiju aktivacije, najvećim delom zahvaljujući tome što amin prvo deprotonuje karboksilnu kiselinu, čime se smanjuje njena reaktivnost. Kao takva, direktna reakcija često zahteva visoke temperature.
- RCO2H + R′R″NH ⇌ RCO−
2 + R′R″NH+
2 ⇌ RC(O)NR′R″ + H2O
Poznate su mnoge metode za navođenje ravnoteže udesno. Najvećim delom ove reakcije uključuju „aktiviranje” karboksilne kiseline prvo njenim pretvaranjem u bolji elektrofil; kao što su estri, kiselinski hloridi (Šoten-Baumanova reakcija) ili anhidride (Lumijer-Barbijerov metod). Konvencionalne metode u sintezi peptida koriste sredstva za spajanje kao što su HATU, HOBt ili PiBOP.[10] Poslednjih godina je takođe došlo do porasta primene borovih reagensa za stvaranje amidnih veza, uključujući katalitičku upotrebu 2-jodofenilboronske kiseline[11] ili MIBA,[12] i tris(2,2,2-trifluoroetil) borata.[13][14]
- Reakcije za sintezu amida
| Ime reakcije | Supstrat | Detalji |
|---|---|---|
| Nukleofilna reakcija | Acil hlorid ili anhidrid kiseline | Reaktanti: amonijak ili amin |
| Bekmanovo preuređivanje | Ciklični keton | Reaktanti: hidroksilamin i kiselina |
| Šmitova reakcija | Ketoni, azotna kiselina | |
| Hidroliza nitrila | Nitril, voda | Kisela kataliza |
| Vilgertovo preuređenje | Arilalkilcetini, sumpor i amin (morfolin) | |
| Paserinijeva reakcija | Karboksilna kiselina, ketoni i aldehidi | |
| Ugijeva reakcija | Izocijanat, karboksilna kiselina, keton, glavni amin | |
| Reakcija Bodroa[15][16] | Karboksilna kiselina, organomagnezijum sa derivatom anilina (ArNHR') | 
|
| Čapmanovo preuređivanje[17][18] | Arilni imino eter | Za N,N-diaril amid. Mehanizam reakcija zasniva se na nukleofilnoj aromatičnoj supstituciji[19] 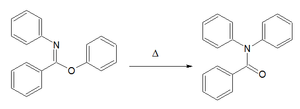
|
| Leukartova sinteza amida[20] | Izocijanat | Reakcija sa izocijanatom katalizovana aluminijum hloridom, uz formiranje aromatičnog amida. |
| Riterova reakcija[21] | Alkeni, alkoholi, ili drugi izvori karbonijum jona | Sekundarni amidi putem reakcije adicije između nitrila i karbonijum jona u prisustvu koncentrovanih kiselina. |
| Fotolitička adicija formamida olefinima[22] | Terminalni alkeni | Reakcija homologacije slobodnih radikala između terminalnog alkena i formamida. |
| Estarska aminoliza[23][24][25] | Estri | Bazom katalizovana reakcija estara sa raznim aminima čime se formiraju alkoholi i amidi. |
Ostale metode[уреди | уреди извор]
Jednostavna reakcija između alkohola i amina nije korištena pre 2007. godine, kada je prijavljen katalizator na bazi jezgre rutenijuma, koji ima sposobnost posredovanja „dehidrogenizacijske acilacije”[26]
Generisanje divodoničnog gasa kompenzuje za nepovoljnu termodinamiku. Smatra se da se ova reakcija odvija putewm alkoholne dehidratacije aldehida, a zatim sledi nastanak Hemiaminala, pa druga dehidratacija kojom nastaje amid. Nije uočeno da prilikom obezvodnjavanja hemiamina nastaje imin.
Transamidacija je tipično veoma spora, ali se može ubrzati pomoću Luisovih kiselina[27] i organometalnih katalizatora:[28]
- RC(O)NR'2 + HNR"2 → RC(O)NR"2 + HNR'2
Primarni amide (RC(O)NH2) su podesniji za ovu reakciju.
Reference[уреди | уреди извор]
- ^ „Amide definition and meaning - Collins English Dictionary”. www.collinsdictionary.com. Приступљено 15. 4. 2018.
- ^ „amide - Definition of amide in English by Oxford Dictionaries”. Oxford Dictionaries - English. Архивирано из оригинала 20. 08. 2016. г. Приступљено 15. 4. 2018.
- ^ IUPAC. „amides”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ „Chemistry International”. Chemistry International. 29 (4). 2007. doi:10.1515/ci.2007.29.4.16.
- ^ а б Kemnitz, Carl R.; Loewen, Mark J. (2007). „"Amide Resonance" Correlates with a Breadth of C−N Rotation Barriers”. Journal of the American Chemical Society. 129 (9): 2521—8. PMID 17295481. doi:10.1021/ja0663024.
- ^ Organic Chemistry IUPAC Nomenclature. Rules C-821. Amides http://www.acdlabs.com/iupac/nomenclature/79/r79_540.htm Архивирано 2011-01-21 на сајту Wayback Machine
- ^ Boonen, Jente; Bronselaer, Antoon; Nielandt, Joachim; Veryser, Lieselotte; De Tré, Guy; De Spiegeleer, Bart (2012). „Alkamid database: Chemistry, occurrence and functionality of plant N-alkylamides” (PDF). Journal of Ethnopharmacology. 142 (3): 563—90. PMID 22659196. doi:10.1016/j.jep.2012.05.038. hdl:1854/LU-2133714.
- ^ Montalbetti, Christian A. G. N.; Falque, Virginie (14. 11. 2005). „Amide bond formation and peptide coupling”. Tetrahedron. 61 (46): 10827—10852. doi:10.1016/j.tet.2005.08.031.
- ^ Valeur, Eric; Bradley, Mark (2009). „Amide bond formation: beyond the myth of coupling reagents”. Chem. Soc. Rev. 38 (2): 606—631. PMID 19169468. doi:10.1039/B701677H.
- ^ „Greener Methods: Catalytic Amide Bond Formation”. Приступљено 22. 9. 2016.
- ^ „MIBA 96% | Sigma-Aldrich”. www.sigmaaldrich.com. Приступљено 22. 9. 2016.
- ^ „Tris(2,2,2-trifluoroethyl) borate 97% | Sigma-Aldrich”. www.sigmaaldrich.com. Приступљено 22. 9. 2016.
- ^ Sabatini, Marco T.; Boulton, Lee T.; Sheppard, Tom D. (1. 9. 2017). „Borate esters: Simple catalysts for the sustainable synthesis of complex amides”. Science Advances. 3 (9): e1701028. Bibcode:2017SciA....3E1028S. PMC 5609808
 . PMID 28948222. doi:10.1126/sciadv.1701028.
. PMID 28948222. doi:10.1126/sciadv.1701028.
- ^ Bodroux F. (1905). Bull. Soc. Chim. France. 33: 831.
- ^ „Bodroux reaction”. Institute of Chemistry, Skopje, Macedonia. Архивирано из оригинала 24. 09. 2015. г. Приступљено 16. 10. 2019.
- ^ Schulenberg, J. W.; Archer, S. (1965). The Chapman Rearrangement. Org. React. 14. стр. 1—51. ISBN 978-0471264187. doi:10.1002/0471264180.or014.01.
- ^ Chapman, Arthur William (1925). „CCLXIX.—Imino-aryl ethers. Part III. The molecular rearrangement of N-phenylbenziminophenyl ether”. Journal of the Chemical Society, Transactions. 127: 1992—1998. doi:10.1039/CT9252701992.
- ^ March, Jerry (1966). Advanced organic Chemistry, Reactions, mechanisms and structure (3rd изд.). ISBN 978-0-471-85472-2.
- ^ Leuckart, R. (1885). „Ueber einige Reaktionen der aromatischen Cyanate”. Berichte der deutschen chemischen Gesellschaft. 18: 873—877. doi:10.1002/cber.188501801182.
- ^ Adams, Rodger; Krimen, L.I.; Cota, Donald J. (1969). Organic Reaction Volume 17. London: John Wiley & Sons, Inc. стр. 213—326. ISBN 9780471196150. doi:10.1002/0471264180.
- ^ Monson, Richard (1971). Advanced Organic Synthesis: Methods and Techniques. Newyork: Academic Press. стр. 141. ISBN 978-0124336803.
- ^ Corson, B. B.; Scott, R. W.; Vose, C. E. (1941). „Cyanoacetamide”. Organic Syntheses. 1: 179. doi:10.15227/orgsyn.009.0036.
- ^ Jacobs, W. A. (1941). „Chloroacetamide”. Organic Syntheses. 1: 153. doi:10.15227/orgsyn.007.0016.
- ^ Kleinberg, J.; Audrieth, L. F. (1955). „Lactamide”. Organic Syntheses. 3: 516. doi:10.15227/orgsyn.021.0071.
- ^ Gunanathan, C.; Ben-David, Y.; Milstein, D. (2007). „Direct Synthesis of Amides from Alcohols and Amines with Liberation of H2”. Science. 317 (5839): 790—2. Bibcode:2007Sci...317..790G. PMID 17690291. doi:10.1126/science.1145295.
- ^ T. A. Dineen; M. A. Zajac; A. G. Myers (2006). „Efficient Transamidation of Primary Carboxamides by in situ Activation with N,N-Dialkylformamide Dimethyl Acetals”. J. Am. Chem. Soc. 128 (50): 16406—16409. doi:10.1021/ja066728i.
- ^ Emma L. Baker; Michael M. Yamano; Zhou, Yujing; Sarah M. Anthony; Neil K. Garg (2016). „A two-step approach to achieve secondary amide transamidation enabled by nickel catalysis”. Nature Communications. 7: 11554. Bibcode:2016NatCo...711554B. PMC 4876455
 . PMID 27199089. doi:10.1038/ncomms11554.
. PMID 27199089. doi:10.1038/ncomms11554.


