Oksazol

| |
| Nazivi | |
|---|---|
| IUPAC naziv
1,3-oxazole
| |
| Identifikacija | |
3D model (Jmol)
|
|
| ECHA InfoCard | 100.005.474 |
| |
| Svojstva | |
| C3H3NO | |
| Molarna masa | 69,06 g/mol |
| Gustina | 1,050 g/cm3 |
| Tačka ključanja | 69-70 °C |
| Baznost (pKb) | 0.8 |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Oksazol je osnova velike klase heterocikličnih aromatičnih organskih jedinjenja. Oni su azoli kod kojih su kiseonik i azot odvojeni jednim ugljenikom.[3] Oksazoli su u manjoj meri aromatični od tiazola. Oksazol je slaba baza. Njegova konjugovana kiselina ima pKa od 0.8, u poređenju sa 7 za imidazol.[4][5][6][7]
Priprema[уреди | уреди извор]
Klasični sintetički metodi oksazola su
- Robinson-Gabrielova sinteza dehidracijom 2-acilaminoketona[8][9][10]

- Fišerova sinteza oksazola iz cijanohidrina i aldehida[11][12]

Drugi metodi su isto tako poznati.
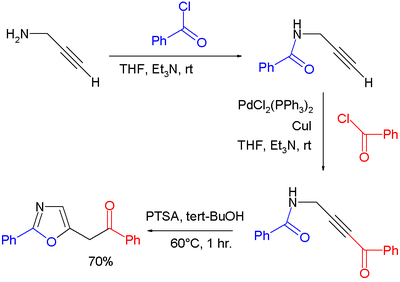
- Oksazoli se mogu dobiti cikloizomerizacijom pojedinih propargil amida. U jednoj studiji[13] oksazoli su pripremljeni putem kondenzacije propargil amina i benzoil hlorida do amida, čemu je sledilo Sonogašira spajanje kraja alkina sa ekvivalentom benzoilhlorida, i završna cikloizomerizacija katalisana p-toluensulfonskom kiselinom:
- U jednoj objavljenoj sintezi oksazola reaktanti su nitro-supstituisani benzoil hlorid i izonitril:[14]
Biosinteza[уреди | уреди извор]
U biomolekulima, oksazoli su proizvod ciklizacije i oksidacije serina ili treonina neribozomskih peptida:

Gde je X = H, CH
3 za serin i treonin respektivno, B = baza.
(1) Enzimatska ciklizacija. (2) Eliminacija. (3) [O] = enzimatska oksidacija.
Oksazoli su manje zastupljeni u biomolekulima od srodnih tiazola.
Reference[уреди | уреди извор]
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Heterocyclic Chemistry TL Gilchrist, The Bath press (1985) ISBN 0-582-01421-2
- ^ Katritzky A.R.; Pozharskii A.F. (2000). Handbook of Heterocyclic Chemistry (Second изд.). Academic Press. ISBN 0080429882.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ McMurry John E. (1992). Fundamentals of Organic Chemistry (3rd изд.). Belmont: Wadsworth. ISBN 0-534-16218-5.
- ^ Morrison Robert Thornton; Boyd Robert Neilson (2006). Organic chemistry. Engelwood Cliffs, New Jersey: Prentice Hall. ISBN 8120307658.
- ^ Robinson, R. J. Chem. Soc. 1909, 95, 2167.
- ^ Gabriel, S. Chemische Berichte 1910, 43, 134.
- ^ Gabriel, S. Chemische Berichte 1910, 43, 1283.
- ^ Emil Fischer, Chemische Berichte 1896, 29, 205.
- ^ Wiley, R. H. Chem. Rev. 1945, 37, 401.
- ^ A new consecutive three-component oxazole synthesis by an amidation–coupling–cycloisomerization (ACCI) sequence, Eugen Merkul and Thomas J. J. Müller, Chem. Commun., 2006, 4817 - 4819, . doi:10.1039/b610839c. Недостаје или је празан параметар
|title=(помоћ) - ^ Fully Automated Continuous Flow Synthesis of 4,5-Disubstituted Oxazoles Marcus Baumann, Ian R. Baxendale, Steven V. Ley, Christoper D. Smith, and Geoffrey K. Tranmer, Org. Lett.; 2006; 8(23) pp. 5231 - 5234; (Letter) . doi:10.1021/ol061975c. Недостаје или је празан параметар
|title=(помоћ)