Сребро фулминат

| |
| Идентификација | |
|---|---|
3Д модел (Jmol)
|
|
| |
| Својства | |
| CAgNO | |
| Моларна маса | 149,885 |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
Сребро фулминат је органско једињење, општа формула Аг(ЦНО), које садржи 1 атом угљеника и има молекулску масу од 149,885 Da.
Сребрни фулминат је примарни експлозив, али као такав има ограничену употребу због своје екстремне осетљивости на ударце, топлоту, притисак и електрицитет. Једињење постаје прогресивно осетљиво како се агрегира, чак и у малим количинама; додир пера које пада, удар једне капљице воде или мало статичко пражњење су способни да експлозивно детонирају неограничену гомилу сребрног фулмината величине мање од новчића и тежине неколико милиграма. Агрегирање већих количина је немогуће, због тенденције једињења да самоиницијативно детонира под сопственом тежином.
Веома је осетљив на ударце и трење, па је опасан за руковање (дуго је био извор незгода у апотекама и хемијским или физичким експериментима у лабораторијама које су га проучавале или користиле[3], као и у фотографским студијима[4]).
Сребрни фулминат се може припремити на сличан начин као и живин фулминат, али ова со је још нестабилнија од живиног фулмината, може чак и да експлодира под водом. То је изомер сребрног цијаната.
Користи се за прављење одређених петарди, у веома малим количинама.
Сребрни фулминат је први припремио Едвард Чарлс Хауард 1800. године у свом истраживачком пројекту за припрему великог броја разноврсних фулмината. Заједно са живиним фулминатом, то је једини фулминат који је довољно стабилан за комерцијалну употребу. Детонатори који користе сребрни фулминат коришћени су за иницирање пикринске киселине 1885. године, али их је од тада користила само италијанска морнарица.[5] Тренутна комерцијална употреба је у производњи нештетних звучних ефеката код дечијих играчака.
Историја
[уреди | уреди извор]Осамдесетих година 17. века, Клод-Луј Бертоле је проучавао форму „фулминирајућег сребра“.[6] Он даје формулу и описује њена својства у Запажањима о физици Аббе Розиер-а у јуну 1788. године.[6] Конкретно, док се други фулминанти морају запалити или загрејати да би детонирали, он примећује велику нестабилност фулминантног сребра („додир са хладним телом је довољан да детонира“).
Око 1800. године , непосредно након фулмината живе, Десцостилс, Цруицксанкс и Бругнателли[6] су то описали прецизније.
Јустус Лиебиг и Гаи-Луссац су 1824. објавили методу за анализу ове супстанце.[7]
Калмелс је 1884. проучавао реакцију примарних јодида алкохола са сребрним фулминатом.[8]
Током 1930-их Мураоур је проучавао вакуумску детонацију фулмината као основног експлозива и предложио рад са сребрним азидом.
Године 1978. поново је процењен као потенцијални пиротехнички детонатор, упркос својој опасности,[9] а понекад се користи за проучавање детонационих и дефлаграционих таласа.[10]
Особине
[уреди | уреди извор]| Особина | Вредност |
|---|---|
| Број акцептора водоника | 1 |
| Број донора водоника | 0 |
| Број ротационих веза | 0 |
| Партициони коефицијент[11] (ALogP) | -0,8 |
| Растворљивост[12] (logS, log(mol/L)) | 1,5 |
| Поларна површина[13] (PSA, Å2) | 90,5 |
Структура
[уреди | уреди извор]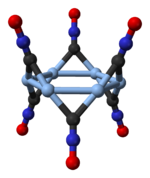
Сребрни фулминат се јавља у два полиморфна облика, орторомбичном и тригоналном са ромбоедарском решетком.[14] Тригонални полиморф се састоји од цикличних хексамера, (АгЦНО)6.[15]

Својства
[уреди | уреди извор]Фулминати су токсични, отприлике исто као и цијаниди.[5] Када је чист, сребрни фулминат је хемијски стабилан и не распада се након година складиштења. Као и многе сребрне соли, потамни при излагању светлости. Слабо је растворљив у хладној води и може се рекристалисати коришћењем вреле воде.[5][16] Такође се може рекристалисати из 20% раствора амонијум ацетата.[5] Није хигроскопан и може експлодирати када је влажан или под водом; пријављено је да је остао експлозиван након 37 година под водом.[5] Експлодира у контакту са концентрованом сумпорном киселином или хлором или бромом, али не и у контакту са јодом.[5] Нерастворљив је у азотној киселини, али се раствара у амонијаку , алкалним хлоридима, алкалним цијанидима, анилину, пиридину и калијум-јодиду формирајући комплексе.[5] Концентрована хлороводонична киселина га неексплозивно разлаже уз шиштање; тиосулфат га такође неексплозивно разлаже и може се користити за одлагање.[5]
Припрема
[уреди | уреди извор]Ово једињење се може припремити сипањем раствора сребрног нитрата у азотној киселини у етанол, под пажљивом контролом реакционих услова, како би се избегла експлозија.[17] Реакција се обично врши на 80—90 °Ц (176—194 °Ф; 353—363 К); на 30 °Ц (86 °Ф; 303 К), талог се можда неће формирати.[5] Само мале количине сребрног фулмината треба припремити одједном, јер чак и тежина кристала може изазвати њихову самодетонацију. Други начин да се добије сребрни фулминат је реакција сребрног карбоната са амонијаком у раствору.
Сребрни фулминат се такође формира када се гасни азот оксид пропушта кроз раствор сребровог нитрата у етанолу.[5]
Сребрни фулминат се може припремити ненамерно, када кисели раствор сребровог нитрата дође у контакт са алкохолом.[17] Ово представља опасност у неким формулацијама хемијски посребрених огледала.
Новитети експлозива
[уреди | уреди извор]Сребрни фулминат, често у комбинацији са калијум хлоратом, користи се у триковима који стварају буку познатим као "одбацивање", "крекери", "снапери", "бичеви", "поп-итс" или "банг снапс", а популарна врста новитета ватромета. Садрже приближно 200 милиграма ситног шљунка прекривеног малом количином (приближно 80 микрограма)[18] сребрног фулмината. Када се баци на тврду површину, ударац је довољан да детонира сићушну количину експлозива, стварајући мали поздрав од суперсоничне детонације. Снапс је дизајниран тако да не може да изазове штету (чак и када детонирају на кожи) због ефекта пригушења који обезбеђује много већа маса шљунковите средине. То је такође хемикалија пронађена у божићним крекерима[19] коју је у ту сврху први употребио Том Смит 1860. Хемикалија је нанесена на једној од две уске траке картона, а на другој је абразив. Када се крекер повуче, абразив детонира сребрни фулминат.
Мешавина фулмината са 10-20% калијум хлората је јефтинија и сјајнија од самог фулмината.[5]
Апликације
[уреди | уреди извор]У пракси, сребрни фулминат нема никакву примену, чак ни као експлозив. Због своје високе осетљивости, никада се не користи у ватромету, јер се мешавине калијум хлората или црвеног фосфора увек користе за паљење трењем.
Види још
[уреди | уреди извор]- Примарни експлозив
- Сребро цијанат
- Фулминска киселина
- Калијум фулминат
- Жива(II) фулминате
- Изомер (хемијски)
Референце
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Viel C (2005). Des accidents dans les laboratoires de chimie au XIXe siècle. Revue d'histoire de la pharmacie, 93(346), 175-186.
- ^ Lefebvre, T., & Raynal, C. (2001). Les accidents du travail chez les photographes du XIXe siècle. Revue d'histoire de la pharmacie, 89(329), 121-124.
- ^ а б в г д ђ е ж з и ј Matyas, Robert; Pachman, Jiri (12. 3. 2013). Primary Explosives. Springer Science & Business Media, 338 pages.
- ^ а б в Lemay, P. (1961). Berthollet invente des explosifs. Revue d'histoire de la pharmacie, 49(169), 53-57.(résumé)
- ^ Liebig J & Gay-Lussac J.L (1824) Analyse du fulminate d’argent. Ann. Chim. et Phys, 25, 285œ311.
- ^ Compt. rend, 99, 794.
- ^ En Collins, P. H., & Holloway, K. J. (1978). A reappraisal of silver fulminate as a detonant. Propellants, Explosives, Pyrotechnics, 3(6), 159-162 (résumé)
- ^ Manson N (1987) [Manson, N. (1987). Historique de la découverte de l'onde de détonation. Le Journal de Physique Colloques, 48(C4), C4-7. Historique de la découverte de l'onde de détonation]. Le Journal de Physique Colloques, 48(C4), C4-7.
- ^ Ghose, A.K.; Viswanadhan V.N. & Wendoloski, J.J. (1998). „Prediction of Hydrophobic (Lipophilic) Properties of Small Organic Molecules Using Fragment Methods: An Analysis of AlogP and CLogP Methods”. J. Phys. Chem. A. 102: 3762—3772. doi:10.1021/jp980230o.
- ^ Tetko IV, Tanchuk VY, Kasheva TN, Villa AE (2001). „Estimation of Aqueous Solubility of Chemical Compounds Using E-State Indices”. Chem Inf. Comput. Sci. 41: 1488—1493. PMID 11749573. doi:10.1021/ci000392t.
- ^ Ertl P.; Rohde B.; Selzer P. (2000). „Fast calculation of molecular polar surface area as a sum of fragment based contributions and its application to the prediction of drug transport properties”. J. Med. Chem. 43: 3714—3717. PMID 11020286. doi:10.1021/jm000942e.
- ^ Бриттон, D.; Дунитз, Ј. D. (1965). „Тхе Црyстал Струцтуре оф Силвер Фулминате”. Ацта Црyсталлограпхица. 19 (4): 662—668. дои:10.1107/С0365110X6500405X.
- ^ Бриттон, D. (1991). „А Редетерминатион оф тхе Тригонал Силвер Фулминате Струцтуре”. Ацта Црyсталлограпхица C. 47 (12): 2646—2647. дои:10.1107/С0108270191008855.
- ^ 0.0075 гм ат 13 °Ц, 0.018 гм ат 30 °Ц, анд 0.25 гм пер 100 гм Х2О ат 100 °Ц
- ^ а б Цоллинс, П. Х.; Холлоwаy, К. Ј. (1978). „А Реаппраисал оф силвер фулминате ас а детонант”. Пропеллантс, Еxплосивес, Пyротецхницс. 3 (6): 159—162. дои:10.1002/преп.19780030603.
- ^ пацкаге дисцлосуре оф Алеxрон Цо. Лтд, Хонг Конг, Пхантом Бранд Банг Снапс, (ц)2013
- ^ Спецтрум. „Цоммент #70”. Олд Фиреwорк Фацторy Лоцатионс. УК Пyротецхницс Социетy. Приступљено 20. 12. 2011.
Литература
[уреди | уреди извор]- Цлаyден, Јонатхан; Греевес, Ницк; Wаррен, Стуарт; Wотхерс, Петер (2001). Органиц Цхемистрy (I изд.). Оxфорд Университy Пресс. ИСБН 978-0-19-850346-0.
- Смитх, Мицхаел Б.; Марцх, Јеррy (2007). Адванцед Органиц Цхемистрy: Реацтионс, Мецханисмс, анд Струцтуре (6тх изд.). Неw Yорк: Wилеy-Интерсциенце. ИСБН 0-471-72091-7.
- Катритзкy А.Р.; Позхарскии А.Ф. (2000). Хандбоок оф Хетероцyцлиц Цхемистрy (Сецонд изд.). Ацадемиц Пресс. ИСБН 0080429882.
Додатна литература
[уреди | уреди извор]- Сингх, К. (1959). „Црyстал струцтуре оф силвер фулминате”. Ацта Црyсталлограпхица. 12 (12): 1053. дои:10.1107/С0365110X5900295X
 .
. - Матyас, Роберт; Пацхман, Јири (Мар 12, 2013). Примарy Еxплосивес. Спрингер Сциенце & Бусинесс Медиа, 338 пагес
