Силикон

Силикон (полисилоксан) је полимер који се производи као флуид смоле или еластомера. Делимично је органско једињење али не садржи угљеник, већ се састоји од наизменичних атома силицијума и кисеоника. Код већине силикона, две органске групе везују се за сваки атом силицијума.[1][2]
Силиконски флуид користи се као имплант за груди, као лепак, мазива, за изолацију од воде. Силиконска гума се користи као електрични изолатор, као материјал за заптивање, као компонента аутомобилског мотора, за ламинацију стаклене тканине и као хируршка мембрана и имплант.[3]
Хемија
[уреди | уреди извор]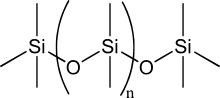
Прецизније назив је полимеризовани силоксани или полисилоксани.[4] Силикони се састоје од неорганског силицијум-кисеоничног главног ланца (⋯-Si-O-Si-O-Si-O-⋯) са органским бочним групама везаним за атоме силицијума. Атоми силицијума су тетравалентни. Силикони су полимери формирани од неорганско-органских мономера. Силикони имају општу формулу [R2SiO]n, где је R органска група као што је алкил (метил, етил) или фенил група.
У неким случајевима, органске бочне групе се могу користити за везивање два или више тих -Si-O- главних ланаца заједно. Варирајући дужину -Si-O- ланаца, бочне групе, и степен унакрсног везивања, силикони се могу синтетисати са широким варијететом својстава и композиција. Они могу да варирају у конзистенцији од течности до гела до гуме и до тврде пластике. Најчешћи силикон је линеарни полидиметилсилоксан (ПДМС), силиконско уље. Једна друга велика група силиконских материјала је базирана на силиконским резинима, који се формирају од разгранатих олигосилоксана, као и оних у облику кавеза.
Терминологија и историја
[уреди | уреди извор]Ф. С. Кипинг је сковао реч силикон 1901. године да би описао полидифенилсилоксан по аналогији са формулом једињења, Ph2SiO (Ph означава фенил, C6H5), са формулом кетонског бензофенона, Ph2CO (његов термин је оригинално био силикокетон).[5] Кипинг је знао да је полидифенилсилоксан полимер, док је бензофенон мономер, и запазико је да Ph2SiO и Ph2CO имају веома различита хемијска својства.[1][2] Откриће структурних разлика између Кипингових молекула и кетона је значило да силикон више није био коректан термин (мада се задржао у свакодневној употреби) и да је термин силоксан коректан према номеклатури модерне хемије.[6]
Силикон се понекад погрешно назива силицијумом. Хемијски елемент силицијум је кристални металоид који налази широку примену у рачунарима и другој електронској опреми. Мада силикони садрже атоме силицијума, они исто тако садрже угљеник, водоник, кисеоник, а неке врсте садрже и друге атоме, и имају физичка и хемијска својства која су веома различита од елементарног силицијума.
Права силиконска група са двоструком везом између кисеоника и силицијума се веома ретко јавља у природи. Атоми силицијума обично формирају једноструке везе са сваким од два атома кисеоника, уместо двоструке везе са једним атомом кисеоника. Полисилоксани су међу многобројним супстанцама познатим као силикони.
Молекули који садрже двоструке везе између силицијума и кисеоника постоје и називају се силанонима, али су веома реактивни. Упркос тога, силанони су важни као интермедијари у процесима у гасној фази хемијске парне депозиције у продукцији микроелектронике, и у формирању керамике путем сагоревања.[7]
Синтеза
[уреди | уреди извор]Најзаступљенији материјали су базирани на полидиметилсилоксану, који се формира хидролизом диметилдихлоросилана. Овај дихлорид реагује са водом на следећи начин:
- n Si(CH3)2Cl2 + n H2O → [Si(CH3)2O]n + 2n HCl
Полимеризација типично производи линеарне ланце завршене са Si-Cl или Si-OH (силанол) групама. Под различитим условима полимер је цикличан, уместо отвореног ланца.[3]
За потрошачке примене као што су заптивачи силил ацетати се користе уместо силил хлорида. Хидролизом ацетата се формира мање опасна сирћетна киселина (киселина присутна у сирћету) као реакциони производ знатно споријег процеса очвршћавања. Ова хемија се користи у многим видовима потрошачких примена, као што су силиконски заптивачи и адхезиви.
Гранање и унакрсно везивање у полимерним ланцима се могу увести користећи органосиликонске прекурзоре са мањим бројем алкил група, као што су метилтрихлоросилан и метилтриметоксисилан. Идеално, сваки молекул таквог једињења постаје тачка гранања. Тај процес се може користити за прављење тврдих силиконских смола. Слично томе, прекурзори са три метил групе се могу користити за ограничавање молекулске тежине, пошто такав молекул има само једно реактивно место и стога може да формира крај силоксанског ланца.
Сагоревање
[уреди | уреди извор]Кад силикон сагорева на ваздуху или кисеонику, он формира чврсти силикон (силикон диоксид) (SiO2) у виду белог праха, чађи, и разних гасова. Тај прах који се лако распршује се понекад назива силиконским димом.
Примене
[уреди | уреди извор]Чврсто гориво
[уреди | уреди извор]Везива на бази полидиметилсилоксана (PDMS) заједно са амонијум перхлоратом (NH4ClO4) се користе као брзо сагоревајућа чврста горива у ракетама.[8]
Електроника
[уреди | уреди извор]Употреба силикона у електроници није без проблема. Силикони су релативно скупи и могу бити нападнути појединим растварачима. Силикон лако мигрира као течност или пара на друге компоненте. Контаминација силиконом на електричним контактима прекидача може довести до кварова изазивањем повећања отпора контакта, често касно у животном веку контакта, дуго након завршетка тестирања.[9][10] Употреба производа у виду спреја на бази силикона у електронским уређајима током одржавања или поправци може изазвати касније кварове.
Накит
[уреди | уреди извор]Силикон је популарна алтернатива традиционалним металима (као што су сребро и злато) у накиту, посебно прстењу. Силиконски прстенови се обично носе у професијама где метални прстенови могу довести до повреда, као што су услед електричне проводљивости и авулзије прстена.[11][12] Средином 2010-их, неки професионални спортисти су почели да носе силиконске прстенове као алтернативу током утакмица.[13]
Медицина и естетска хирургија
[уреди | уреди извор]Силикон се користи у микрофлуидима, заптивкама, поклопцима и другим апликацијама које захтевају високу биокомпатибилност. Поред тога, у облику гела се користи у завојима и облогама, грудним имплантатима, имплантатима тестиса, пекторалним имплантатима, контактним сочивима и разним другим медицинским употребама.
Недозвољене инјекције козметичког силикона могу изазвати хроничну и дефинитивну силиконску дифузију крви са дерматолошким компликацијама.[14]
Адициони и кондензациони (нпр. поливинил силоксан) силикони налазе широку примену као материјал за зубне отиске због својих хидрофобних својстава и термичке стабилности.[15][16][17]
Производња и маркетинг
[уреди | уреди извор]Водећи светски произвођачи силиконских основних материјала сврставају се у три регионалне организације: Европском силиконском центру (CES) у Бриселу, Белгија; Савет за здравље и безбедност животне средине (SEHSC) у Херндону, Вирџинија, САД; и Удружење силиконске индустрије Јапана (SIAJ) у Токиу, Јапан. Дау Корнинг Силиконс, Евоник Индустрије, Моментивни перформантни материјали, Миликен и Компанија (SiVance Specialty Silicones), Шин-Ецу Силикони, Вакер Чеми, Блустар Силикони, JNC корпорација, Вакер Асахикасеј Силикон и Дау Корнинг Торај представљају колективно чланство ових организација. Четврта организација, Глобални силиконски савет (GSC) делује као кровна структура над регионалним организацијама. Све четири организације су непрофитне, немају комерцијалну улогу; њихове првенствене мисије су да промовишу безбедност силикона из перспективе здравља, безбедности и животне средине. Док се европска хемијска индустрија припрема за имплементацију Закона о регистрацији, евалуацији и ауторизацији хемикалија (REACH), CES предводи формирање конзорцијума[18] произвођача и увозника силикона, силана и силоксана како би олакшао приступ подацима и омогућио увид у трошкове.
Размишљања о безбедности и животној средини
[уреди | уреди извор]Силиконска једињења су распрострањена у животној средини. Посебна једињења силикона, циклични силоксани D4 и D5, су загађивачи ваздуха и воде и негативно утичу на здравље испитиваних животиња.[19] Силиконска једињења се користе се у разним производима за личну негу. Европска агенција за хемикалије открила је да је „D4 перзистентна, биоакумулативна и токсична (PBT) супстанца, а D5 веома постојана, веома биоакумулативна (vPvB) супстанца“.[20][21] Други силикони се лако биоразграђују, што је процес који се убрзава разним катализаторима, укључујући глину.[3] Показало се да циклични силикони укључују појаву силанола током биоразградње код сисара.[22] Добијени силандиоли и силантриоли су способни да инхибирају хидролитичке ензиме као што су термолизин, ацетихолинестераза. Међутим, дозе потребне за инхибицију су више редова величине веће од оних које су резултат акумулиране изложености потрошачким производима који садрже циклометикон.[23][24]
На око 200 200 °C (392 °F) у атмосфери која садржи кисеоник, ПДМС ослобађа трагове формалдехида (али мање количине од других уобичајених материјала као што је полиетилен.[25][26]) На овој температури, утврђено је да силикони имају мање стварање формалдехида од минералног уља и пластике (мање од 3 до 48 µg CH2O/(g·hr) за силиконску гуму високе конзистенције, у односу на око400 µg CH2O/(g·hr) за пластику и минерално уље). До 250 °C (482 °F), откривено је да сви силикони производе велике количине формалдехида (1,200 to 4,600 µg CH2O/(g·hr)).[26]
Референце
[уреди | уреди извор]- ^ а б Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II изд.). Oxford: Butterworth-Heinemann. стр. 362. ISBN 0080379419.
- ^ а б Kipping, Frederick; Lloyd, L. L. (1901). „XLVII.-Organic derivatives of silicon. Triphenylsilicol and alkyloxysilicon chlorides”. J. Chem. Soc., Trans. 79: 449—459. doi:10.1039/CT9017900449.
- ^ а б в Moretto, Hans-Heinrich; Schulze, Manfred; Wagner, Gebhard (2000). „Silicones”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 3527306730. doi:10.1002/14356007.a24_057.
- ^ Rösch, Lutz; John, Peter; Reitmeier, Rudolf (2000). „Silicon Compounds, Organic”. Ullmann's Encyclopedia of Industrial Chemistry. San Francisco: John Wiley and Sons. ISBN 3527306730. doi:10.1002/14356007.a24_021.
- ^ K.L. Mittal, A. Pizzi (2009). Handbook of Sealant Technology. CRC Press. стр. 27. ISBN 978-0-8493-9162-0.
- ^ Mark, Allcock & West 2005, стр. 155
- ^ Khabashesku, V. N.; Kerzina, Z. A.; Kudin, K. N.; Nefedov, O. M. (1998). „Matrix isolation infrared and density functional theoretical studies of organic silanones, (CH3O)2Si=O and (C6H5)2Si=O”. J. Organomet. Chem. 566 (1–2): 45—59. doi:10.1016/S0022-328X(98)00726-8.
- ^ Eisele, Siegfried; Gerber, Peter; Menke, Klaus (јун 2002). <161::aid-prep161>3.0.co;2-4 „Fast Burning Rocket Propellants Based on Silicone Binders – New Aspects of an Old System”. Propellants, Explosives, Pyrotechnics. 27 (3): 161. ISSN 0721-3115. doi:10.1002/1521-4087(200206)27:3<161::aid-prep161>3.0.co;2-4.
- ^ Paul G. Slade (1999). „16.4.1”. Electrical Contacts: Principles and Applications. CRC Press. стр. 823. ISBN 978-0-8247-1934-0. Архивирано из оригинала 2017-12-18. г.
- ^ W. Witter; R. Leiper (1979). „A Comparison for the Effects of Various Forms of Silicon Contamination on Contact Performance”. IEEE Transactions on Components, Hybrids, and Manufacturing Technology. 2: 56—61. doi:10.1109/TCHMT.1979.1135411.
- ^ Ashley, Sarah (1. 8. 2018). „Is the Silicone Ring Trend Here to Stay?”.
- ^ Chen, Connie. „A ton of couples are skipping the fancy wedding rings and opting for these $20 rubber bands instead — here's why”. Insider.
- ^ „The (wedding) ring's the thing: Silicone bands a growing trend in NFL”. ESPN.com. 29. 9. 2016.
- ^ Bertin, Chloé; Abbas, Rachid; Andrieu, Valérie; Michard, Florence; Rioux, Christophe; Descamps, Vincent; Yazdanpanah, Yazdan; Bouscarat, Fabrice (1. 1. 2019). „Illicit massive silicone injections always induce chronic and definitive silicone blood diffusion with dermatologic complications”. Medicine. 98 (4): e14143. PMC 6358378
 . PMID 30681578. doi:10.1097/MD.0000000000014143 — преко journals.lww.com.
. PMID 30681578. doi:10.1097/MD.0000000000014143 — преко journals.lww.com.
- ^ „The many uses of dental impression silicone”. 19. 7. 2022. Приступљено 16. 1. 2023.
- ^ Ferracane, Jack L. (2001). Materials in dentistry : principles and applications (2nd изд.). Philadelphia: Lippincott Williams & Wilkins. ISBN 0-7817-2733-2. OCLC 45604030.
- ^ Sturdevant's art and science of operative dentistry. André V. Ritter, Clifford M. Sturdevant (7 изд.). St. Louis. 2018. ISBN 978-0-323-47858-8. OCLC 1124496192.
- ^ „REACH consortium”. Reach.silicones.eu. Архивирано из оригинала 2012-03-15. г. Приступљено 2012-02-28.
- ^ Bienkowski, Brian (30. 4. 2013). „Chemicals from Personal Care Products Pervasive in Chicago Air”. Scientific American. Архивирано из оригинала 20. 6. 2015. г. Приступљено 8. 4. 2015.
- ^ European Chemicals Agency. „Committee for Risk Assessment concludes on restricting D4 and D5”. European Chemicals Agency. Приступљено 28. 8. 2018.
- ^ „ECHA classifies cyclic siloxanes as SVHCs”. Food Packaging Forum Foundation. 25. 6. 2018. Приступљено 28. 8. 2018.
- ^ S. Varaprath, K. L. Salyers, K. P. Plotzke and S. Nanavati: "Identification of Metabolites of Octamethylcyclotetrasiloxane (D4) in Rat Urine", Drug Metab Dispos 1999, 27, 1267-1273.
- ^ S. M. Sieburth, T. Nittoli, A. M. Mutahi and L. Guo: Silanediols: a new class of potent protease inhibitors, Angew. Chem. Int. Ed. 1998, volume 37, 812-814.
- ^ M. Blunder, N. Hurkes, M. List, S. Spirk and R. Pietschnig: Silanetriols as in vitro AChE Inhibitors, Bioorg. Med. Chem. Lett. 2011, volume 21, 363-365.
- ^ Hard, Dave. „Dielectric Fluids for Transformer Cooling — History and Types”. General Electric. Архивирано из оригинала 2016-07-19. г.
- ^ а б David C. Timpe Jr. Formaldehyde Generation from Silicone Rubber Архивирано 2015-04-27 на сајту Wayback Machine Arlon
Литература
[уреди | уреди извор]- K.L. Mittal, A. Pizzi (2009). Handbook of Sealant Technology. CRC Press. стр. 27. ISBN 978-0-8493-9162-0.
- Mark, James E.; Allcock, Harry R.; West, Robert (2005). Inorganic Polymers. Oxford University. стр. 155. ISBN 978-0-19-535131-6. Архивирано из оригинала 18. 12. 2017. г.
- E. Wiberg: Anorganska kemija, Školska knjiga, Zagreb, 1976. (језик: хрватски)
Спољашње везе
[уреди | уреди извор]- Science of Silicone Polymers (Silicone Science On-line, Centre Européen des Silicones – CES)
