Karbonat
| |
| Nazivi | |
|---|---|
| Preferisani IUPAC naziv
Karbonat | |
| Sistemski IUPAC naziv
Trioksidokarbonat[1]:127 | |
| Identifikacija | |
3D model (Jmol)
|
|
| ChemSpider | |
| UNII | |
| |
| |
| Svojstva | |
| CO2− 3 | |
| Molarna masa | 60,01 g·mol−1 |
| Konjugovana kiselina | Bikarbonat |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |
| Reference infokutije | |
Karbonat je anjon (CO32-) koji nastaje jonizacijom karbonatne kiseline (H2CO3).[4] Ovaj naziv takođe označava i svaku so koja potiče od ove kiseline. Karbonatni anjoni vrše važnu funkciju u fiziologiji živih ćelija (od regulacije acido-bazne ravnoteže - hidrogenkarbonatni pufer, preko razmene gasova i drugih bitnih funkcija). Najpoznatiji karbonat u prirodi je kalcijum karbonat, poznat i kao kreda, krečnjak i mermer. Ne rastvara se u vodi, ali se zato dobro rastvara u kiselim vodenim rastvorima.
Termin se takođe koristi u glagolskom obliku da se opiše karbonacija: proces povećanja koncentracije karbonatnih i bikarbonatnih jona u vodi za proizvodnju gazirane vode i drugih gaziranih pića – bilo dodavanjem gasa ugljen-dioksida pod pritiskom, ili rastvaranjem karbonata ili bikarbonatne soli u vodi.
U geologiji i [mineralogy[|mineralogiji]], termin „karbonat” se može odnositi i na karbonatne minerale i na karbonatne stene (koje se sastoje uglavnom od karbonatnih minerala), a u oba dominira karbonatni jon, CO2−
3. Karbonatni minerali su izuzetno raznovrsni i sveprisutni u hemijski precipitiranim sedimentnim stenama. Najčešći su kalcit ili kalcijum karbonat, CaCO3, glavni sastojak krečnjaka (kao i glavna komponenta školjki mekušaca i skeleta korala); dolomit, kalcijum-magnezijum karbonat CaMg(CO3)2; i siderit, ili gvožđe(II) karbonat, FeCO3, važna ruda gvožđa. Natrijum karbonat („soda” ili „natron”) i kalijum karbonat („potaša”) korišćeni su od antike za čišćenje i konzervaciju, kao i za proizvodnju stakla. Karbonati se široko koriste u industriji, kao što je topljenje gvožđa, kao sirovina za proizvodnju portland cementa i kreča, u sastavu keramičkih glazura i drugo.
Struktura i vezivanje[uredi | uredi izvor]
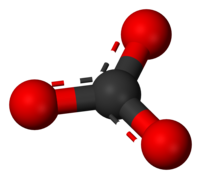
Karbonatni jon je najjednostavniji oksougljenični anjon. Sastoji se od jednog atoma ugljenika okruženog sa tri atoma kiseonika, u trigonalnom planarnom rasporedu, sa D3h molekularnom simetrijom. On ima molekulsku masu od 60,01 g/mol i nosi ukupno formalno naelektrisanje od -2. To je konjugovana baza hidrogenkarbonatnog (bikarbonatnog)[5] jona, HCO−
3, koja je konjugirana baza H
2CO
3, karboksilne kiseline.
Luisova struktura karbonatnog jona ima dve (duge) jednostruke veze sa negativnim atomima kiseonika i jednu kratku dvostruku vezu sa neutralnim kiseonikom.
Ova struktura je nekompatibilna sa uočenom simetrijom jona, što implicira da su tri veze podjednako dugačke i da su tri atoma kiseonika ekvivalentna. Kao i u slučaju izoelektronskog nitratnog jona, simetrija se može postići rezonancom između tri strukture:
Ova rezonanca se može sumirati modelom sa frakcionim vezama i delokalizovanim naelektrisanjem:
Hemijska svojstva[uredi | uredi izvor]
Metalni karbonati se generalno razlažu pri zagrevanju, oslobađajući ugljen-dioksid iz dugotrajnog ciklusa ugljenika u kratkoročni ciklus ugljenika i ostavljajući za sobom oksid metala.[4] Ovaj proces se naziva kalcinacija, po calx, latinskom nazivu živog kreča ili kalcijum oksida, CaO, koji se dobija pečenjem krečnjaka u peći za kreč.
Karbonatna so se formira kada pozitivno naelektrisani jon, M+
, M2+
, ili M3+
, povezuje se sa negativno naelektrisanim atomima jona kiseonika formirajući sa njima elektrostatičku privlačnost, formirajući jonsko jedinjenje:
- 2 M+
+ CO2−
3 → M
2CO
3
- M2+
+ CO2−
3 → MCO
3
- 2 M3+
+ 3 CO2−
3 → M
2(CO
3)
3
Većina karbonatnih soli je nerastvorljiva u vodi na standardnoj temperaturi i pritisku, sa konstantom rastvorljivosti manjim od 1×10−8. Izuzeci su litijum, natrijum, kalijum i amonijum karbonati, kao i mnogi uranijum karbonati.
U vodenom rastvoru, karbonat, bikarbonat, ugljen-dioksid i ugljena kiselina postoje zajedno u dinamičkoj ravnoteži. U jako baznim uslovima preovladava karbonatni jon, dok u slabo baznim uslovima preovladava bikarbonatni jon. U kiselijim uslovima, vodeni ugljen-dioksid, CO2(aq), je glavni oblik, koji je sa vodom, H2O, u ravnoteži sa ugljen-dioksidom – ravnoteža leži snažno prema ugljen-dioksidu. Tako je natrijum karbonat bazan, natrijum bikarbonat je slabo bazan, dok je sam ugljen-dioksid slaba kiselina.
Gazirana voda nastaje rastvaranjem CO2 u vodi pod pritiskom. Kada se parcijalni pritisak CO2 smanji, na primer kada se otvori konzerva gaziranog pića, ravnoteža za svaki od oblika karbonata (karbonat, bikarbonat, ugljen-dioksid i ugljena kiselina) se pomera sve dok koncentracija CO2 u rastvoru ne bude jednaka rastvorljivosti CO2 na toj temperaturi i pritisku. U živim sistemima enzim, karbonska anhidraza, ubrzava međukonverziju CO2 i ugljene kiseline.
Iako su karbonatne soli većine metala nerastvorljive u vodi, isto ne važi i za soli bikarbonata. U rastvoru ova ravnoteža između karbonata, bikarbonata, ugljen-dioksida i ugljene kiseline se stalno menja u skladu sa promenljivim uslovima temperature i pritiska. U slučaju jona metala sa nerastvorljivim karbonatima, kao što je CaCO3, dolazi do formiranja nerastvorljivih jedinjenja. Ovo je objašnjenje za nakupljanje kamenca unutar cevi uzrokovano tvrdom vodom.
Karbonat u neorganskoj nomenklaturi[uredi | uredi izvor]
Sistematski aditivni IUPAC naziv za karbonat anjon je trioksidokarbonat(2−).[1]:127 Slično, cijanidni anjon CN− se naziva nitridokarbonat(1−).[1]:291 Međutim, prateći istu logiku za karbonat(4−) (ortokarbonska kiselina), po sličnosti sa silikatom(4−) (ortosilicijumska kiselina), u sistematskoj nomenklaturi aditiva nema smisla jer ta materija nikada nije identifikovana pod normalnim uslovima temperature i pritiska. Ortokarbonska kiselina je energetski mnogo manje stabilna od ortosilicijumske kiseline i ne može postojati u normalnim uslovima zbog energetski nepovoljne orbitalne konfiguracije jednog centralnog atoma ugljenika vezanog za četiri atoma kiseonika.[1]:287[6]
Organski karbonati[uredi | uredi izvor]
U organskoj hemiji karbonat se takođe može odnositi na funkcionalnu grupu unutar većeg molekula koji sadrži atom ugljenika vezan za tri atoma kiseonika, od kojih je jedan dvostruko vezan. Ova jedinjenja su takođe poznata kao organokarbonati ili karbonatni estri i imaju opštu formulu ROCOOR′, ili RR′CO3. Važni organokarbonati uključuju dimetil karbonat, ciklična jedinjenja etilen karbonat i propilen karbonat i zamenu za fosgen, trifosgen.[7]
Pufer[uredi | uredi izvor]
Karbonat deluje kao pufer u krvi na sledeći način: kada je pH nisko, koncentracija vodonikovih jona je previsoka, te se izdiše CO2. Ovo dovodi do pomeranja jednačine ulevo, suštinskog smanjenja koncentracije H+ jona, što proizvodi bazičniji pH.
Kada je pH previsoko, koncentracija vodonikovih jona u krvi je preniska, te bubrezi izlučuju bikarbonat (HCO−
3). Ovo dovodi do pomeranja jednačine udesno, u suštini povećavajući koncentraciju vodoničnih jona, uzrokujući kiseliji pH.
Tri važne reverzibilne reakcije kontrolišu gornji pH balans:[8]
- H2CO3 ⇌ H+ + HCO−
3 - H2CO3 ⇌ CO2 + H2O
- CO2(aq) ⇌ CO2(g)
Izdahnuti CO2(g) iscrpljuje CO2(aq), što zauzvrat dovodi do utroška H2CO3, izazivajući gore pomenuti pomak ulevo u prvoj reakciji po Le Šateljeovom principu. Po istom principu, kada je pH previsoko, bubrezi izlučuju bikarbonat (HCO−
3) u urin kao urea preko ciklusa uree (ili Krebs-Henselejt ornitinskog ciklusa). Uklanjanjem bikarbonata, više H+ se generiše iz ugljene kiseline (H2CO3), koja dolazi od CO2(g) proizvedenog ćelijskim disanjem.
Važno je naglasiti da ovaj isti pufer deluje u okeanima. On je glavni faktor klimatskih promena i dugotrajnog ciklusa ugljenika, zbog velikog broja morskih organizama (posebno korala) koji se formiraju od kalcijum karbonata. Povećana rastvorljivost karbonata kroz povišene temperature rezultira manjom proizvodnjom morskog kalcita i povećanom koncentracijom atmosferskog ugljen-dioksida. Ovo, zauzvrat, povećava temperaturu Zemlje. Tonaža CO2−
3 je na geološkoj skali i sav može biti ponovo rastvoren u moru i ispušten u atmosferu, povećavajući nivoe CO2 još više.
Prisustvo van Zemlje[uredi | uredi izvor]
Uopšteno se smatra da je prisustvo karbonata u steni jak dokaz za prisustvo tečne vode. Nedavna posmatranja planetarne magline NGC 6302 proizvela su dokaze o postojanju karbonata u svemiru,[9] gde je promena vode slična onoj na Zemlji malo verovatna. Predloženi su i drugi minerali koji bi odgovarali tim zapažanjima.
Do nedavno karbonatni depoziti nisu bili pronađeni na Marsu putem daljinskog istraživanja ili in situ misija, iako marsovski meteoriti sadrže male količine. Podzemne vode su možda postojale u Gusevu[10] i Meridijani Planum.[11]
Reference[uredi | uredi izvor]
- ^ a b v g Međunarodna unija za čistu i primenjenu hemiju (2005). Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). Cambridge (UK): Royal Society of Chemistry – IUPAC. ISBN 0-85404-438-8. Electronic version.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ a b Chisholm, Hugh, ur. (1911). „Carbonates”. Encyclopædia Britannica (na jeziku: engleski) (11 izd.). Cambridge University Press.
- ^ Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005 (PDF), IUPAC, str. 137, Arhivirano (PDF) iz originala 2017-05-18. g.
- ^ Al-Shemali Musstafa; Boldyre Alexander I (2002). „Search for ionic orthocarbonates: Ab initio study of Na4CO4”. J. Phys. Chem. A. 106 (38): 8951—8954. Bibcode:2002JPCA..106.8951A. doi:10.1021/jp020207+.
- ^ Dr. Heiner Eckert; Dr. Barbara Forster (1987). „Triphosgene, a Crystalline Phosgene Substitute”. Angew. Chem. Int. Ed. Engl. 26 (9): 894—895. doi:10.1002/anie.198708941.
- ^ „Archived copy”. Arhivirano iz originala 2011-07-21. g. Pristupljeno 2010-09-05.
- ^ Kemper, F., Molster, F.J., Jager, C. and Waters, L.B.F.M. (2001) The mineral composition and spatial distribution of the dust ejecta of NGC 6302. Astronomy & Astrophysics 394, 679–690.
- ^ Squyres, S. W.; et al. (2007). „Pyroclastic Activity at Home Plate in Gusev Crater, Mars” (PDF). Science. 316 (5825): 738—742. Bibcode:2007Sci...316..738S. PMID 17478719. S2CID 9687521. doi:10.1126/science.1139045. hdl:2060/20070016011
 .
.
- ^ Squyres, S. W.; et al. (2006). „Overview of the Opportunity Mars Exploration Rover Mission to Meridiani Planum: Eagle Crater to Purgatory Ripple” (PDF). Journal of Geophysical Research: Planets. 111 (E12): n/a. Bibcode:2006JGRE..11112S12S. doi:10.1029/2006JE002771
 . hdl:1893/17165.
. hdl:1893/17165.
Spoljašnje veze[uredi | uredi izvor]
- Carbonate/bicarbonate/carbonic acid equilibrium in water: pH of solutions, buffer capacity, titration and species distribution vs. pH computed with a free spreadsheet
- „Carbonate”. Dictionary.com. Pristupljeno 5. 4. 2014.
- „Carbonate”. Dictionary.com. Pristupljeno 5. 4. 2014.




