Алфа хеликс
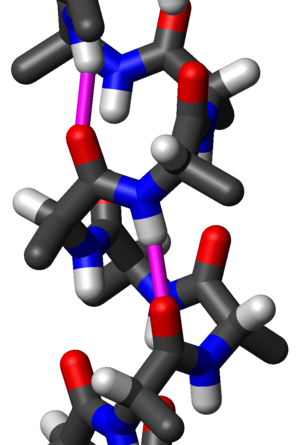
Чест мотив секундарне структуре протеина, алфа хеликс (α-хеликс) је десногира завојита конформација која подсећа на опругу, код које свака алфа-амино (N–H) група ствара водоничну везу са алфа-карбоксилном (C=O) групом аминокиселине 4 остатка раније ( водонична веза).
Полипептидни ланац може формирати различите врсте хеликса које се разликују по броју увијања ланца и по размаку између увијених сегмената полипептида у хеликсу. Оне се образују спонтано, јер су енергетски најсиромашније, а тиме и најстабилније конформације протеина. Хеликс могу да образују и L- и D-аминокиселине, али само једне или друге јер хеликс не може да се образује од пептидног ланца који садржи смешу остатака L- и D-аминокиселина. Хеликси могу бити десногири и левогири, зависно од тога на коју страну се уврће протеински ланац; десногири хеликс је одређен правцем у коме се окрећу прсти десне руке када се палац постави на осу хеликса у правцу у коме се он гради. L-аминокиселине су чешће у природи и оне могу да образују и левогири и десногири хеликс, али већина познатих хеликса у природи су десногири. Међутим, само једна хеликсна конформација истовремено задовољава оптималне услове увијања која даје основу за лако успостављање интрамолекулских водоничних веза између блиских конституената пептидне везе. Та форма се назива α-хеликс и најчешће је присутна у протеинима живих система.
Развој теорије[уреди | уреди извор]
Током раних 1930их, Вилијам Естбури је уочио драстичне промене у дифракцији Икс-зрака на влакнима влажне вуне или косе након примењеног истезања. Подаци су указивали на постојање хеликоидне молекулске структуре са карактеристичним периодом понављања од ~5,1 Å (0,51 nm). Естбури је претпоставио следеће: (1) неистегнути молекули протеина образују хеликс (коју је он назвао α-облик) и (2) истезање доводи до одмотавања хеликса и стварања издуженог стања (које је назвао β-облик). Иако непрецизни у детаљима, Естбуријеви модели ових структура су били суштински исправни и одговарају модерним елементима секундарне структуре, α-хеликсу и β-равни (задржана је Естбуријева номенклатура), које су развили Линус Паулинг, Роберт Коури и Херман Бренсон 1951. године. Ханс Нојрат је први уочио да Естбуријеви модели не могу бити прецизни до детаља, јер су подразумевали преклапање атома. Интересантно, Нојратов рад и Естбуријеви подаци су подстакли Х. С. Тејлора, Мориса Хагинса, Брега и сараднике да предложе модел кератина који подсећа на модерни α-хеликс. Два кључна корака у развоју и обликовању модерног α-хеликса били су: (1) правилна геометрија везе, описана захваљујући методама одређивања кристалне структуре амино киселина и пептида као и Паулинговим предвиђањима планарних пептидних веза и (2) одбацивање идеје о обавезном целом броју остатака по пуном обрту хеликса. Идеја о осовинском моменту се јавила у јануару 1948, када се Паулинг прехладио и легао у кревет. Пошто му је било досадно, нартао је полипептидни ланац приближно тачних димензија на папирној траци и савио је у хеликс, пазећи да пептидне везе одржи планарним. После неколико покушаја, направио је модел са физички вероватним водоночним везама. Затим је наставио рад на потврђивању тог модела са Коријем и Бренсоном пре објављивања.
Структура[уреди | уреди извор]
Геометрија и водоничне везе[уреди | уреди извор]
Аминокиселине се, у алфа-хеликсу, уређују у десногиру увијену (хеликоидну) структуру широку 5,4 Å (0.54 nm). Свака аминокиселина одговара окрету у хеликсу од 100° (тј. хеликс има 3,6 остатака по пуном кругу) и транслацију од 1,5 Å (0.15 nm) дуж осе хеликса. Најважније, N–H група амино киселине гради водоничну везу са C=O групом 4 амино киселине ниже низ ланац. Разлог за овако успостављање водоничних веза у α-хеликсу је то што се тако постиже оптимално растојање од 2,8 Å између О- и Н- атома ових група, па би се водоничне везе могле формирати. Бочне групе аминокиселина у α-хеликсу су окренуте ка спољашњости хеликса што омогућава да се избегне просторна интерференција ових група. α-хеликс је уобичајени елемент секундарне структуре како фиброзних, тако и глобуларних протеина. У глобуларним протеинима α-хеликса су изграђене у просеку од 12 аминокиселина и дужине су око 18 Å, мада су у појединим протеинима нађени и α-хеликси изграђени од 53 аминокиселинска остатка.
Водоничне везе у α-хеликсу су скоро паралелне са уздужном осом. За раскидање водоничних веза потребна је мала енергија (свега 21-42 kJ/mol, скоро десет пута мање него за раскидање ковалентне везе), али α-хеликс представља стабилну структуру, јер у формирању водоничних веза учествује свака пептидна веза, што укупно захтева значајну енергију за дестабилизацију ове структуре.
Ово понављање водоничних веза дефинише α-хеликс. Сличне структуре имају и 310 хеликса () и π-хеликса (). Ове алтернативне завојнице су релативно ретке, иако се 310 хеликс често налази на крају α-хеликса, „затварајући“ је. Привремене структуре (понекад обележаване као δ-хеликси) су примећене као интермедијери у симулацијама молекулске динамике увијања α-хеликса.
А. К. остаци α-хеликса заузимају осовинске (φ, ψ) диедарске углове од приближно (-60°, -45°). У општем случају, они заузимају диедарке углове тако да се ψ диедарски угао једне аминокиселине и φ угао следећег остатка сабирају до вредности од -105° приближно. Сходно томе, диедарски углови α-хеликса се, углавном, смештају на дијагоналне траке Рамахандрановог дијаграма (са падом -1), узимајући вредности од (-90°, -15°) до (-35°, -70°). Поређења ради, сума диедарских углова 310 хеликса је приближно -75°, док је код π-хеликса она -130°. Општа формула за углове ротације Ω по остатку било којег полипептидног хеликоидног ланца са транс изомерима добија се помоћу једначине:
Алфа хеликс је густо пакован; скоро да нема слободног простора унутар њега. Бочни ланци аминокиселина се налазе на спољашњој страни и благо су повијени „надоле“ (према N-терминусу), као гране зимзеленог дрвета. Ова усмереност се понекад користи при прелиминарним мапама (са ниском резолуцијом) електронске густине за одређивање смера увијања протеинске осовине.
Дефиниција осе хеликса[уреди | уреди извор]
Предложено је неколико дефиниција оса хеликса, од којих је Сугета-Мијазавина најједноставнија и најопштија. Све дефиниције су еквивалентне ако сваки остатак хеликса има исту геометрију везе и диедарске углове. Ипак, дефиниције одликује различита осетљивост на промене ових параметара.
Стабилност[уреди | уреди извор]
Хеликси укључени у структуру протеина могу бити грађени од 4 до 40 аминокиселина, али је типичан хеликс грађен од 10 аминокиселина (око три круга). Кратки полипептиди углавном не граде алфа-хеликсе у раствору, пошто ентропијски утрошак енергије уложен за увијање полипептидног ланца није компензован довољним бројем стабилизујићих интеракција. Водоничне везе основне структуре α-хеликса се углавном сматрају слабијим од оних код β-равни и изложене су јаком дејству молекула воде, као растварача. Са друге стране, у нешто хидрофобнијим срединама (као што је ћелијска мембрана, или у присуству других растварача као трифлуороетанола (TFE)) олигопептиди редовно формирају стабилне α-хеликоидне структуре.
Експериментално одређивање[уреди | уреди извор]
Пошто је α-хеликс дефинисан својим водоничним везама, најпоузданије експериметалне методе одређивања α-хеликса, до резолуције појединачних атома, су рендгенска кристалографија или НМР спектроскопија. У неким случајевима, поједине водоничне везе се могу посматрати директно као слаба скаларна спрезања у НМР спектру.
Постоји неколико нискорезолутивних метода за одређивање опште хеликоидне структуре. Хемијски померај у НМР (посебно Cα, Cβ и С’ атома) и резидуално диполарно спрезање су често карактеристике хеликса. Спектар циркуларног дихротоизма хеликса у далекој УЉ области (170-250 nm) је веома карактеристичан, са израженим двоструким минимумом на ~208 nm и ~222 nm. Инфрацрвена спектроскопија се ретко користи, пошто спектар α-хеликса подсећа на спектар насумичне завојнице (додуше, спектри се могу разликовати, нпр. помоћу водонично-деутеријумске замене). Коначно, криоскопска електронска микроскопија је данас у могућности да разазнаје појединачне α-хеликсе унутар протеина, док је примена ове методе на одређивање појединих остатака још предмет истраживања.
Дуги хомополимери амино киселина, ако су растворљиви, често граде хеликсе. Такви дуги, изоловани хеликси могу се детектовати другим методама, као што су диелектрична релаксација, или хидродинамичка техника за мерење ротационих дифузионих константи. Строго говорећи, ове методе само детектују карактеристични пролатни (дугуљасти), хидродинамични облик хеликса, или његов велики диполни момент.
Заступљеност аминокиселина и њихов афинитет према α-хеликсу[уреди | уреди извор]
Различите секвенце аминокиселина имају различите афинитете за формирање α-хеликалне структуре. Метионин, аланин, леуцин, глутаминска киселина и лизин ("MALEK" у једнословним кодовима аминокиселина) имају веома високе афинитете према α-хеликсу. Пролин тежи да раскине или уврне хеликс, пошто не може да донира протон за водоничну везу (јер нема амидни водоников атом) и зато што његов бочни ланац стерно интерагује. Његова прстенаста структура такође ограничава централни φ диедарски угао на вредности око -70°, што се ретко виђа код α-хеликса. Ипак, пролин је често први члан хеликса, вероватно због своје структурне крутости. Са друге стране, глицин такође тежи да поремети хеликалну структуру, зато што га висока конформациона флексибилност чини ентропијски прејаким да заузме релативно спутану α-хеликалну структуру.
Диполни момент[уреди | уреди извор]
Хеликс има мерљив укупан диполни момент изазван ефектом нагомилавања појединачних дипола карбонилних група пептидне везе дуж осе. Ова појава може довести до дестабилизације хеликса кроз ентропијске ефекте. Као резултат, α-хеликси често почињу на N-терминалном крају са негативно наелектрисаном аминокиселином, као што је глутаминска киселина, како би се неутралисао овај диполни момент хеликса. Ређе (и мање ефективно) је завршавање ланца на С-крају са аминокиселином са позитивним остатком, као што је лизин. Позитиван набој на N-терминусу се углавном користи да веже негативно наелектрисане лиганде, као што су фосфатне групе, што је веома ефикасно, јер амиди примарне структуре могу да служе као донори протона водоничне везе.
Суперструктуре[уреди | уреди извор]
Миоглобин, први протеин чија је структура одређена рендгенском кристалографијом, састављен је од приближно 70% алфа хеликса, при чему остатак чине области неуређених кривина.
Упредене завојнице алфа хеликса су веома стабилни облици у којима се две или више хеликса међусобно уплићу у „суперхеликалну“ структуру. Упредене завојнице имају веома карактеристичан понављајући мотив познат као хептадни остатак, у којем се основни мотив понавља сваких седам аминокиселина дуж низа. Прва и посебно четврта аминокиселина (на тзв. а и h местима) су скоро увек хидрофобне (четврта а. к. је обично леуцин) и густо паковане унутар намотаја хеликса. Пети и седми остатак (на е и g местима), углавном имају супротна наелектрисања и граде јонски мост стабилизован електростатичким интеракцијама. Фиброзни протеини, као кератин и миозин, често граде упредене завојнице, као и неки димеризујући протеини. Пар упредених завојница – намотај од 4 хеликса – је веома чест структурни мотив у протеинима. Нпр. налази се у структури хормона раста човека и неколико варијетета цитохрома. Ропов протеин, који убрзава умножавање плазмида у бактеријама је занимљив случај у којем један полипептид формира упредену завојницу, а два таква мономера се спајају дајући намотај од 4 хеликса.
Аминокиселине које граде дати хеликс могу се приказати на хеличном точку, приказу који илуструје оријентацију аминокиселина које граде хеликс. Често у глобуларним протеинима, као и у посебним структурама попут упредене завојнице и леуцинског рајсфершлуса, алфа хеликс ће испољити два „лица“ – једно, које првенствено садржи хидрофобну аминокиселину, оријентисану ка унутрашњости протеина, ка хидрофобном језгру; и друго, које је углавном састављено од поларних аминокиселина, оријентисаних ка површини протеина изложеној растварачу.
Функционалне улоге[уреди | уреди извор]
α-хеликси имају посебан значај у структурама које учествују у метаболизму ДНК, укључујући мотиве типа хеликс-окрет-хеликс, леуцински рајсфершлус и цинк-прст. Све то, због згодне структурне особине да је пречник α-хеликса 1,2 нанометра, исти као и ширина великог жлеба у B-облику ДНК.
Прелаз из хеликса у завојницу[уреди | уреди извор]
Хомополимери аминокиселина (као поли-лизин) могу да усвоје α-хеликалну структуру на ниским температурама, која се „топи“, размотава, на вишој. Овај прелаз из хеликса у завојницу се раније сматрао аналогним денатурацији протеина. Статистичка механика овог прелаза се може моделовати коришћењем елегантне методе матрице прелаза, коју карактеришу два параметра: склоност ка увијању хеликса и склоност ка растезању исте.
Литература[уреди | уреди извор]
- Carl Branden and John Tooze. 1999. Introduction to Protein Structure 2nd ed. Garland Publishing: New York, NY.
- Eisenberg, D. (2003). „The discovery of the alpha-helix and beta-sheet, the principal structural features of proteins”. Proceedings of the National Academy of Sciences of the United States of America. 100 (20): 11207—11210. PMC 208735
 . PMID 12966187. doi:10.1073/pnas.2034522100
. PMID 12966187. doi:10.1073/pnas.2034522100  .
. - John Kendrew et al. 1960. The structure of myoglobin: a three-dimensional Fourier synthesis and 2Â resolution. Nature 185: 422-7.
- Astbury WT and Woods HJ. "The Molecular Weights of Proteins", . Nature. 127: 663—665. 1931. Недостаје или је празан параметар
|title=(помоћ). - Astbury WT and Street A. (1931) "X-ray studies of the structures of hair, wool and related fibres. I. General", Trans. R. Soc. Lond., A230, 75-101.
- Astbury WT. "Some Problems in the X-ray Analysis of the Structure of Animal Hairs and Other Protein Fibers", . Trans. Faraday Soc. 29: 193—211. 1933. Недостаје или је празан параметар
|title=(помоћ). - Astbury WT and Woods HJ. (1934) "X-ray studies of the structures of hair, wool and related fibres. II. The molecular structure and elastic properties of hair keratin", Trans. R. Soc. Lond., A232, 333-394.
- Astbury WT and Sisson WA. (1935) "X-ray studies of the structures of hair, wool and related fibres. III. The configuration of the keratin molecule and its orientation in the biological cell", Proc. R. Soc. Lond., A150, 533-551.
- Neurath H. "Intramolecular folding of polypeptide chains in relation to protein structure", . J. Phys. Chem. 44: 296—305. 1940. Недостаје или је празан параметар
|title=(помоћ). - Taylor HS. "Large molecules through atomic spectacles", . Proc. Am. Philos. Soc. 85: 1—12. 1942. Недостаје или је празан параметар
|title=(помоћ). - Huggins M. "The structure of fibrous proteins", . Chem. Rev. 32: 195—218. 1943. Недостаје или је празан параметар
|title=(помоћ). - Bragg L, Kendrew JC and Perutz MF. (1950) "Polypeptide chain configurations in crystalline proteins", Proc. Roy. Soc., A203, 321.
- Pauling L, Corey RB and Branson HR. "The Structure of Proteins: Two Hydrogen-Bonded Helical Configurations of the Polypeptide Chain", . Proc. Nat. Acad. Sci. Wash. 37: 205. 1951. Недостаје или је празан параметар
|title=(помоћ). - Sugeta H and Miyazawa T. "General Method for Calculating Helical Parameters of Polymer Chains from Bond Lengths, Bond Angles, and Internal-Rotation Angles", . Biopolymers. 5: 673—679. 1967. Недостаје или је празан параметар
|title=(помоћ). - Wada A. "The α-helix as an electric macro-dipole", . Adv. Biophys. 9: 1—63. 1976. Недостаје или је празан параметар
|title=(помоћ). - Chothia C, Levitt M and Richardson D. "Structure of proteins:Packing of α-helices and pleated sheets", . Proceedings of the National Academy of Science USA. 74: 4130—4134. 1977. Недостаје или је празан параметар
|title=(помоћ). - Chothia C, Levitt M and Richardson D. "Helix to Helix Packing in Proteins", . Journal of Molecular Biology. 145: 215—250. 1981. Недостаје или је празан параметар
|title=(помоћ). - Hol WGJ. "The role of the α-helix dipole in protein function and structure", . Prog. Biophys. Mol. Biol. 45: 149—195. 1985. Недостаје или је празан параметар
|title=(помоћ). - Barlow DJ and Thornton JM. "Helix Geometry in Proteins", . J. Mol. Biol. 201: 601—619. 1988. Недостаје или је празан параметар
|title=(помоћ). - Murzin AG and Finkelstein AV. "General architecture of the α-helical globule", . Journal of Molecular Biology. 204: 249—269. 1988. Недостаје или је празан параметар
|title=(помоћ).





![{\displaystyle 3\cos \Omega =1-4\cos ^{2}\left[\left(\phi +\psi \right)/2\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/289a67463099a87877ac9fca00daf052bb2edd9a)