Ензим разградње гликогенских грана
| Амило-α-1,6-глукозидаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Ензим кресања грана код Е. цоли | |||||||||
| Идентификатори | |||||||||
| ЕЦ број | 3.2.1.33 | ||||||||
| ЦАС број | 9012-47-9 | ||||||||
| Базе података | |||||||||
| ИнтЕнз | ИнтЕнз преглед | ||||||||
| БРЕНДА | БРЕНДА приступ | ||||||||
| ЕxПАСy | НицеЗyме преглед | ||||||||
| КЕГГ | КЕГГ приступ | ||||||||
| МетаЦyц | метаболички пут | ||||||||
| ПРИАМ | профил | ||||||||
| Структуре ПБП | РЦСБ ПДБ ПДБе ПДБј ПДБсум | ||||||||
| Онтологија гена | АмиГО / ЕГО | ||||||||
| |||||||||
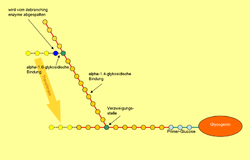
Ензим разлагања гликогенских грана или ензим кресања грана је молекул који учествује у разградњи гликогена, складишта глукозе у телу, активношћу глукозилтрансфераза и глукозидаза. Заједно са фосфорилазама, ови ензими мобилишу резерве глукозе из гликогенских наслага у мишићима и јетри. Ово представља главни извор енергетских резерви у већини организама. Разградња гликогена у телу је високо регулирана, посебно у јетри, путем разних хормона, укључујући инсулин и глукагон, да би се одржао хомеостатски баланс нивоа глукозе у крви. Када је разградња гликогена угрожена мутацијама у синтези овог ензима, јављају се метаболичке болести, као што је болест гликогенске потхрањеноси типа III.
Код сисара, квасаца и неких бактерија, глукозилтрансфераза и глукозидаза се јављају у једном ензиму, док код Е. цоли и других бактерија, то чине два различита ензима, што компликује номенклатуру. Протеини који катализирају обе функције се називају гликоген ензими за разлагање гликогенских грана или ензими кресања гликогенских грана (ГДЕ). Када се глукозилтрансфераза и глукозидаза катализују различитим ензимима, назив се обично односи на глукозидазни ензим.[1][2]

.
Структура и активност[уреди | уреди извор]
Два ензима[уреди | уреди извор]
Код Escherichia coli и других бактерија, глукозилтрансфераза и глукозидаза делују путем два различита ензима. Код Е. цоли, трансфер глукозе обавља 4-алфа-глуканотрансфераза, протеин од 78,5 кДа, који је кодиран геном малQ. Други протеин, звани ензим за отклањане грана, разлагање обавља алфа-1,6-глукоза. Овај ензим има молекулску масу од 73,6 кДа, а кодиран геном глгX. Активност ова два ензима не одвија се увек нужно заједно. Код E. coli glgX селективно катализује разлагање 4-подединичне гране, без акције глуканотрансферазе. Производ овог разлагања, малтотетраоза, додатно деградира малтодекстрин фосфорилаза.[3][4][5]
Ген ГлгX Е. цоли је структурно сличан протеину изоамилази. Мономерни протеин садржи централни домен у којем је осам паралелних бета-ланаца окружено са осам паралелних алфа нити. Унутар ове структуре је расцеп дужине 26 ангстрема, а широк 9 ангстрема, који садржи ароматске остатке за које се сматра да, пре разлагања, стабилизују четвероглукозне гране.[1]
Један ензим са два каталитска места[уреди | уреди извор]
Код сисара и квасаца, један ензим обавља обе функције уклањања гликогенских грана. Људски ензим уклањања грана гликогена (ген: АГЛ) је мономер с молекулском масом од 175 кДа. Доказано је да две каталитске акције АГЛ могу функционисати независно једна од друге, што показује да је присутно више активних места. Ова појава је ојачана активним местом инхибитора, као што је полихидроксиамин, за који је утврђено да инхибира глукозидазну активност док трансферазна није мерљиво промењена. Ензим за разлагање гликогенских грана је једини познати еукариотски ензим који садржи више каталитских места и који је активан као мономер.
Неке студије су показале да је пола квашћевих ГДЕ C-крајева повезано са глукозидазном активности, док је пола Н-крајева повезано са активности глукозилтрансферазе. Осим ова два активна места, чини се да АГЛ садржи и треће активно место који омогућава да се веже за гликогенски полимер. Иако је комплетна структура ГДЕ код еукариота тек треба да се утврди, мисли се да се вежу за шестомолекулске ланце глукозе као и разгранате глукозе, што одговара седам подединица у активном мјесту, као што је приказано на слици испод.[6][7][8][9][10][11][12][13][14][15][16]

Може се уочити да када је глукоза у активном месту 'А', 'Б', 'C' и '0' је најбрже хидролизирају. Ово указује да је овај регион веза ланца гликогена најјачи на активном месту, јер јача интеракција између ензима и супстрата доводи до брже хидролизе. Упркос овом напретку, комплетна структура ГДЕ код еукариота тек треба да се утврди. Ензими који разлажу гликоген код археја Sulfolobus solfataricus су боље окарактерисани од оних код еукариота. ГДЕ у S. solfataricus је познат као Треx. Иако, као и сисарски ГДЕ, Треx има и амилозидазне и глуканотрансферазне функције, Треx је структурно сличан глгX и има масу од 80 кД и једно активно место. За разлику од глгX или АГЛ, међутим, Треx у раствору постоји као димер и тетрамер. Изгледа да олигомерни облик Трекса има значајну улогу у измени и облика и функције ензима. Сматра се да димеризација стабилизује „флексибилне петље” које се налазе у непосредној близини активног места. То може бити кључ за објашњење зашто ТРЕX (и не глгX) испољава глукозилтрансферазну активност. Као тетрамера, каталитске ефикасности ТРЕX су повећана четири пута, у односу на свој димерни облик.[7][8][1][11]
Генетичка локција[уреди | уреди извор]
Службени назив за ген је „амило- α-1,6- глукозидаза, α- глуканотрансфераза 4-”, са службеним симболом АГЛ. АГЛ је аутозомни ген који се налази на хромозому 21, позиција: лп21. АГЛ ген садржи упутства за израду неколико различитих верзија, познатих као [[изоформа|изоформе, ензима за разлагање гликогенских грана. Ове изоформе разликују се по величини и испољавају се у различитим ткивима, као што су јетра и мишићи. Овај ген је студиран у детаље, јер његова мутација је узрок болести складиштења гликогена, типа III.
Ген је дуг 85 кб, а има 35 ексона и кодира за 7,0 кб-иРНК. Транслација гена почиње у егзону 3, који кодира првих 27 аминокиселина АГЛ, јер су прва два егзона (68кб) садрже непреведене 5' регије. Ексони 4-35 кодирају преосталих 1.505 аминокиселина које кодира АГЛ ген.[17][18][19][20]
Клинички значај[уреди | уреди извор]
Када је угрожена активност ГДЕ, тело не може ефикасно отпуштати ускладиштени гликоген, па се јавља тип III болести складиштења гликогена (због недостатка ензима), што је аутозомно рецесивни поремећај. Разградња ГСД III гликоген је непотпуна и не постоји акумулација абнормалног гликогена са кратким вањским гранама.
Већина пацијената показују недостатак ГДЕ и у јетри и мишићима (тп ИИИа), иако 15% пацијената садржи ГДЕ у мишићима, а који је одсутан из јетри (Тип ИИИб). Зависно од места мутације, различите мутације у АГЛ гену могу утицати на различите изоформе експресије гена. На пример, мутације које се јављају на егзону 3, утичу на облик који делује на изоформе које су је првенствено изражене у јетри; то доводи до појаве ГСД тип III.
Ове различите манифестације производе разноврсне симптоме, који могу бити готово исти као код типа I ГСД, укључујући и хепатомегалију, хипогликемију код деце, низак раст, миопатије и кардиопатије.
Пацијенти са типом ИИИа често имају симптоме који се односе на болести јетре и прогресију у мишићнима, са варијацијама који су условљени годином почетка, стопом прогресије и озбиљности болести. Пацијенти с Тип ИИИб обично симптоме који се односе на болест јетре.[20] Пацијенти са типом III се разликују по повишеним ензимом јетре, са нормалним разинам мокраћне киселине и лактата у крви, за разлику од других облика ГСД. У пацијената са укљученошћу мишића, тип ИИИа, мишићна слабост постаје доминантна у одраслом добу и може довести до хипертрофије срчаних комора и дисталних мишића.
Референце[уреди | уреди извор]
- ^ а б в Сонг ХН, Јунг ТY, Парк ЈТ, Парк БЦ, Мyунг ПК, Боос W, Wоо ЕЈ, Парк КХ (јун 2010). „Струцтурал ратионале фор тхе схорт бранцхед субстрате специфицитy оф тхе глyцоген дебранцхинг ензyме ГлгX”. Протеинс. 78 (8): 1847—55. ПМИД 20187119. дои:10.1002/прот.22697.
- ^ Бао Y, Даwсон ТЛ, Цхен YТ (децембар 1996). „Хуман глyцоген дебранцхинг ензyме гене (АГЛ): цомплете струцтурал организатион анд цхарацтеризатион оф тхе 5' фланкинг регион”. Геномицс. 38 (2): 155—65. ПМИД 8954797. дои:10.1006/гено.1996.0611.
- ^ Цхен YТ, Хе ЈК, Динг ЈХ, Броwн БИ (децембар 1987). „Глyцоген дебранцхинг ензyме: пурифицатион, антибодy цхарацтеризатион, анд иммуноблот аналyсес оф тyпе III глyцоген стораге дисеасе”. Ам. Ј. Хум. Генет. 41 (6): 1002—15. ПМЦ 1684360
 . ПМИД 2961257.
. ПМИД 2961257.
- ^ „Глyцоген дебранцхинг ензyме - Хомо сапиенс (Хуман)”. УниПрот.
- ^ Гиллард БК, Wхите РЦ, Зингаро РА, Нелсон ТЕ (септембар 1980). „Амyло-1,6-глуцосидасе/4-алпха-глуцанотрансферасе. Реацтион оф раббит мусцле дебранцхинг ензyме wитх ан ацтиве сите-дирецтед ирреверсибле инхибитор, 1-С-диметхyларсино-1-тхио-бета-D-глуцопyраносиде”. Ј. Биол. Цхем. 255 (18): 8451—7. ПМИД 6447697.
- ^ Гиллард БК, Нелсон ТЕ (септембар 1977). „Амyло-1,6-глуцосидасе/4-алпха-глуцанотрансферасе: усе оф реверсибле субстрате модел инхибиторс то студy тхе биндинг анд ацтиве ситес оф раббит мусцле дебранцхинг ензyме”. Биоцхемистрy. 16 (18): 3978—87. ПМИД 269742. дои:10.1021/би00637а007.
- ^ а б Wоо ЕЈ, Лее С, Цха Х, Парк ЈТ, Yоон СМ, Сонг ХН, Парк КХ (октобар 2008). „Струцтурал инсигхт инто тхе бифунцтионал мецханисм оф тхе глyцоген-дебранцхинг ензyме ТреX фром тхе арцхаеон Сулфолобус солфатарицус”. Ј. Биол. Цхем. 283 (42): 28641—8. ПМЦ 2661413
 . ПМИД 18703518. дои:10.1074/јбц.М802560200.
. ПМИД 18703518. дои:10.1074/јбц.М802560200.
- ^ а б „ТреX - Ацтинопланес сп. СН223/29”. УниПрот.
- ^ „Глyцоген дебранцхинг ензyме - Есцхерицхиа цоли О139:Х28 (страин Е24377А / ЕТЕЦ)”. УниПрот.
- ^ „4-алпха-глуцанотрансферасе - Есцхерицхиа цоли (страин К12)”.
- ^ а б Парк ЈТ, Парк ХС, Канг ХК, Хонг ЈС, Цха Х, Wоо ЕЈ, Ким ЈW, Ким МЈ, Боос W, Лее С, Парк КХ (2008). „Олигомериц анд фунцтионал пропертиес оф а дебранцхинг ензyме (ТреX) фром тхе арцхаеон Сулфобус солфатарицус П2.”. Биоцаталyсис анд Биотрансформатион. 26: 76—85. дои:10.1080/10242420701806652.
- ^ Таленте ГМ, Цолеман РА, Алтер C, Бакер L, Броwн БИ, Цаннон РА, Цхен YТ, Цриглер ЈФ, Ферреира П, Хаwортх ЈЦ, Херман ГЕ, Иссенман РМ, Кеатинг ЈП, Линде Р, Рое ТФ, Сениор Б, Wолфсдорф ЈИ (фебруар 1994). „Глyцоген стораге дисеасе ин адултс”. Анн. Интерн. Мед. 120 (3): 218—26. ПМИД 8273986. дои:10.7326/0003-4819-120-3-199402010-00008.
- ^ С, Сатдарсхан П.. Монга (2010). Молецулар Патхологy оф Ливер Дисеасес (Молецулар Патхологy Либрарy). Берлин: Спрингер. ИСБН 978-1-4419-7106-7.
- ^ Хондох Х, Сабури W, Мори Х, et al. (2008). „Субстрате рецогнитион мецханисм оф алпха-1,6-глуцосидиц линкаге хyдролyзинг ензyме, деxтран глуцосидасе фром Стрептоцоццус мутанс”. Ј. Мол. Биол. 378 (4): 913—22. ПМИД 18395742. дои:10.1016/ј.јмб.2008.03.016.
- ^ МцЦартер ЈД, Wитхерс СГ (децембар 1994). „Мецханисмс оф ензyматиц глyцосиде хyдролyсис”. Цурр. Опин. Струцт. Биол. 4 (6): 885—92. ПМИД 7712292. дои:10.1016/0959-440X(94)90271-2.
- ^ Yамамото Е, Макино Y, Омицхи К (мај 2007). „Ацтиве сите маппинг оф амyло-алпха-1,6-глуцосидасе ин порцине ливер глyцоген дебранцхинг ензyме усинг флуорогениц 6-О-алпха-глуцосyл-малтоолигосаццхаридес”. Ј. Биоцхем. 141 (5): 627—34. ПМИД 17317688. дои:10.1093/јб/мвм065.
- ^ С, Цхиба (август 1997). „Молецулар мецханисм ин алпха-глуцосидасе анд глуцоамyласе”. Биосци. Биотецхнол. Биоцхем. 61 (8): 1233—9. ПМИД 9301101. дои:10.1271/ббб.61.1233.
- ^ „Генес (Генетиц Хоме Референце а сервице оф У.С. Натионал Либрарy оф Медицине.”. Приступљено 29. 2. 2012.
- ^ Схен Ј, Бао Y, Лиу ХМ, Лее П, Леонард ЈВ, Цхен YТ (јул 1996). „Мутатионс ин еxон 3 оф тхе глyцоген дебранцхинг ензyме гене аре ассоциатед wитх глyцоген стораге дисеасе тyпе III тхат ис дифферентиаллy еxпрессед ин ливер анд мусцле”. Ј. Цлин. Инвест. 98 (2): 352—7. ПМЦ 507437
 . ПМИД 8755644. дои:10.1172/ЈЦИ118799.
. ПМИД 8755644. дои:10.1172/ЈЦИ118799.
- ^ а б Кисхнани ПС, Аустин СЛ, Арн П, et al. (јул 2010). „Глyцоген стораге дисеасе тyпе III диагносис анд манагемент гуиделинес”. Генет. Мед. 12 (7): 446—63. ПМИД 20631546. дои:10.1097/ГИМ.0б013е3181е655б6.
Спољашње везе[уреди | уреди извор]
- GeneReviews/NCBI/NIH/UW entry on Glycogen Storage Disease Type III
- OMIM entries on Glycogen Storage Disease Type III
- Глyцоген+дебранцхинг+ензyме на US National Library of Medicine Medical Subject Headings (MeSH)
