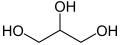
Глицерол
| |||

| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
propan-1,2,3-triol
| |||
| Drugi nazivi
glicerin
propan-1,2,3-triol 1,2,3-propantriol 1,2,3-trihidroksipropan gliceritol glicil alkohol | |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.000.263 | ||
| E-brojevi | E422 (zgušnjivači, ...) | ||
| UNII | |||
| |||
| Svojstva | |||
| C3H5(OH)3 | |||
| Molarna masa | 92,09382 g/mol | ||
| Agregatno stanje | čista, bezbojna, higroskopna tečnost | ||
| Miris | bez mirisa | ||
| Gustina | 1,261 g/cm³ | ||
| Tačka topljenja | 17.8°C (64.2 °F) | ||
| Tačka ključanja | 290°C (554 °F)[3] | ||
| Indeks refrakcije (nD) | 1.4746 | ||
| Viskoznost | 1.2 Pa·s | ||
| Opasnosti | |||
| Bezbednost prilikom rukovanja | JT Baker | ||
| NFPA 704 | |||
| Tačka paljenja | 160°C (otvoren sud) 176°C (zatvoren sud) | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
Glicerol (glicerin) je jednostavno poliolno jedinjenje. To je bezbojna, bezmirisna, viskozna tečnost koja je u širokoj upotrebi u farmaceutskoj formulaciji. Glicerol sadrži tri hidrofilne hidroksilne grupe koje su odgovorne za njegovu rastvorljivost u vodi i njegovu higroskopnu prirodu. Glicerolna osnova je centralna strukturna komponenta svih lipida poznatih kao trigliceridi. Glicerol ima sladak ukus i nisku toksičnost.
Proizvodnja[уреди | уреди извор]
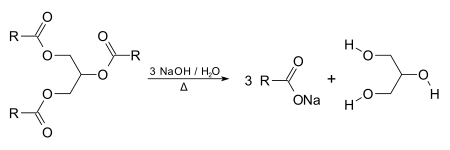
Glicerol formira osnovu triglicerida, i može biti proizveden saponifikacijom masti, npr. on je nusproizvod pravljenja sapuna.
On je takođe sporedni proizvod proizvodnje biodizela putem transesterifikacije. Trigliceridi (1) reaguju sa alkoholom poput etanola (2) u prisustvu katalitičke baze čime nastaju etil estri masnih kiselina (3) i glicerol (4):
Glicerol se može proizvesti različitim putevima iz propilena. Epihlorohidrinski proces je najvažniji. On se sastoji od hlorinacije propilena čime se formira alil hlorid, koji se oksidira hipohloritom do dihlorohidrina, koji reaguje sa jakom bazom i formira epihlorohidrin. Epihlorohidrin se hidrolizuje do glicerola.[4]
Reference[уреди | уреди извор]
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Milne, George W. A.; Lide, David R. (1994). Handbook of data on organic compounds. Boca Raton: CRC Press. ISBN 978-0-8493-0445-3.
- ^ Christoph, Ralf; Schmidt, Bernd; Steinberner, Udo; Dilla, Wolfgang; Karinen, Reetta (2006). „Glycerol”. Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a12_477.pub2.
Literatura[уреди | уреди извор]
- Milne, George W. A.; Lide, David R. (1994). Handbook of data on organic compounds. Boca Raton: CRC Press. ISBN 978-0-8493-0445-3.