Sindrom iscrpljivanja mitohondrijske DNK
| Sindrom iscrpljivanja mitohondrijske DNK | |
|---|---|
| Sinonimi | mtDNA depletion syndrome |
 | |
| Sindrom iscrpljivanja mitohondrijalne DNK nasleđuje se na autozomno recesivan način | |
| Specijalnosti | genetika, neurologija |
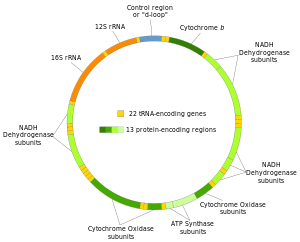
Sindromi iscrpljivanja mitohondrijske DNK (mtDNK) (akronim MDDS) su grupa klinički heterogenih autozomno recesivnih poremećaja koje karakteriše ozbiljno kvantitativno smanjenje ukupne mtDNK, genetskog materijala prisutnog isključivo unutar mitohondrija. Mitohondrijski genom (mtDNK) je kružni genom od 16,5 kb, koji kodira 13 podjedinica respiratornog lanca i 24 RNK molekula neophodna za intramitohondrijsku translaciju ovih 13 proteina. Za razliku od nuklearne DNK, gde svaka ćelija sadrži dve kopije svakog gena (po jednu kopiju od svakog roditelja), Mitohondrijski genom je genom sa više kopija, a svaka ćelija sadrži hiljade kopija. Smanjenje mtDNK je definisano kao rezidualni broj kopija mtDNK od <30% u poređenju sa kontrolama koje odgovaraju uzrastu, ali nivoi mtDNK su često <10%, a ponekad i samo 1-2% kontrola, posebno u hepatocerebralnom obliku bolesti.
Klinička slike sindroma iscrpljivanja mitohondrijske DNK uključuju ranu hepatocerebralnu bolest koja se preklapa sa Alpersovim sindromom, izolovanu miopatiju, encefalomiopatiju isindrom mitohondrijalne neurogastrointestinalna encefalomiopatije (MNGIE).
Sindrom iscrpljivanja mitohondrijske DNK može biti uzrokovan recesivnim defektima u proteinima uključenim u replikaciju mtDNK (pravljenje kopija mtDNK) ili u proteinima koji sintetišu deoksiribonukleozid trifosfate (dNTP) za ugradnju u mtDNK. Oba tipa defekta će verovatno izazvati zastoj kompleksa replikacije,3 mehanizam koji je takođe važan u generisanju višestrukih delecija mtDNK, još jedan nedostatak u održavanju mtDNK.
Alpersov sindrom i srodni hepatocerebralni poremećaji predstavljaju najčešću podgrupu sindroma iscrpljivanja mitohondrijske DNK, uzrokovanu mutacijama u POLG genu koji kodira katalitičku podjedinicu mitohondrijalne DNK polimeraze γ, enzima odgovornog za replikaciju mtDNK.
Alpersov sindrom se karakteriše teškom epilepsijom i disfunkcijom jetre, ali bilo koji problem se može pojaviti izolovano. Kod pacijenata sa POLG mutacijama i Alpersovim sindromom, stepen deplecije mtDNK tkiva ima određenu korelaciju sa kliničkom težinom.
Klinička slika[uredi | uredi izvor]
Svi oblici sindroma iscrpljivanja mitohondrijske DNK su veoma retki. Dok sindrom iscrpljivanja mitohondrijske DNK izaziva širok spektar simptoma, koji se mogu pojaviti kod novorođenčadi, odojčadi, dece ili odraslih, u zavisnosti od klase sindroma iscrpljivanja mitohondrijske DNK. Takođe unutar svake klase simptomi su takođe različiti.[1]
Kod sindroma iscrpljivanja mitohondrijske DNK povezanih sa mutacijama u TK2, novorođenčad se generalno razvija normalno, ali oko dve godine starosti počinju da se pojavljuju simptomi opšte slabosti mišića (nazvane „hipotonija“), umora, nedostatka izdržljivosti i poteškoća u hranjenju. Neka deca počinju da gube kontrolu nad mišićima na licu, ustima i grlu i mogu imati poteškoća sa gutanjem. Motoričke veštine koje su bile naučene mogu biti izgubljene, ali generalno ne utiče na funkcionisanje mozga i sposobnost razmišljanja.[1]
Kod sindroma iscrpljivanja mitohondrijske DNK povezanih sa mutacijama u SUCLA2 ili SUCLG1 koje prvenstveno utiču na mozak i mišiće, hipotonija se generalno javlja kod novorođenčadi pre 6 meseci starosti, njihovi mišići počinju da se troše i postoji kašnjenje u psihomotoričkom učenju (učenje osnovnih veština kao što su hodanje, pričanje , i namerno, koordinisano kretanje). Kičma često počinje da se krivi (skolioza ili kifoza), a dete često ima abnormalne pokrete (distonija, atetoza ili koreja), otežano hranjenje, refluks kiseline, gubitak sluha, zaostajanje u rastu i otežano disanje što može dovesti do čestih infekcija pluća. Ponekad se razvije epilepsija.[1]
U sindromu iscrpljivanja mitohondrijske DNK povezanim sa mutacijama u RRM2B koje prvenstveno utiču na mozak i mišiće, ponovo postoji hipotonija u prvim mesecima, simptomi laktacidoze kao što su mučnina, povraćanje i brzo duboko disanje, neuspeh u razvoju, uključujući ostanak male glave, kašnjenje ili nazadovanje kod kretanja i gubitka sluha. Mnogi sistemi tela su pogođeni.[1][2] Slučaj Čarlija Garda je bio povezan sa ovim podoblikom bolesti.[3]
U sindromu iscrpljivanja mitohondrijske DNK povezanim sa mutacijama u DGUOK-u koje prvenstveno utiču na mozak i jetru, postoje dva oblika. Postoji rani oblik u kome simptomi nastaju zbog problema sa mnogim organima u prvoj nedelji života, posebno simptomi laktacidoze kao i nizak nivo šećera u krvi. U roku od nekoliko nedelja od rođenja mogu razviti otkazivanje jetre i povezanu žuticu i oticanje abdomena, kao i mnoge neurološke probleme, uključujući zastoj u razvoju i regresiju, i nekontrolisano kretanje očiju. Retko u ovoj klasi već retkih bolesti, simptomi koji se odnose na bolest jetre pojavljuju se kasnije u detinjstvu ili u detinjstvu.[1]
Kod sindroma iscrpljivanja mitohondrijske DNK povezanih sa mutacijama u MPV17 koje prvenstveno utiču na mozak i jetru, simptomi su slični onima uzrokovanim DGUOK-om i takođe se pojavljuju ubrzo nakon rođenja, uglavnom sa manje i manje ozbiljnih neuroloških problema. Postoji podskup ljudi Navaho porekla koji razvijaju Navaho neurohepatopatiju, koji pored ovih simptoma takođe imaju lako lomljene kosti koje ne izazivaju bol, deformisane ruke ili stopala i probleme sa rožnjačom.[1]
Kod sindroma iscrpljivanja mitohondrijske DNK povezanih sa mutacijama u POLG-u koje prvenstveno utiču na mozak i jetru,[4] simptomi su veoma raznovrsni i mogu se pojaviti u bilo kom trenutku od rođenja do starosti. Prvi znaci bolesti, koji uključuju teško izlečive napade i neispunjavanje značajnih razvojnih prekretnica, obično se javljaju u detinjstvu, nakon prve godine života, ali ponekad i do pete godine. Primarni simptomi bolesti su zaostajanje u razvoju, progresivna intelektualna ometenost, hipotonija (nizak tonus mišića), spastičnost (ukočenost udova) koja može dovesti do kvadriplegije i progresivne demencije. Napadi mogu uključivati epilepsiju partialis continua, vrstu napada koja se sastoji od ponovljenih miokloničnih (mišićnih) trzaja. Može se javiti i optička atrofija, koja često dovodi do slepila. Može doći i do gubitka sluha. Pored toga, iako fizički znaci hronične disfunkcije jetre možda nisu prisutni, mnogi ljudi pate od oštećenja jetre što dovodi do otkazivanja jetre.[5][6]
U sindromu iscrpljivanja mitohondrijske DNK povezanim sa mutacijama u PEO1/C10orf2 koje prvenstveno utiču na mozak i jetru, simptomi se javljaju ubrzo nakon rođenja ili u ranom detinjstvu, sa hipotonijom, simptomima laktacidoze, uvećanom jetrom, problemima hranjenja, nedostatkom rasta i kašnjenjem psihomotorike. veštine. Neurološki, razvoj je usporen ili zaustavljen i pojavljuje se epilepsija, kao i senzorni problemi poput gubitka kontrole oka i gluvoće, i neuromišićnih problema kao što su nedostatak refleksa, mišićna atrofija i trzaji, i epilepsija.[1]
Kod sindroma iscrpljivanja mitohondrijske DNK povezanih sa mutacijama u genima povezanim sa mutacijama u ECGF1/TIMP-u koje prvenstveno utiču na mozak i gastrointestinalni trakt, simptomi se mogu pojaviti bilo kada u prvih pedeset godina života; najčešće se javljaju pre nego što osoba napuni 20 godina. Gubitak težine je uobičajen kao i nedostatak sposobnosti želuca i creva da se automatski šire i skupljaju i na taj način se kreću kroz njih ( gastrointestinalni motilitet) – to dovodi do osećaja sitosti samo nakon jela. male količine hrane, mučnina, refluks kiseline. Sve pogođene osobe razvijaju gubitak težine i progresivnu gastrointestinalnu dismotilitet koja se manifestuje kao rana sitost, mučnina, dijareja, povraćanje, bol i otok u stomaku. Ljudi takođe razvijaju neuropatiju, sa slabošću i peckanjem. Često postoje problemi sa očima i intelektualni invaliditet.[1]
Dijagnoza[uredi | uredi izvor]
Sindroma iscrpljivanja mitohondrijske DNK se dijagnostikuje na osnovu sistemskih simptoma koji se javljaju kod novorođenčadi, nakon čega sledi klinički pregled i laboratorijski testovi (na primer, visoki nivoi laktata su uobičajeni) medicinski imidžing, i obično se konačno potvrđuje i formalno identifikuje genetskim testiranjem.[1]
Klasifikacija[uredi | uredi izvor]
Sindrom iscrpljivanja mitohondrijske DNK je grupa genetskih poremećaja koji dele zajedničku patologiju — nedostatak funkcionalne DNK u mitohondrijama.[1] Generalno postoje četiri oblika sindroma iscrpljivanja mitohondrijske DNK:[1]
- oblik koji prvenstveno utiče na mišiće povezane sa mutacijama u TK2 genu,
- oblik koji prvenstveno utiče na mozak i mišiće povezane sa mutacijama u genima SUCLA2, SUCLG1 ili RRM2B,
- oblik koji prvenstveno utiče na mozak i jetru povezan sa mutacijama u DGUOK, MPV17,[7] POLG ili TVNK proteinu (koji se takođe naziva PEO1),
- oblik koji prvenstveno utiče na mozak i gastrointestinalni trakt povezan sa mutacijama u ECGF1 (koji se takođe naziva TIMP).
Terapija[uredi | uredi izvor]
Ne postoji odgovarajuća terapija za sindroma iscrpljivanja mitohondrijske DNK, ali se nekim simptomima može upravljati.
Za preživele koji žive sa sindroma iscrpljivanja mitohondrijske DNK, postoje lekovi za kontrolu epilepsije, a fizikalna terapija može pomoći u kontroli mišića.
Transplantacija jetre može koristiti ljudima sa zahvaćenom jetrom.[1]
Prognoza[uredi | uredi izvor]
Miopatski oblik[uredi | uredi izvor]
Miopatski oblik povezan sa TK2 dovodi do slabosti mišića, brzo napreduje, što dovodi do respiratorne insuficijencije i smrti u roku od nekoliko godina od početka. Najčešći uzrok smrti je plućna infekcija. Samo nekoliko ljudi je preživelo kasno detinjstvo i adolescenciju.[1]
Encefalomiopatski oblik[uredi | uredi izvor]
Oblici povezani sa SUCLA2 i RRM2B dovode do deformiteta mozga.[8] Studija iz 2007. zasnovana na 12 slučajeva sa Farskih ostrva (gde postoji relativno visoka incidencija zbog efekta osnivača) sugeriše da je ishod često loš sa ranom smrtnošću.[5] Novije studije (2015) sa 50 ljudi sa SUCLA2 mutacijama, sa rasponom od 16 različitih mutacija, pokazuju veliku varijabilnost u ishodima sa određenim brojem ljudi koji su preživeli u odraslom dobu (srednja vrednost preživljavanja bila je 20 godina. Postoje značajni dokazi (p = 0,020) da ljudi sa missen mutacijama imaju duže stope preživljavanja, što bi moglo značiti da neki od dobijenih proteina imaju neku rezidualnu aktivnost enzima.[8]
RRM2B mutacije su prijavljene kod 16 novorođenčadi sa teškim encefalomiopatskim MDS-om koji je povezan sa ranim početkom (neonatalnom ili infantilnom), multiorganskom prezentacijom i mortalitetom tokom detinjstva. [1]
Hepatopatski oblik[uredi | uredi izvor]
Oblici povezani sa DGUOK, POLG i MPV17 dovode do oštećenja jetre.[1] Disfunkcija jetre je progresivna kod većine osoba sa oba oblika MDS-a povezanog sa DGUOK-om i najčešći je uzrok smrti. Za decu sa multiorganskim oblikom, transplantacija jetre ne pruža nikakvu korist za preživljavanje.[9]
Bolest jetre obično napreduje do otkazivanja jetre kod pogođene dece sa MDS-om povezanim sa MPV17, a transplantacija jetre ostaje jedina opcija lečenja za otkazivanje jetre. Približno polovina obolele dece koja je prijavljena nije bila podvrgnuta transplantaciji jetre i umrla je zbog progresivne insuficijencije jetre – većina tokom detinjstva ili ranog detinjstva. Samo je je nekoliko dece preživelo bez transplantacije jetre.[10]
Izvori[uredi | uredi izvor]
- ^ a b v g d đ e ž z i j k l lj m El-Hattab AW, Scaglia F (April 2013). "Mitochondrial DNA depletion syndromes: review and updates of genetic basis, manifestations, and therapeutic options". Neurotherapeutics. 10 (2): 186–98. El-Hattab, Ayman W.; Scaglia, Fernando (2013). „Mitochondrial DNA Depletion Syndromes: Review and Updates of Genetic Basis, Manifestations, and Therapeutic Options”. Neurotherapeutics. 10 (2): 186—198. PMC 3625391
 . PMID 23385875. doi:10.1007/s13311-013-0177-6..
. PMID 23385875. doi:10.1007/s13311-013-0177-6..
- ^ Adam, M. P.; Mirzaa, G. M.; Pagon, R. A.; Wallace, S. E.; Bean LJH; Gripp, K. W.; Amemiya, A.; Lim, A. Z.; McFarland, R.; Taylor, R. W.; Gorman, G. S. (1993). „RRM2B Mitochondrial DNA Maintenance Defects”. PMID 24741716.
- ^ Wheaton, Oliver (2017-07-25). „What is Charlie Gard's condition mitochondrial DNA depletion syndrome (or MDDS)?”. Metro (na jeziku: engleski). Pristupljeno 2022-03-09.
- ^ This form of MDDS is also called "Alpers' disease", also called "Alpers' syndrome", "Alpers-Huttenlocher syndrome", "progressive sclerosing poliodystrophy", and "progressive infantile poliodystrophy". It is named after Bernard Jacob Alpers (Alpers' disease at Who Named It?) and Peter Huttenlocher (see
- ^ a b „Alpers' Disease Information Page | National Institute of Neurological Disorders and Stroke”. www.ninds.nih.gov. Pristupljeno 2022-03-09.
- ^ Adam, M. P.; Mirzaa, G. M.; Pagon, R. A.; Wallace, S. E.; Bean LJH; Gripp, K. W.; Amemiya, A.; Cohen, B. H.; Chinnery, P. F.; Copeland, W. C. (1993). „POLG-Related Disorders”. GeneReviews. PMID 20301791.
- ^ Karasawa, M.; Zwacka, R. M.; Reuter, A.; Fink, T.; Hsieh, C. L.; Lichter, P.; Francke, U.; Welher, H. (1993). „The human homolog of the glomerulosclerosis gene Mpv17: Structure and genomic organization”. Human Molecular Genetics. 2 (11): 1829—1834. PMID 8281143. doi:10.1093/hmg/2.11.1829..
- ^ a b Carrozzo R, Verrigni D, Rasmussen M, de Coo R, Amartino H, Bianchi M, et al. (March 2016). "Succinate-CoA ligase deficiency due to mutations in SUCLA2 and SUCLG1: phenotype and genotype correlations in 71 patients". Journal of Inherited Metabolic Disease. 39 (2): 243–52. Carrozzo, Rosalba; et al. (2016). „Succinate‐CoA ligase deficiency due to mutations in SUCLA2 and SUCLG1: Phenotype and genotype correlations in 71 patients”. Journal of Inherited Metabolic Disease. 39 (2): 243—252. PMID 26475597. S2CID 7881205. doi:10.1007/s10545-015-9894-9.
- ^ Dimmock, David P.; Dunn, J. Kay; Feigenbaum, Annette; Rupar, Anthony; Horvath, Rita; Freisinger, Peter; Mousson De Camaret, Bénédicte; Wong, Lee-Jun; Scaglia, Fernando (2008). „Abnormal neurological features predict poor survival and should preclude liver transplantation in patients with deoxyguanosine kinase deficiency”. Liver Transplantation. 14 (10): 1480—1485. PMID 18825706. S2CID 28819842. doi:10.1002/lt.21556.
- ^ El-Hattab AW, Li FY, Schmitt E, Zhang S, Craigen WJ, Wong LJ (March 2010). "MPV17-associated hepatocerebral mitochondrial DNA depletion syndrome: new patients and novel mutations". Molecular Genetics and Metabolism. 99 (3): 300–8.
Spoljašnje veze[uredi | uredi izvor]
| Klasifikacija | |
|---|---|
| Spoljašnji resursi |
 | Molimo Vas, obratite pažnju na važno upozorenje u vezi sa temama iz oblasti medicine (zdravlja). |
