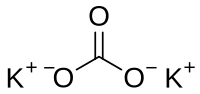
Калијум карбонат
Изглед
| |
| |

| |
| Називи | |
|---|---|
| IUPAC назив
Калијум карбонат
| |
| Други називи
Поташа
| |
| Идентификација | |
| ECHA InfoCard | 100.008.665 |
| Е-бројеви | E501(i) (регулатор киселости, ...) |
| MeSH | Potassium+carbonate |
| RTECS | TS7750000 |
| Својства | |
| K2CO3 | |
| Моларна маса | 138,2055 g/mol |
| Агрегатно стање | Чврста бела хигроскопна супстанца |
| Густина | 2,29 g/cm³, основно |
| Тачка топљења | 891 °C |
| Тачка кључања | разграђује се |
| 112 g/100 mL (20 °C) | |
| Опасности | |
| NFPA 704 | |
| Тачка паљења | није запаљив |
| Сродна једињења | |
Други катјони
|
литијум-карбонат, натријум-карбонат, цезијум-карбонат |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |
Калијум карбонат (молекулска формула K2CO3) је хемијско једињење, калијумова со угљене киселине.[1][2] Калијум карбонат је безбојна кристална супстанција веома добро растворљива у води; 93.7 g у 100 g воде. Температура топљења калијум карбоната износи 891°C. Он гради хидрате, у воденим растворима се хидролизује. Под утицајем киселина подлеже распаду на угљен-диоксид и калијум оксид.
Калијум карбонат се добија увођењем угљен-диоксида у водени раствор калијум хидроксида. Користи се у индустрији стакла, керамике, за продукцију средстава за прање, у фотографији и за добијање других једињења калијума.
Молекулска маса калијум карбоната је 138.2 у.
Види још
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Holleman A. F.; Wiberg E. (2001). Inorganic Chemistry (1st изд.). San Diego: Academic Press. ISBN 0-12-352651-5.

