Kalijum sulfid
| |
| Nazivi | |
|---|---|
| IUPAC naziv
Kalijum sulfid
| |
| Drugi nazivi
Dikalijum monosulfid,
Dikalijum sulfid, Kalijum monosulfid, Kalijum sulfid | |
| Identifikacija | |
3D model (Jmol)
|
|
| ECHA InfoCard | 100.013.816 |
| RTECS | TT6000000 |
| |
| Svojstva | |
| K2S | |
| Molarna masa | 110,262 g/mol |
| Agregatno stanje | čist: bezbojan sa nečistoćama: žuto-braon |
| Miris | HS |
| Gustina | 1,74 g/cm3 |
| Tačka topljenja | 840 °C |
| Tačka ključanja | 912 °C (razlaže se) |
| kovertuje se u KSH, KOH | |
| Rastvorljivost u drugi rastvarači | rastvoran u etanolu, glicerolu nerastvoran u etru |
| Struktura | |
| Kristalna rešetka/struktura | antiFluorit |
| Opasnosti | |
| Opasnost u toku rada | Opasan za sredinu (N) |
| R-oznake | R17, R23, R25, R31, R34, R50 |
| S-oznake | S24, S26 |
| Srodna jedinjenja | |
Drugi katjoni
|
Natrijum sulfid, Gvožđe (II) sulfid |
Srodna jedinjenja
|
Kalijum hidrosulfid, Kalijum sulfit, Kalijum sulfat |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Kalijum sulfid je neorgansko jedinjenje sa formulom K2S.[3][4] Ova bezbojna čvrsta materija se retko sreće, jer brzo reaguje sa vodom, pri čemu se formiraju kalijum hidrosulfid (KSH) i kalijum hidroksid (KOH). Najčešće se termin kalijum sulfid koristi u širem smislu za ovu mešavinu, a ne za anhiratni prah.
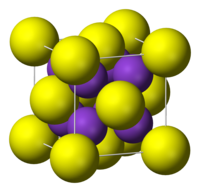
Struktura[уреди | уреди извор]
On poprima "antifluoritnu strukturu", što znači da mali K+ joni zauzimaju tetraedralna (F−) mesta u fluoritu, i veliki S2− centri imaju osam koordinatnih mesta. Li2S, Na2S, i Rb2S imaju sličnu kristalnu strukturu.[5]
Reference[уреди | уреди извор]
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Holleman A. F.; Wiberg E. (2001). Inorganic Chemistry (1st изд.). San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
