Растварање — разлика између измена
| Ред 1: | Ред 1: | ||
[[Датотека:SaltInWaterSolutionLiquid.jpg|мини|десно|200п|Раствор кухињске соли у води]] |
[[Датотека:SaltInWaterSolutionLiquid.jpg|мини|десно|200п|Раствор кухињске соли у води]] |
||
'''Растварање''' је процес диспереговања (равномерног разређивања, распоређивања) једне [[хемијска супстанца|супстанце]] или више њих у другој. Осим код правих [[смеше|смеша]], увек је праћено разменом енергије са околином.<ref name="Atkins7th">{{Atkins7th}}</ref><ref name="McQuarrie1st">{{McQuarrie1st}}</ref> |
'''Растварање''' је процес диспереговања (равномерног разређивања, распоређивања) једне [[хемијска супстанца|супстанце]] или више њих у другој. Осим код правих [[смеше|смеша]], увек је праћено разменом енергије са околином.<ref name="Atkins7th">{{Atkins7th}}</ref><ref name="McQuarrie1st">{{McQuarrie1st}}</ref> |
||
{{рут}} |
|||
Растварач је супстанца која раствара растворак, чиме се формира [[раствор]]. |
Растварач је супстанца која раствара растворак, чиме се формира [[раствор]]. Растварач је обично течност, али такође може бити и чврста супстанца, гас или [[supercritical fluid|суперкритични флуид]]. Количина растворка који се може растворити у одређеној запремини растварача варира у зависности од [[temperature|температуре]]. Уобичајена употреба [[Organic compound|органских]] растварача је у [[dry cleaning|хемијском чишћењу]] (нпр. [[тетрахлороетилен]]), као средство за [[paint thinner|разређивање]] боје (нпр. [[толуен]], [[turpentine|терпентин]]), као средство за уклањање лака за нокте и растварач за лепљење ([[ацетон]], [[метил ацетат]], [[етил ацетат]]), у уклањању мрља (нпр. [[хексан]], бензин етар), у детерџентима ([[Limonen|цитрусни терпени]]) и у [[парфем]]има ([[етанол]]). Вода је растварач за [[Chemical polarity#Polarity of molecules|поларне молекуле]] и најчешћи растварач који користе жива бића; сви јони и протеини у ћелији растворени су у води унутар ћелије. Растварачи налазе разне примене у хемијској, [[Лек|фармацеутској]], нафтној и гасној индустрији, укључујући употребе у [[Hemijska sinteza|хемијским синтезама]] и процесима пречишћавања. |
||
== Растварач == |
== Растварач == |
||
Верзија на датум 28. фебруар 2020. у 18:46

Растварање је процес диспереговања (равномерног разређивања, распоређивања) једне супстанце или више њих у другој. Осим код правих смеша, увек је праћено разменом енергије са околином.[1][2]
Растварач је супстанца која раствара растворак, чиме се формира раствор. Растварач је обично течност, али такође може бити и чврста супстанца, гас или суперкритични флуид. Количина растворка који се може растворити у одређеној запремини растварача варира у зависности од температуре. Уобичајена употреба органских растварача је у хемијском чишћењу (нпр. тетрахлороетилен), као средство за разређивање боје (нпр. толуен, терпентин), као средство за уклањање лака за нокте и растварач за лепљење (ацетон, метил ацетат, етил ацетат), у уклањању мрља (нпр. хексан, бензин етар), у детерџентима (цитрусни терпени) и у парфемима (етанол). Вода је растварач за поларне молекуле и најчешћи растварач који користе жива бића; сви јони и протеини у ћелији растворени су у води унутар ћелије. Растварачи налазе разне примене у хемијској, фармацеутској, нафтној и гасној индустрији, укључујући употребе у хемијским синтезама и процесима пречишћавања.
Растварач
Растварач, релативан и конвенционални појам, назив за средину у којој је нека супстанца дисперегована. Идеалан раствор, смеша, без хемијског међудејства средине и растворене супстанце или са међудејством. Може бити чврст, течан или гасовит. Вода је универзалан растварач. Растварачи као вода веома су значајни за живот, такође и у индустрији, а нарочито важну улогу имају селективни растварачи.
Растварачи у дегазацији
Растварачи у дегазацији су органска једињења с двојаком наменом - за растварање дегазитора у току њихове припреме за употребу и за растварање самих бојних отрова, односно за дагазацију физичким путем. Као растварачи дегазатора најчешће се употребљавају дихлоретан, тетрахлоругљеник и титрохлоретилен, а као растварачи бојних отрова бензин и петролеум.
Раствор
Раствор (чврст, течан или гасовит) настаје мешањем двеју или више супстанци. Засићен раствор за дату температуру има максималну концетрацију растворене супстанце. Незасићен раствор је раствор у коме се може растворити још извесна количина већ растворене супстанце све док се не добије засићен простор. Презасићен простор је раствор у коме је растворено више супстанци него што одговара засићеном раствору. Нестабилан је и из њега се лако издваја, у облику талога, вишак растворене супстанце.
Растворљивост
Растворљивост неке супстанце представља број грама супстанције који се раствара у 100г растварача на одређеној темпаратури.
Вишекомпонентни
Растварачи
| Име | Композиција |
|---|---|
| Растварач 645 | толуен 50%, бутил ацетат 18%, етил ацетат 12%, бутанол 10%, етанол 10%. |
| Растварач 646 | толуен 50%, етанол 15%, бутанол 10%, бутил- или амил ацетат 10%, етил целосолв 8%, ацетон 7%[3] |
| Растварач 647 | бутил- или амил ацетат 29,8%, етил ацетат 21,2%, бутанол 7,7%, толуен или пиробензен 41,3%[4] |
| Растварач 648 | бутил ацетат 50%, етанол 10%, бутанол 20%, толуен 20%[5] |
| Растварач 649 | етил целосолв 30%, бутанол 20%, ксилен 50% |
| Растварач 650 | етил целосолв 20%, бутанол 30%, ксилен 50%[6] |
| Растварач 651 | вајт спирит 90%, бутанол 10% |
| Растварач KR-36 | бутил ацетат 20%, бутанол 80% |
| Растварач P-4 | толуен 62%, ацетон 26%, бутил ацетат 12%. |
| Растварач P-10 | ксилен 85%, ацетон 15%. |
| Растварач P-12 | толуен 60%, бутил ацетат 30%, ксилен 10%. |
| Растварач P-14 | циклохексанон 50%, толуен 50%. |
| Растварач P-24 | растварач 50%, ксилен 35%, ацетон 15%. |
| Растварач P-40 | толуен 50%, етил целосолв 30%, ацетон 20%. |
| Растварач P-219 | толуен 34%, циклохексанон 33%, ацетон 33%. |
| Растварач P-3160 | бутанол 60%, етанол 40%. |
| Растварач RCC | ксилен 90%, бутил ацетат 10%. |
| Растварач RML | етанол 64%, етилцелосолв 16%, толуен 10%, бутанол 10%. |
| Растварач PML-315 | толуен 25%, ксилен 25%, бутил ацетат 18%, етил целосолф 17%, бутанол 15%. |
| Растварач PC-1 | толуен 60%, бутил ацетат 30%, ксилен 10%. |
| Растварач PC-2 | вајт спирит 70%, ксилен 30%. |
| Растварач RFG | етанол 75%, бутанол 25%. |
| Растварач RE-1 | ксилен 50%, ацетон 20%, бутанол 15%, етанол 15%. |
| Растварач RE-2 | растварач 70%, етанол 20%, ацетон 10%. |
| Растварач RE-3 | растварач 50%, етанол 20%, ацетон 20%, етил целосолв 10%. |
| Растварач RE-4 | растварач 50%, ацетон 30%, етанол 20%. |
| Растварач FK-1 (?) | апсолутни алкохол (99,8%) 95%, етил ацетат 5% |
Разређивачи
| Име | Композиција |
|---|---|
| Разређивач RKB-1 | бутанол 50%, ксилен 50% |
| Разређивач RKB-2 | бутанол 95%, ксилен 5% |
| Разређивач RKB-3 | ксилен 90%, бутанол 10% |
| Разређивач M | етанол 65%, бутил ацетат 30%, етил ацетат 5%. |
| Разређивач P-7 | циклохексанон 50%, етанол 50%. |
| Разређивач R-197 | ксилен 60%, бутил ацетат 20%, етил целосолв 20%. |
| Разређивач WFD | толуен 50%, бутил ацетат (или амил ацетат) 18%, бутанол 10%, етанол 10%, етил ацетат 9%, ацетон 3%. |
Физичка својства
Табела својстава уобичајених растварача
Растварачи се групишу у неполарне, поларне апртичне, и поларне протичне раствараче, при чему свака група има већу поларност. Својства растварача која надмашују својства воде су приказана задебљаним фонтом.
| Растварач | Хемијска формула | Тачка кључања[7] (°C) |
Диелектрична константа[8] | Густина (g/mL) |
Диполни моменат (D) |
|---|---|---|---|---|---|
Неполарни растварачи | |||||
| Пентан | CH3CH2CH2CH2CH3 | 36 | 1,84 | 0,626 | 0,00 |
| Циклопентан | 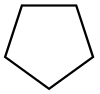 C5H10 |
40 | 1,97 | 0,751 | 0,00 |
| Хексан | CH3CH2CH2CH2CH2CH3 | 69 | 1,88 | 0,655 | 0,00 |
| Циклохексан |  C6H12 |
81 | 2,02 | 0,779 | 0,00 |
| Бензен | 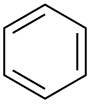 C6H6 |
80 | 2,3 | 0,879 | 0,00 |
| Толуен | C6H5-CH3 | 111 | 2,38 | 0,867 | 0,36 |
| 1,4-Диоксан |  C4H8O2 |
101 | 2,3 | 1,033 | 0,45 |
| Хлороформ | CHCl3 | 61 | 4,81 | 1,498 | 1,04 |
| Диетил етар | CH3CH2-O-CH2CH3 | 35 | 4,3 | 0,713 | 1,15 |
| Дихлорометан (DCM) | CH2Cl2 | 40 | 9,1 | 1,3266 | 1,60 |
Поларни апротични растварачи | |||||
| Тетрахидрофуран (THF) | 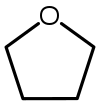 C4H8O |
66 | 7,5 | 0,886 | 1,75 |
| Етил ацетат |  CH3-C(=O)-O-CH2-CH3 |
77 | 6,02 | 0,894 | 1,78 |
| Ацетон |  CH3-C(=O)-CH3 |
56 | 21 | 0,786 | 2,88 |
| Диметилформамид (DMF) | 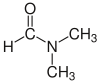 H-C(=O)N(CH3)2 |
153 | 38 | 0,944 | 3,82 |
| Ацетонитрил (MeCN) | CH3-C≡N | 82 | 37,5 | 0,786 | 3,92 |
| Диметил сулфоксид (DMSO) |  CH3-S(=O)-CH3 |
189 | 46,7 | 1,092 | 3,96 |
| Нитрометан | CH3-NO2 | 100–103 | 35,87 | 1,1371 | 3,56 |
| Пропилен карбонат | C4H6O3 | 240 | 64,0 | 1,205 | 4,9 |
Поларни протични растварачи | |||||
| Мравља киселина |  H-C(=O)OH |
101 | 58 | 1,21 | 1,41 |
| n-Бутанол | CH3CH2CH2CH2OH | 118 | 18 | 0,810 | 1,63 |
| Изопропил алкохол (IPA) | 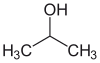 CH3-CH(-OH)-CH3 |
82 | 18 | 0,785 | 1,66 |
| n-Пропанол | CH3CH2CH2OH | 97 | 20 | 0,803 | 1,68 |
| Етанол | CH3CH2OH | 79 | 24,55 | 0,789 | 1,69 |
| Метанол | CH3OH | 65 | 33 | 0,791 | 1,70 |
| Сирћетна киселина |  CH3-C(=O)OH |
118 | 6,2 | 1,049 | 1,74 |
| Вода | H-O-H |
100 | 80 | 1,000 | 1,85 |
Вредности параметра Хансенове растворљивости
Вредности Хансеновог параметра растворљивости[9][10] заснивају се на дисперзионим везама (δD), поларним везама (δP) и водоничним везама (δH). Оне садрже информације о међумолекуларним интеракцијама са другим растварачима, као и са полимерима, пигментима, наночестицама, итд. То омогућава рационалне формулације знајући, на пример, да постоји добро подударање између растварача и полимера. Рационалне супституције могу се правити тако да се користе „добри” раствараче (ефикасни у растварању растворка) уместо „лоших” (скупих или опасних по здравље или животну средину). Следећа табела показује да је интуитивно поимање „неполарног”, „поларног апротичног” и „поларног протичног” изражено нумерички - „поларни” молекули имају виши ниво δP, а протични растварачи имају виши ниво δH. Пошто се користе нумеричке вредности, поређење се може рационално вршити упоређивањем бројевима. На пример, ацетонитрил је много поларнији од ацетона, али показује нешто слабије водонично везивање.
| Растварач | Хемијска формула | δD дисперција | δP поларност | δH водонично везивање |
|---|---|---|---|---|
Неполарни растварачи | ||||
| n-Хексан | CH3CH2CH2CH2CH2CH3 | 14,9 | 0,0 | 0,0 |
| Бензен | C6H6 | 18,4 | 0,0 | 2,0 |
| Толуен | C6H5-CH3 | 18,0 | 1,4 | 2,0 |
| Диетил етар | CH3CH2-O-CH2CH3 | 14,5 | 2,9 | 4,6 |
| Хлороформ | CHCl3 | 17,8 | 3,1 | 5,7 |
| 1,4-Диоксан | /-CH2-CH2-O-CH2-CH2-O-\ | 17,5 | 1,8 | 9,0 |
Поларни апротични растварачи | ||||
| Етил ацетат | CH3-C(=O)-O-CH2-CH3 | 15,8 | 5,3 | 7,2 |
| Тетрахидрофуран (THF) | /-CH2-CH2-O-CH2-CH2-\ | 16,8 | 5,7 | 8,0 |
| Дихлорометан | CH2Cl2 | 17,0 | 7,3 | 7,1 |
| Ацетон | CH3-C(=O)-CH3 | 15,5 | 10,4 | 7,0 |
| Ацетонитрил (MeCN) | CH3-C≡N | 15,3 | 18,0 | 6,1 |
| Диметилформамид (DMF) | H-C(=O)N(CH3)2 | 17,4 | 13,7 | 11,3 |
| Диметил сулфоксид (DMSO) | CH3-S(=O)-CH3 | 18,4 | 16,4 | 10,2 |
Поларни протични растварачи | ||||
| Сирћетна киселина | CH3-C(=O)OH | 14,5 | 8,0 | 13,5 |
| n-Бутанол | CH3CH2CH2CH2OH | 16,0 | 5,7 | 15,8 |
| Изопропанол | CH3-CH(-OH)-CH3 | 15,8 | 6,1 | 16,4 |
| n-Пропанол | CH3CH2CH2OH | 16,0 | 6,8 | 17,4 |
| Етанол | CH3CH2OH | 15,8 | 8,8 | 19,4 |
| Метанол | CH3OH | 14,7 | 12,3 | 22,3 |
| Мравља киселина | H-C(=O)OH | 14,6 | 10,0 | 14,0 |
| Вода | H-O-H | 15,5 | 16,0 | 42,3 |
Ако је ради заштите животне средине или неког другог разлога неопходно да се растварач или мешавина растварача замени другим еквивалентним растварачем, замена се може извршити на основу њихових Хансенових параметара растворљивости. Вредности за смеше се узимају као пондерисани просеци вредности чистих растварача. То се може израчунати приступом пробе и грешке, помоћу табеле вредности или HSP софтвера.[9][10] Мешавина 1:1 толуена и 1,4 диоксана има вредности δD, δP и δH од 17,8, 1,6 и 5,5, које су упоредиве са вредностима хлороформа од 17,8, 3,1 и 5,7 респективно. Због опасности по здравље повезане са употребом толуена, друге смеше растварача се могу наћи помоћу пуног HSP сета података.
Види још
Референце
- ^ Peter Atkins; Julio de Paula (2001). Physical Chemistry (7th изд.). W. H. Freeman. ISBN 0716735393.
- ^ Donald A. McQuarrie; John D. Simon (1997). Physical Chemistry: A Molecular Approach (1st изд.). University Science Books. ISBN 0935702997.
- ^ dcpt.ru Solvent 646 Characteristics (ru)
- ^ dcpt.ru Solvent 647 Characteristics (ru)
- ^ dcpt.ru Solvent 648 Characteristics (ru)
- ^ dcpt.ru Solvent 650 Characteristics (ru)
- ^ Solvent Properties – Boiling Point Архивирано 14 јун 2011 на сајту Wayback Machine. Xydatasource.com. Retrieved on 26 January 2013.
- ^ Dielectric Constant Архивирано 4 јул 2010 на сајту Wayback Machine. Macro.lsu.edu. Retrieved on 26 January 2013.
- ^ а б Abbott S, Hansen CM (2008). Hansen solubility parameters in practice. Hansen-Solubility. ISBN 978-0-9551220-2-6.
- ^ а б Hansen CM (јануар 2002). Hansen solubility parameters: a user's handbook. CRC press. ISBN 978-0-8493-7248-3.
Литература
- Lowery TH, Richardson KS (1987). Mechanism and Theory in Organic Chemistry (3rd изд.). Harper Collins Publishers. ISBN 978-0-06-364044-3.
Спољашње везе
- "European Solvents Industry Group - ESIG - ESIG European Solvents Industry Group" Solvents in Europe.
- Table and text O-Chem Lecture
- Tables Properties and toxicities of organic solvents
- CDC – Organic Solvents – NIOSH Workplace Safety and Health Topic
- EPA – Solvent Contaminated Wipes
