Benzojeva kiselina
| |||
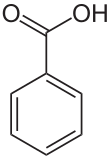
 Kristali benzojeve kiseline
| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
Benzoic acid
| |||
| Drugi nazivi | |||
| Identifikacija | |||
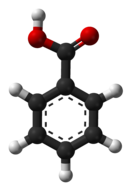
3D model (Jmol)
|
|||
| 3DMet | B00053 | ||
| Bajlštajn | 636131 | ||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.562 | ||
| EC broj | 200-618-2 | ||
| E-brojevi | E210 (konzervansi) | ||
| Gmelin Referenca | 2946 | ||
| KEGG[1] | |||
| MeSH | benzoic+acid | ||
| RTECS | DG0875000 | ||
| UNII | |||
| |||
| Svojstva | |||
| C7H6O2 | |||
| Molarna masa | 122,12 g·mol−1 | ||
| Agregatno stanje | bezbojna kristalna materija | ||
| Gustina | 1,27 g/cm3[4] | ||
| Tačka topljenja | 12.238 °C (22.060 °F; 12.511 K) | ||
| Tačka ključanja | 250 °C (482 °F; 523 K) | ||
| 2.9 g/L[4] | |||
| Kiselost (pKa) | 4.21 | ||
| Indeks refrakcije (nD) | 1.5397 | ||
| Struktura | |||
| Kristalna rešetka/struktura | Monoklinična | ||
| Oblik molekula (orbitale i hibridizacija) | planaran | ||
| Dipolni moment | 1.72 D u dioksanu | ||
| Opasnosti | |||
| Opasnost u toku rada | Iritacija | ||
| Bezbednost prilikom rukovanja | JT Baker | ||
| NFPA 704 | |||
| Tačka paljenja | 121 °C (250 °F)[4] | ||
| 570 °C (1.058 °F; 843 K) | |||
| Srodna jedinjenja | |||
Srodne karboksilna kiselina
|
Fenolne kiseline Aminobenzojeve kiseline, Nitrobenzojeve kiseline | ||
Srodna jedinjenja
|
Benzaldehid, Benzil alkohol, Benzoil hlorid, Benzilamin, Benzamid | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
Benzojeva kiselina,[6][7] C7H6O2 (ili C6H5COOH), je bezbojna kristalna materija. Ona je najjednostavnija aromatična karboksilna kiselina. Ime je izvedeno od benzoinske smole, koja je dugo vremena bila jedini izvor benzojeve kiseline. Njene soli se koriste kao prehrambeni prezervativi. Benzojeva kiselina je važan prekurzor za sintezu mnogih drugih organskih supstanci. Soli i estri benzojeve kiseline su poznati kao benzoati.
Istorija
[уреди | уреди извор]Benzojeva kiselina je otkrivena u šesnaestom veku. Suva destilacija benzoinske smole je prvo opisana od strane Nostradamusa (1556), i naknadno u radovima Aleksius Pedemontanusa (1560) i Blaiz de Vigenera (1596).[8]
Proizvodnja
[уреди | уреди извор]Industrijska priprema
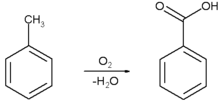
[уреди | уреди извор]Benzojeva kiselina se komercijalno proizvodi parcijalnom oksidacijom toluena kiseonikom. Proces se katalizuje kobalt ili mangan naftenatima. Proces koristi jeftine sirovine i proizvodi visok prinos.
Laboratorijska sinteza
[уреди | уреди извор]Benzojeva kiselina je jeftina i široko dostupna, tako da laboratorijska sinteza benzojeve kiseline prvenstveno ima pedagošku vrednost.
U svim sintezama, benzojeva kiselina se može prečistiti rekristalizacijom iz vode usled njene visoke rastvorljivosti u toploj i male rastvorljivosti u hladnoj vodi. Odsustvo organskih rastvarača u rekristalizaciji čini ovaj eksperiment posebno bezbednim. Drugi mogući rekristalizacioni rastvarači su sirćetna kiselina, benzen, aceton, petroleum etar, i mešavina etanola i vode.[9]
Putem hidrolize
[уреди | уреди извор]Kao i svaki drugi nitril ili amid, benzonitril i benzamid se mogu hidrolizovati do benzojeve kiseline ili njenih konjugovanih baza u kiselim ili baznim uslovima.
Iz benzaldehida
[уреди | уреди извор]Bazom indukovana disproportionacija benzaldehida, Kanizarova reakcija, proizvodi jednake količine benzoata i benzil alkohola. Alkohol može biti odstranjen destilacijom.
Farmakokinetika
[уреди | уреди извор]Metabolički putevi metamfetamina
|
Reference
[уреди | уреди извор]- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б в г Record in the GESTIS Substance Database from the IFA
- ^ „Melting point of benzoic acid”. Архивирано из оригинала 26. 10. 2011. г. Приступљено 18. 07. 2011.
- ^ Шурањи, Терезија; Цанић, Велимир (1977). „Испитивање пропионатних, фталатних и бензоатних комплекса церијума (III)”. Гласник Хемијског друштва Београд. 42: 538.
- ^ Гласник Српске академије наука. Београд. 1953. стр. 261.
- ^ Neumüller O-A (1988). Römpps Chemie-Lexikon (6 изд.). Stuttgart: Frankh'sche Verlagshandlung. ISBN 978-3-440-04516-9. OCLC 50969944.
- ^ D. D. Perrin; W. L. F. Armarego (1988). Purification of Laboratory Chemicals (3rd изд.). Pergamon Press. стр. 94. ISBN 978-0-08-034715-8.
Dodatna literatura
[уреди | уреди извор]- Cosmetic Ingredient Review Expert Panel Bindu Nair (2001). „Final Report on the Safety Assessment of Benzyl Alcohol, Benzoic Acid, and Sodium Benzoate”. Int J Tox. 20 (Suppl. 3): 23—50. PMID 11766131. doi:10.1080/10915810152630729.
- Neumüller O-A (1988). Römpps Chemie-Lexikon (6 изд.). Stuttgart: Frankh'sche Verlagshandlung. ISBN 978-3-440-04516-9. OCLC 50969944.
- D. D. Perrin; W. L. F. Armarego (1988). Purification of Laboratory Chemicals (3rd изд.). Pergamon Press. стр. 94. ISBN 978-0-08-034715-8.