Radikal (hemija) — разлика између измена
Спашавам 1 извора и означавам 0 мртвим. #IABot (v2.0beta15) |
. |
||
| Ред 1: | Ред 1: | ||
{{short description|Atom, molekul ili gvožđe koji ima nespareni valentni elektron; tipično visoko reaktivan}} |
|||
[[File:Hydroxyl radical.png|thumb|[[Hidroksil radikal]], prikazana [[Lewis structure|Luisova struktura]], sadrži jedan nespareni elektron]] |
|||
'''Radikali''' (''slobodni radikali'') su [[atom]]i, [[molekul]]i, ili [[jon]]i sa [[nespareni elektron|nesparenim elektronima]] u spoljašnjoj ljuski.<ref name="Clayden1st">{{Clayden1st}}</ref><ref name="MorrisonBoyd6th">{{MorrisonBoyd6th}}</ref><ref name="March6th">{{March6th}}</ref> Slobodni radikali mogu da budu pozitivni, negativni, ili bez naelektrisanja. Nespareni elektroni daju radikalima [[hemijska reakcija|hemijsku reaktivnost]]. Smatra se da su slobodni radikali u telu jedan od uzroka [[degenerativna bolest|degenerativnih bolesti]], [[starenje|starenja]] i [[Rak (bolest)|kancera]]. |
'''Radikali''' (''slobodni radikali'') su [[atom]]i, [[molekul]]i, ili [[jon]]i sa [[nespareni elektron|nesparenim elektronima]] u spoljašnjoj ljuski.<ref name="Clayden1st">{{Clayden1st}}</ref><ref name="MorrisonBoyd6th">{{MorrisonBoyd6th}}</ref><ref name="March6th">{{March6th}}</ref> Slobodni radikali mogu da budu pozitivni, negativni, ili bez naelektrisanja. Nespareni elektroni daju radikalima [[hemijska reakcija|hemijsku reaktivnost]]. Smatra se da su slobodni radikali u telu jedan od uzroka [[degenerativna bolest|degenerativnih bolesti]], [[starenje|starenja]] i [[Rak (bolest)|kancera]]. |
||
| Ред 19: | Ред 22: | ||
* Reakcije '''propagacije''' su reakcije u kojima se totalni broj slobodnih radikala ne menja. |
* Reakcije '''propagacije''' su reakcije u kojima se totalni broj slobodnih radikala ne menja. |
||
* Reakcije '''terminacije''' dovode do umanjenja broja slobodnih radikala. Tipično dva slobodna radikala formiraju stabilnije vrste, npr.: -{2Cl'''·'''→ Cl<sub>2</sub>}- |
* Reakcije '''terminacije''' dovode do umanjenja broja slobodnih radikala. Tipično dva slobodna radikala formiraju stabilnije vrste, npr.: -{2Cl'''·'''→ Cl<sub>2</sub>}- |
||
== Nastajanje == |
|||
[[Datoteka:Dibenzoylperoxide Reaction V.1.svg|thumb|desno|Termolitičko ili fotolitičko raspadanje benzoilperoksida čime nastaju benzoiloksi radikali, što predstavlja tehnički vrlo važnu reakciju pri proizvodnji raznih polimera.]] |
|||
{{rut}} |
|||
Radikali nastaju delovanjem: |
|||
* visoke temperature ([[termoliza|termolitičko]] raspadanje [[hemijska veza|veza]]) |
|||
* [[Ultraljubičasto zračenje|ultraljubičastog zračenja]], koje djeluje tako što se [[kovalenta veza|kovalentne veze]] [[homoliza|homolitički]] raspadaju ([[fotoliza]]) |
|||
* [[Rendgensko zračenje|rendgenskim]] i drugim [[Ionizirajuće zračenje|ionizirajućim zračenjem]] |
|||
* [[Elektrohemija|elektrohemijski]] putem oksidacije odnosno redukcije |
|||
Za iniciranje reakcije radikalizacije pri hemijskim sintezama često se u reakcionu smjesu dodaje "starter radikala". Pri tome se radi o molekuli koja se naročito lahko cijepa na radikale, naprimjer kada se osvijetli ultraljubičastim svjetlom. Primjeri takvih spojeva su: [[Azobisisobutyronitril|azobis''izo''butironitril]], [[dibenzoilperoksid]], [[dilauroilperoksid]], [[di-tert-butilperoksid|di-''tert''-butilperoksid]], diizopropilperoksidikarbonat i [[kalij-peroksodisulfat]].<ref name="Lechner"/> |
|||
Radicals are either (1) formed from spin-paired molecules or (2) from other radicals. Radicals are formed from spin-paired molecules through homolysis of weak bonds or electron transfer, also known as reduction. Radicals are formed from other radicals through substitution, addition, and elimination reactions. |
|||
[[File:Brominehomolysis.png|thumb|300x300px|Homolysis of a bromine molecule producing two bromine radicals]] |
|||
=== Formiranje radikala od spin-uparenih molekula === |
|||
==== Homoliza ==== |
|||
[[File:Homolysis2.png|thumb|Homolysis of dibenzoyl peroxide producing two benzoyloxy radicals|450x450px]] |
|||
[[Homolysis (chemistry)|Homolysis]] makes two new radicals from a spin-paired molecule by breaking a covalent bond, leaving each of the fragments with one of the electrons in the bond.<ref name=":1">{{Cite book|last=Clayden, Jonathan.|url=https://www.worldcat.org/oclc/761379371|title=Organic chemistry|date=2012|publisher=Oxford University Press|others=Greeves, Nick., Warren, Stuart G.|isbn=978-0-19-927029-3|edition=2nd |location=Oxford|oclc=761379371}}</ref> Because breaking a chemical bond requires energy, homolysis occurs under the addition of heat or light. The [[Bond-dissociation energy|bond dissociation energy]] associated with homolysis depends on the stability of a given compound, and some weak bonds are able to homolyze at relatively lower temperatures. |
|||
Some homolysis reactions are particularly important because they serve as an initiator for other radical reactions. One such example is the homolysis of halogens, which occurs under light and serves as the driving force for radical halogenation reactions. |
|||
Another notable reaction is the homolysis of dibenzoyl peroxide, which results in the formation of two benzoyloxy radicals and acts as an initiator for many radical reactions.<ref>{{Cite web|title=Diacyl Peroxides|url=https://polymerdatabase.com/polymer%20chemistry/Diaroyl%20Peroxides.html|access-date=2020-12-08|website=polymerdatabase.com}}</ref> |
|||
[[File:ketonereduction.png|thumb|Reduction of a ketone to form a ketyl radical|250x250px|link=Special:FilePath/Radicalreduction.png]] |
|||
==== Redukcija ==== |
|||
Radicals can also form when a single electron is added to a spin-paired molecule, resulting in an electron transfer.<ref>{{Cite web|date=2015-01-21|title=IV. Nonchain Reactions: Radical Formation by Electron Transfer|url=https://chem.libretexts.org/Bookshelves/Organic_Chemistry/Book%3A_Radical_Reactions_of_Carbohydrates_(Binkley)/II%3A_Radical_Reactions_of_Carbohydrates/18%3A_Compounds_with_Carbon%E2%80%93Carbon_Multiple_Bonds_I%3A_Addition_Reactions/IV._Nonchain_Reactions%3A_Radical_Formation_by_Electron_Transfer|access-date=2020-12-08|website=Chemistry LibreTexts|language=en}}</ref> This reaction, also called reduction, usually takes place with an alkali metal donating an electron to another spin-paired molecule. |
|||
=== Formiranje radikala od drugih radikala === |
|||
==== Apstrajcija ==== |
|||
[[File:Abstraction.png|thumb|Radical abstraction between a benzoyloxy radical and hydrogen bromide|450x450px]] |
|||
[[File:radicaladdition.png|thumb|Radical addition of a bromine radical to a substituted alkene|300x300px]] |
|||
[[Hydrogen atom abstraction|Hydrogen abstraction]] describes when a hydrogen atom is removed from a hydrogen donor molecule (e.g. tin or silicon hydride) with its one electron.<ref>{{Cite web|date=2015-01-11|title=II. Atom Abstraction|url=https://chem.libretexts.org/Bookshelves/Organic_Chemistry/Book%3A_Radical_Reactions_of_Carbohydrates_(Binkley)/I%3A_Structure_and_Reactivity_of_Carbohydrate__Radicals/04%3A_Elementary_Reactions/02._Atom_Abstraction|access-date=2020-12-08|website=Chemistry LibreTexts|language=en}}</ref> Abstraction produces a new radical and a new spin-paired molecule. This is different from homolysis, which results in two radicals from a single spin-paired molecule and doesn’t include a radical as its reactant. Hydrogen abstraction is a fundamental process in radical chemistry because it serves as the final propagation step in many chemical reactions, converting carbon radicals into stable molecules. The figure to the right shows a radical abstraction between a benzoyloxy radical and a hydrogen bromide molecule, resulting in the production of a benzoic acid molecule and a bromine radical. |
|||
==== Adicija ==== |
|||
[[Free-radical addition|Radical addition]] describes when a radical is added to a spin-paired molecule to form a new radical.<ref>{{Cite web|date=2013-10-02|title=Radical Additions: Anti-Markovnikov Product Formation|url=https://chem.libretexts.org/Bookshelves/Organic_Chemistry/Supplemental_Modules_(Organic_Chemistry)/Alkenes/Reactivity_of_Alkenes/Free_Radical_Reactions_of_Alkenes/Radical_Additions%3A_Anti-Markovnikov_Product_Formation|access-date=2020-12-08|website=Chemistry LibreTexts|language=en}}</ref> The figure on the right shows the addition of a bromine radical to an alkene. Radical addition follows the [[Markovnikov's rule|Anti -Markovnikov rule]], where the substituent is added to the less substituted carbon atom. |
|||
==== Eliminacija ==== |
|||
[[File:radicalelimination.png|thumb|A radical elimination reaction of a benzoyloxy radical|center|400x400px]] |
|||
Radical elimination can be viewed as the reverse of radical addition. In radical elimination, an unstable radical compound breaks down into a spin-paired molecule and a new radical compound. Shown below is an example of a radical elimination reaction, where a benzoyloxy radical breaks down into a phenyl radical and a carbon dioxide molecule.<ref>{{Citation|last=Su|first=Wei-Fang|title=Radical Chain Polymerization|date=2013|work=Principles of Polymer Design and Synthesis|pages=137–183|editor-last=Su|editor-first=Wei-Fang|series=Lecture Notes in Chemistry|volume=82|place=Berlin, Heidelberg|publisher=Springer|language=en|doi=10.1007/978-3-642-38730-2_7|isbn=978-3-642-38730-2|doi-access=free}}</ref> |
|||
== Reaktivnost == |
|||
=== Reaktivni radikali === |
|||
Pošto većina radikala reagira egzergono, oni su izrazito reaktivni i kao takvi vrlo kratko "žive" (kraće od jedne sekunde). Neupareni elektroni obično se pri tom nalaze na atomima ugljika, [[dušik]]a, kisika i [[Živa|žive]] ili na halogenim elementima. |
|||
=== Nereaktivni radikali === |
|||
[[Datoteka:Triphenylmethyl Radical V.1.svg|thumb|desno|Demeriziranje trifenilmetil radikala do 3-difenilmetilen-6-trifenilmetil-cikloheksa-1,4-diena.]] |
|||
Poznati su također i radikali koji ne reagiraju odmah pri nastanku te mogu postojati tokom određenog vremenskog perioda pa čak se mogu i izolirati kao zasebne supstance. Jedan od takvih "stabilnih" radikala jeste trifenilmetil radikal. Kao i drugi nereaktivni radikali, i on se sa svojim dimerom u rastvoru nalazi u ravnoteži. Dimer trifenilmetil radikala nije heksafeniletan, kao što je [[Moses Gomberg|Gomberg]] mislio,<ref name="Gomberg"/> već 3-difenilmetilen-6-trifenilmetil-cikloheksa-1,4-dien.<ref name="Hauptmann"/> Faktori koji vode do stabilnih radikala su, prema nekim teorijama rezonantna stabilizacija (mezomerija), a prema drugim "zastoj" u dimerizaciji, naprimjer putem steričnih, sofisticiranih supstituenata. Stabilni radikali pronađeni su i u prirodi. Tako naprimjer enzim [[ribonukleotidreduktaza]] sadrži tirosil radikal čije [[vrijeme poluraspada]] iznosi oko četiri dana. |
|||
=== Ugljenikovi radikali === |
|||
Radikali u čijem središtu se nalazi atom [[ugljik]]a pokazuju povećanje stabilnosti sljedećim redom: ''primarni C atom'' < ''sekundarni'' < ''tercijarni'', što je posljedica [[Induktivni efekat|induktivnog efekta]] i [[Hiperkonjugacija|hiperkonjugacije]]. Osim toga ugljikov radikal sa ''sp³'' [[Hibridizacija orbitala|hibridiziranom orbitalom]] stabilni je od radikalnog centra, u kojem je ugljik iskazuje ''sp²'' ili ''sp'' hibridizaciju. Aril ili alil grupe također stabiliziraju radikale. |
|||
== Primeri == |
|||
* [[Kiseonik|Molekularni kiseonik]] O<sub>2</sub> – ova molekula kisika sadrži dva nesparena elektrona (biradikal <sup>•</sup>O-O<sup>•</sup>; prema Lewisovoj formuli O=O daje situaciju vezivanja koja nije potpuna niti je u potpunosti tačna) a nastaje u magnetnom polju kao paramagnetni triplet. Iako su mogućnosti reagiranja ovog biradikala ograničene, jer po principu održanja spina pri hemijskim reakcijama u većini slučajeva je potrebno da se prethodno pobude do singleta kisika. |
|||
* [[Dušik-monoksid]] <sup>•</sup>NO – radikal poznat kao supstanca za prenos signala u organizmu. Dušik-monoksid je sastavni dio [[Dušikovi oksidi|nitroznih plinova]]. |
|||
* [[Hidroksil-radikal]] <sup>•</sup>OH – jedan od najreaktivnijih i najznačajnijih radikala u [[Zemljina atmosfera|atmosferi]] (važan pri razgradnji supstanci koje zagađuju atmosferu) |
|||
* Radikali [[hlor]]a Cl<sup>•</sup> – nastaju [[Homoliza|homolitičkim]] raspadom veze između dva atoma u molekularnom hloru (Cl<sub>2</sub>) i veoma su reaktivni međuproizvod pri fotohloriranju alkana kao i hloriranju bočnih lanaca aromatskih spojeva sa supstituiranim alkil grupama. Ovi radikali se otpuštaju i djelovanjem svjetlosti na [[hlorofluorougljik]]e i učestvuju u razaranju [[ozon]]skog omotača. |
|||
* Radikali [[brom]]a Br<sup>•</sup> – nastaju [[Homoliza|homolitičkim]] raspadom veza između dva atoma u molekularnom bromu (Br<sub>2</sub>) i veoma su reaktivni međuproizvod pri fotobromiranju alkana kao i bromiranju bočnih lanaca aromatskih spojeva sa supstituiranim alkil grupama |
|||
* [[2,2,6,6-tetrametilpiperidiniloksil|TEMPO]] – stabilni [[Organska hemija|organski]] radikal, koji se između ostalog koristi i kao oksidacijsko sredstvo |
|||
== U biologiji == |
|||
Radikali, tačnije reaktive vrste kisika, igraju važnu ulogu u brojnim biološkim procesima, a neki od njih mogu i izazvati oštećenja ćelija, što između ostalog može dovesti i do razvoja [[Rak (bolest)|kancerogenih oboljenja]]. Oksidativni procesi raznih supstanci u organizmu, koji se odvijaju pod uticajem slobodnih radikala, po mnogim mišljenjima odgovorni su za nastanak [[Ateroskleroza|arteroskleroze]], [[Alzheimerova bolest|Alzheimerove bolesti]], oštećenja jetre izazvane unosom alkohola u organizam kao i [[emfizem]] zbog korištenja [[duhan (proizvod)|duhanskih]] proizvoda. Od unutarćelijskih signalnih puteva, koji se aktiviraju slobodnim radikalima, signalni put [[NF-κB]] je jedan od najznačajnijih. |
|||
Zaštita od djelovanja radikala je od životne važnosti za organizam, pa zbog toga tijelo sadrži vrlo efikasne odbrambene mehanizme i mehanizme koje mu omogućavaju popravku u obliku enzima, hormona i drugih supstanci, koje umanjuju i sprječavaju štetno djelovanje radikala. Među tim odbrambenim mehanizmima su antioksidansi poput [[epigalokatehin galat]]a, [[Superoksid dismutaza|superoksid dismutaze]], [[Vitamin A|vitamina A]], [[Vitamin C|C]] i [[Vitamin E|E]]; [[Koenzim Q10|koenzima Q10]]; flavonoida poput [[taksifolin]]a<ref name="Dihydroquercetin"/> i [[antocijanin]]a. Osim ovih, smatra se da [[bilirubin]] i [[mokraćna kiselina]] također mogu neutralizirati slobodne radikale. Hormon [[melatonin]] važi za supstancu koja "hvata" radikale odgovorne za [[oksidativni stres]]. Jedan od najsnažnijih poznatih antioksidansa, hidridni ion H<sup>−</sup>, igra važnu ulogu u [[Krebsov ciklus|ciklusu limunske kiseline]] kao i u mnogim metaboličkim redoks-reakcijama. |
|||
U okvirima "teorije starenja", [[Teorija slobodnih radikala|slobodni radikali]] igraju ulogu u procesima starenja organizma. Prema toj teoriji,<ref name="aging"/> radikali se proučavaju kao djelujuće supstance protiv oksidativnog stresa "odgovornog" za starenje. Istraživanja su pokazala da su ćelije ptica značajno otpornije na djelovanje slobodnih radikala. Međutim, pošto je proučavan samo uticaj sintetičkih antioksidanata, ne bi se trebalo izvoditi zaključke o mogućim efektima konzumiranja voća i povrća. Godine 2007. uredništvo Žurnala Američkog medicinskog društva (AMA) pozvalo je na daljnja ispitivanja djelovanja radikala kako bi se utvrdili efekti vitamina C i [[selen]]a na starenje.<ref name="gogo"/> Veoma detaljna i nekoliko puta ažurirana analiza britanskog udruženja [[Cochrane]] (2007–2012) mogla bi pružiti konačan dokaz da nema pozitivnih efekata prehrambenih dodataka (suplemenata) koji sadrže [[vitamin C]]; čak suprotno, smrtnost u proučavanoj grupi osoba bila je neznatno veća od smrtnosti kontrolne grupe.<ref name="PMID22419320"/> |
|||
== Reference == |
== Reference == |
||
{{reflist| |
{{reflist||refs= |
||
<ref name="PMID22419320">{{Cite journal|author=G. Bjelakovic |author2= D. Nikolova |author3= L. L. Gluud |author4= R. G. Simonetti |author5= C. Gluud|title=Antioxidant supplements for prevention of mortality in healthy participants and patients with various diseases|journal=Cochrane database of systematic reviews (Online)|volume=3|year=2012|issn=1469-493X|page=CD007176|doi=10.1002/14651858.CD007176.pub2|pmid=22419320}}</ref> |
|||
<ref name="gogo">{{Cite journal|author=Goran Bjelakovic |author2= Dimitrinka Nikolova |author3= Lise Lotte Gluud |author4= Rosa G. Simonetti |author5= Christian Gluud |title=Mortality in Randomized Trials of Antioxidant Supplements for Primary and Secondary Prevention |journal=JAMA: The Journal of the American Medical Association |volume=297 |issue=8 |datum=28. 1. 2007|pages=842–857 |doi=10.1001/jama.297.8.842}}</ref> |
|||
<ref name="aging">{{Cite journal|author=Kenneth B. Beckmann |author2= Bruce N. Ames|journal=Phys. Rev.|datum=1. 4. 1998|doi=10.1152/physrev.1998.78.2.547|title=The Free Radical Theory of Aging Matures|pages=547-581|volume=78|issue=2}}</ref> |
|||
<ref name="Dihydroquercetin">{{Cite journal|author=Yu. A. Vladimirov |author2= E. V. Proskurnina |author3= E. M. Demin |author4= N. S. Matveeva |author5= O. B. Lubitskiy |author6= A. A. Novikov |author7= D. Yu. Izmailov |author8= A. N. Osipov |author9= V. P. Tikhonov |author10= V. E. Kagan |title=Dihydroquercetin (taxifolin) and other flavonoids as inhibitors of free radical formation at key stages of apoptosis |journal=Biochemistry (Moskva) |volume=74 |number=3 |year=2009 |pages=301–307 |doi=10.1134/S0006297909030092 |pmid=19364325}}</ref> |
|||
<ref name="Gomberg">{{Cite journal|author=Gomberg M.|datum=1. 7. 1901|title=On Trivalent Carbon.|journal=Journal of the American Chemical Society|language=en|volume=23|issue=7|pages=496–502|doi=10.1021/ja02033a015}}</ref> |
|||
<ref name="Hauptmann">{{Cite book|author=Siegfried Hauptmann|title=Organische Chemie|edition=2|publisher=VEB Deutscher Verlag für Grundstoffindustrie|location=Leipzig|year=1985|isbn=3-342-00280-8|page=281}}</ref> |
|||
<ref name="Lechner">{{Cite book|author=M. D. Lechner |author2= K. Gehrke |author3= E. H. Nordmeier|title=Makromolekulare Chemie|edition=4|publisher=Birkhäuser Verlag|isbn=978-3-7643-8890-4|page=54|language=de|year=2009}}</ref> |
|||
}} |
|||
== Literatura == |
|||
== Spoljašnje veze == |
== Spoljašnje veze == |
||
{{Commons category-lat|Radical (chemistry)}} |
|||
* [https://web.archive.org/web/20111003225258/http://mark.jelezniak.de/chemical_reactions/ignition_delay_times.htm Upotreba emisije radikala u određivanju vremena kašnjenja paljenja] |
* [https://web.archive.org/web/20111003225258/http://mark.jelezniak.de/chemical_reactions/ignition_delay_times.htm Upotreba emisije radikala u određivanju vremena kašnjenja paljenja] |
||
{{Authority control}} |
|||
{{DEFAULTSORT:Радикал (хемија)}} |
{{DEFAULTSORT:Радикал (хемија)}} |
||
Верзија на датум 15. фебруар 2021. у 21:39

Radikali (slobodni radikali) su atomi, molekuli, ili joni sa nesparenim elektronima u spoljašnjoj ljuski.[1][2][3] Slobodni radikali mogu da budu pozitivni, negativni, ili bez naelektrisanja. Nespareni elektroni daju radikalima hemijsku reaktivnost. Smatra se da su slobodni radikali u telu jedan od uzroka degenerativnih bolesti, starenja i kancera.
Slobodni radikali su značajni za sagorevanje, atmosfersku hemiju, polimerizaciju, hemiju plazme, biohemiju, i mnoge druge hemijske procese. U hemijskoj biologiji, superoksid i azot-monoksid regulišu mnoštvo procesa, kao što je kontrola vaskularnog tona. Radikali mogu da budu i glasnici posredstvom fenomena zvanog redoks signalizacija. Radikal može da bude zarobljen unutar kaveza rastvarača, ili da budu na neki drugi način vezani.
Hemijske reakcije
U hemijskim jednačinama, slobodni radikali se često označavaju tačkom stavljenom neposredno iza simbola atoma:
- Gasoviti hlor se može razložiti ultravioletnom svetlošću čime se formiraju radikali hlora.
Reakcioni mehanizmi radikala koriste jednostranu strelu za prikazivanje kretanja elektrona:

Homolitičko raskidanje veze se prikazuje strelom koja nalikuje kuki za ribu, da bi se napravila razlika od uobičajenog kretanja dva elektrona, što se prikazuje standardnom zakrivljenom strelom. Treba napomenuti da se drugi elektron raskidajuće veze takođe pomera da formira par sa napadujićem elektronom radikala; to nije eksplicitno prikazano u ovom slučaju.
Slobodni radikali uzimaju učešća u adiciji i supstituciji radikala kao reaktivni intermedijari. Lančane reakcije u kojima učestvuju slobodni radikali se obično dele u tri procesa.
- Reakcije inicijacije rezultuju u povećanju broja slobodnih radikala.
- Reakcije propagacije su reakcije u kojima se totalni broj slobodnih radikala ne menja.
- Reakcije terminacije dovode do umanjenja broja slobodnih radikala. Tipično dva slobodna radikala formiraju stabilnije vrste, npr.: 2Cl·→ Cl2
Nastajanje

Један корисник управо ради на овом чланку. Молимо остале кориснике да му допусте да заврши са радом. Ако имате коментаре и питања у вези са чланком, користите страницу за разговор.
Хвала на стрпљењу. Када радови буду завршени, овај шаблон ће бити уклоњен. Напомене
|
Radikali nastaju delovanjem:
- visoke temperature (termolitičko raspadanje veza)
- ultraljubičastog zračenja, koje djeluje tako što se kovalentne veze homolitički raspadaju (fotoliza)
- rendgenskim i drugim ionizirajućim zračenjem
- elektrohemijski putem oksidacije odnosno redukcije
Za iniciranje reakcije radikalizacije pri hemijskim sintezama često se u reakcionu smjesu dodaje "starter radikala". Pri tome se radi o molekuli koja se naročito lahko cijepa na radikale, naprimjer kada se osvijetli ultraljubičastim svjetlom. Primjeri takvih spojeva su: azobisizobutironitril, dibenzoilperoksid, dilauroilperoksid, di-tert-butilperoksid, diizopropilperoksidikarbonat i kalij-peroksodisulfat.[4]
Radicals are either (1) formed from spin-paired molecules or (2) from other radicals. Radicals are formed from spin-paired molecules through homolysis of weak bonds or electron transfer, also known as reduction. Radicals are formed from other radicals through substitution, addition, and elimination reactions.

Formiranje radikala od spin-uparenih molekula
Homoliza

Homolysis makes two new radicals from a spin-paired molecule by breaking a covalent bond, leaving each of the fragments with one of the electrons in the bond.[5] Because breaking a chemical bond requires energy, homolysis occurs under the addition of heat or light. The bond dissociation energy associated with homolysis depends on the stability of a given compound, and some weak bonds are able to homolyze at relatively lower temperatures.
Some homolysis reactions are particularly important because they serve as an initiator for other radical reactions. One such example is the homolysis of halogens, which occurs under light and serves as the driving force for radical halogenation reactions.
Another notable reaction is the homolysis of dibenzoyl peroxide, which results in the formation of two benzoyloxy radicals and acts as an initiator for many radical reactions.[6]
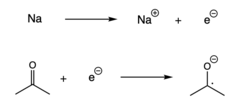
Redukcija
Radicals can also form when a single electron is added to a spin-paired molecule, resulting in an electron transfer.[7] This reaction, also called reduction, usually takes place with an alkali metal donating an electron to another spin-paired molecule.
Formiranje radikala od drugih radikala
Apstrajcija


Hydrogen abstraction describes when a hydrogen atom is removed from a hydrogen donor molecule (e.g. tin or silicon hydride) with its one electron.[8] Abstraction produces a new radical and a new spin-paired molecule. This is different from homolysis, which results in two radicals from a single spin-paired molecule and doesn’t include a radical as its reactant. Hydrogen abstraction is a fundamental process in radical chemistry because it serves as the final propagation step in many chemical reactions, converting carbon radicals into stable molecules. The figure to the right shows a radical abstraction between a benzoyloxy radical and a hydrogen bromide molecule, resulting in the production of a benzoic acid molecule and a bromine radical.
Adicija
Radical addition describes when a radical is added to a spin-paired molecule to form a new radical.[9] The figure on the right shows the addition of a bromine radical to an alkene. Radical addition follows the Anti -Markovnikov rule, where the substituent is added to the less substituted carbon atom.
Eliminacija

Radical elimination can be viewed as the reverse of radical addition. In radical elimination, an unstable radical compound breaks down into a spin-paired molecule and a new radical compound. Shown below is an example of a radical elimination reaction, where a benzoyloxy radical breaks down into a phenyl radical and a carbon dioxide molecule.[10]
Reaktivnost
Reaktivni radikali
Pošto većina radikala reagira egzergono, oni su izrazito reaktivni i kao takvi vrlo kratko "žive" (kraće od jedne sekunde). Neupareni elektroni obično se pri tom nalaze na atomima ugljika, dušika, kisika i žive ili na halogenim elementima.
Nereaktivni radikali

Poznati su također i radikali koji ne reagiraju odmah pri nastanku te mogu postojati tokom određenog vremenskog perioda pa čak se mogu i izolirati kao zasebne supstance. Jedan od takvih "stabilnih" radikala jeste trifenilmetil radikal. Kao i drugi nereaktivni radikali, i on se sa svojim dimerom u rastvoru nalazi u ravnoteži. Dimer trifenilmetil radikala nije heksafeniletan, kao što je Gomberg mislio,[11] već 3-difenilmetilen-6-trifenilmetil-cikloheksa-1,4-dien.[12] Faktori koji vode do stabilnih radikala su, prema nekim teorijama rezonantna stabilizacija (mezomerija), a prema drugim "zastoj" u dimerizaciji, naprimjer putem steričnih, sofisticiranih supstituenata. Stabilni radikali pronađeni su i u prirodi. Tako naprimjer enzim ribonukleotidreduktaza sadrži tirosil radikal čije vrijeme poluraspada iznosi oko četiri dana.
Ugljenikovi radikali
Radikali u čijem središtu se nalazi atom ugljika pokazuju povećanje stabilnosti sljedećim redom: primarni C atom < sekundarni < tercijarni, što je posljedica induktivnog efekta i hiperkonjugacije. Osim toga ugljikov radikal sa sp³ hibridiziranom orbitalom stabilni je od radikalnog centra, u kojem je ugljik iskazuje sp² ili sp hibridizaciju. Aril ili alil grupe također stabiliziraju radikale.
Primeri
- Molekularni kiseonik O2 – ova molekula kisika sadrži dva nesparena elektrona (biradikal •O-O•; prema Lewisovoj formuli O=O daje situaciju vezivanja koja nije potpuna niti je u potpunosti tačna) a nastaje u magnetnom polju kao paramagnetni triplet. Iako su mogućnosti reagiranja ovog biradikala ograničene, jer po principu održanja spina pri hemijskim reakcijama u većini slučajeva je potrebno da se prethodno pobude do singleta kisika.
- Dušik-monoksid •NO – radikal poznat kao supstanca za prenos signala u organizmu. Dušik-monoksid je sastavni dio nitroznih plinova.
- Hidroksil-radikal •OH – jedan od najreaktivnijih i najznačajnijih radikala u atmosferi (važan pri razgradnji supstanci koje zagađuju atmosferu)
- Radikali hlora Cl• – nastaju homolitičkim raspadom veze između dva atoma u molekularnom hloru (Cl2) i veoma su reaktivni međuproizvod pri fotohloriranju alkana kao i hloriranju bočnih lanaca aromatskih spojeva sa supstituiranim alkil grupama. Ovi radikali se otpuštaju i djelovanjem svjetlosti na hlorofluorougljike i učestvuju u razaranju ozonskog omotača.
- Radikali broma Br• – nastaju homolitičkim raspadom veza između dva atoma u molekularnom bromu (Br2) i veoma su reaktivni međuproizvod pri fotobromiranju alkana kao i bromiranju bočnih lanaca aromatskih spojeva sa supstituiranim alkil grupama
- TEMPO – stabilni organski radikal, koji se između ostalog koristi i kao oksidacijsko sredstvo
U biologiji
Radikali, tačnije reaktive vrste kisika, igraju važnu ulogu u brojnim biološkim procesima, a neki od njih mogu i izazvati oštećenja ćelija, što između ostalog može dovesti i do razvoja kancerogenih oboljenja. Oksidativni procesi raznih supstanci u organizmu, koji se odvijaju pod uticajem slobodnih radikala, po mnogim mišljenjima odgovorni su za nastanak arteroskleroze, Alzheimerove bolesti, oštećenja jetre izazvane unosom alkohola u organizam kao i emfizem zbog korištenja duhanskih proizvoda. Od unutarćelijskih signalnih puteva, koji se aktiviraju slobodnim radikalima, signalni put NF-κB je jedan od najznačajnijih.
Zaštita od djelovanja radikala je od životne važnosti za organizam, pa zbog toga tijelo sadrži vrlo efikasne odbrambene mehanizme i mehanizme koje mu omogućavaju popravku u obliku enzima, hormona i drugih supstanci, koje umanjuju i sprječavaju štetno djelovanje radikala. Među tim odbrambenim mehanizmima su antioksidansi poput epigalokatehin galata, superoksid dismutaze, vitamina A, C i E; koenzima Q10; flavonoida poput taksifolina[13] i antocijanina. Osim ovih, smatra se da bilirubin i mokraćna kiselina također mogu neutralizirati slobodne radikale. Hormon melatonin važi za supstancu koja "hvata" radikale odgovorne za oksidativni stres. Jedan od najsnažnijih poznatih antioksidansa, hidridni ion H−, igra važnu ulogu u ciklusu limunske kiseline kao i u mnogim metaboličkim redoks-reakcijama.
U okvirima "teorije starenja", slobodni radikali igraju ulogu u procesima starenja organizma. Prema toj teoriji,[14] radikali se proučavaju kao djelujuće supstance protiv oksidativnog stresa "odgovornog" za starenje. Istraživanja su pokazala da su ćelije ptica značajno otpornije na djelovanje slobodnih radikala. Međutim, pošto je proučavan samo uticaj sintetičkih antioksidanata, ne bi se trebalo izvoditi zaključke o mogućim efektima konzumiranja voća i povrća. Godine 2007. uredništvo Žurnala Američkog medicinskog društva (AMA) pozvalo je na daljnja ispitivanja djelovanja radikala kako bi se utvrdili efekti vitamina C i selena na starenje.[15] Veoma detaljna i nekoliko puta ažurirana analiza britanskog udruženja Cochrane (2007–2012) mogla bi pružiti konačan dokaz da nema pozitivnih efekata prehrambenih dodataka (suplemenata) koji sadrže vitamin C; čak suprotno, smrtnost u proučavanoj grupi osoba bila je neznatno veća od smrtnosti kontrolne grupe.[16]
Reference
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Morrison Robert Thornton; Boyd Robert Neilson (2006). Organic chemistry. Engelwood Cliffs, New Jersey: Prentice Hall. ISBN 8120307658.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ M. D. Lechner; K. Gehrke; E. H. Nordmeier (2009). Makromolekulare Chemie (на језику: немачки) (4 изд.). Birkhäuser Verlag. стр. 54. ISBN 978-3-7643-8890-4.
- ^ Clayden, Jonathan. (2012). Organic chemistry. Greeves, Nick., Warren, Stuart G. (2nd изд.). Oxford: Oxford University Press. ISBN 978-0-19-927029-3. OCLC 761379371.
- ^ „Diacyl Peroxides”. polymerdatabase.com. Приступљено 2020-12-08.
- ^ „IV. Nonchain Reactions: Radical Formation by Electron Transfer”. Chemistry LibreTexts (на језику: енглески). 2015-01-21. Приступљено 2020-12-08.
- ^ „II. Atom Abstraction”. Chemistry LibreTexts (на језику: енглески). 2015-01-11. Приступљено 2020-12-08.
- ^ „Radical Additions: Anti-Markovnikov Product Formation”. Chemistry LibreTexts (на језику: енглески). 2013-10-02. Приступљено 2020-12-08.
- ^ Su, Wei-Fang (2013), Su, Wei-Fang, ур., „Radical Chain Polymerization”, Principles of Polymer Design and Synthesis, Lecture Notes in Chemistry (на језику: енглески), Berlin, Heidelberg: Springer, 82, стр. 137—183, ISBN 978-3-642-38730-2, doi:10.1007/978-3-642-38730-2_7

- ^ Gomberg M. (1. 7. 1901). „On Trivalent Carbon.”. Journal of the American Chemical Society (на језику: енглески). 23 (7): 496—502. doi:10.1021/ja02033a015.
- ^ Siegfried Hauptmann (1985). Organische Chemie (2 изд.). Leipzig: VEB Deutscher Verlag für Grundstoffindustrie. стр. 281. ISBN 3-342-00280-8.
- ^ Yu. A. Vladimirov; E. V. Proskurnina; E. M. Demin; N. S. Matveeva; O. B. Lubitskiy; A. A. Novikov; D. Yu. Izmailov; A. N. Osipov; V. P. Tikhonov; V. E. Kagan (2009). „Dihydroquercetin (taxifolin) and other flavonoids as inhibitors of free radical formation at key stages of apoptosis”. Biochemistry (Moskva). 74 (3): 301—307. PMID 19364325. doi:10.1134/S0006297909030092.
- ^ Kenneth B. Beckmann; Bruce N. Ames (1. 4. 1998). „The Free Radical Theory of Aging Matures”. Phys. Rev. 78 (2): 547—581. doi:10.1152/physrev.1998.78.2.547.
- ^ Goran Bjelakovic; Dimitrinka Nikolova; Lise Lotte Gluud; Rosa G. Simonetti; Christian Gluud (28. 1. 2007). „Mortality in Randomized Trials of Antioxidant Supplements for Primary and Secondary Prevention”. JAMA: The Journal of the American Medical Association. 297 (8): 842—857. doi:10.1001/jama.297.8.842.
- ^ G. Bjelakovic; D. Nikolova; L. L. Gluud; R. G. Simonetti; C. Gluud (2012). „Antioxidant supplements for prevention of mortality in healthy participants and patients with various diseases”. Cochrane database of systematic reviews (Online). 3: CD007176. ISSN 1469-493X. PMID 22419320. doi:10.1002/14651858.CD007176.pub2.

