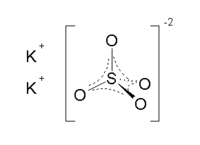
Калијум-сулфат
| |
| Називи | |
|---|---|
| Други називи
Поташум-сулфат
| |
| Идентификација | |
| ECHA InfoCard | 100.029.013 |
| Е-бројеви | E515(i) (регулатор киселости, ...) |
| MeSH | Nickel+carbonate |
| Својства | |
| Моларна маса | 174,259 g/mol (анхидрид) |
| Агрегатно стање | Бела кристална супстанца |
| Густина | 2,66 g/cm3, анхидрован |
| 11.1 g/100 ml (20 °C) | |
| Структура | |
| Кристална решетка/структура | орторомбична |
| Опасности | |
| Главне опасности | Иритант |
| R и S-ознаке | нема |
| Сродна једињења | |
Други анјони
|
Калијум-хидрогенсулфат Калијум-сулфит Калијум-бисулфит Калијум-персулфат |
Други катјони
|
Литијум-сулфат Натријум-сулфат Магнезијум-сулфат |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |
Калијум-сулфат је неорганско хемијско једињење хемијске формуле K2SO4.
Распрострањеност у природи[уреди | уреди извор]
Јавља се у великим количинама у разним двогубим солима у штасфуртским наслагама, као што су шенит и каинит, који и служе за добијање калијум-сулфата.[1]
Добијање[уреди | уреди извор]
Шенит се одваја хлађењем из врућег засићеног раствора каинита, а потом третира раствором калијум-хлорида:
- K2SO4 • MgSO4 • 6H2O + 2KCl → 2K2SO4 + MgCl2 + 6H2O
Прво се добија слабо растворан, анхидровани калијум-сулфат, а концентровањем се из филтрата таложи карналит из кога се добијају калијум-хлорид и магнезијум-хлорид.[1]
Калијум-сулфат се још може добити загревањем калијум-хлорида са сумпорном киселином, али у мањим количинама, а иначе је споредни производ при добијању калијум-дихромата и калијум-перманганата.[1]
Својства[уреди | уреди извор]
То је супстанца коју чине безбојни кристали без воде. У води се слабо раствара (на 0 °C 6,85 g у 100 g воде).[1]
Употреба[уреди | уреди извор]
Користи се за прављење калијумове стипсе и као вештачко ђубриво, посебно приликом гајења дувана и пшенице. Осим калијум-сулфата, као ђубриво се користи и калијум-хлорид, али код парадајза, лука, пасуља и бостана предност се даје калијум-сулфату јер су поменуте биљке осетљиве на веће концентрације хлора.[1]
Извори[уреди | уреди извор]
Спољашње везе[уреди | уреди извор]
