Октетно правило

Октетно правило или правило октета је основно хемијско правило које одражава чињеницу да су атоми главне групе елемената склони комбинацијама у којима сваки има по осам електрона у својој валенцијској љусци, дајући му исту електронску конфигурацију коју има племенити гас. Ово правило се посебно односи на угљеник, азот, кисеоник и халогене, али и на метале као што су натријум или магнезијум.
Валентни електрони могу се прорачунати користећи Луисов дијаграм електронских тачака, као што је приказано на десној страни за угљен диоксид. Заједнички електрони два атома у ковалентној вези броје се два пута, по једном за сваки атом. У угљен диоксиду, сваки кисеоник има четири заједничка електрона са централним угљеником, два (приказана црвено) из самог кисеоника и два (приказана црно) угљеника. Сва четири електрона се рачунају у оба скелета: угљениковом октету и октету кисеоника.
Пример: натријум хлорид
[уреди | уреди извор]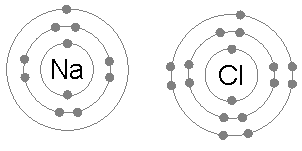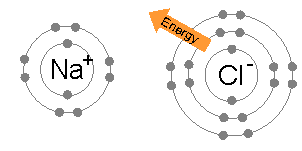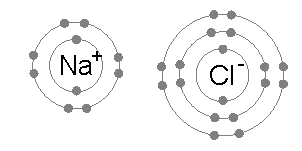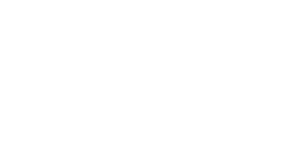
Између парова атома уобичајена је јонска веза, где је један од парњака метал ниске електронегативности (као натријум), а други неметал високе електронегативности (као хлор).
Атом хлора, у вањској електронској љусци има седам електрона, прва и друга љуска се пуне са два, односно осам електрона. Први електронски афинитет хлора (ослобађање енергије када хлор добија електрона) је +328,8 кЈ по молу атома хлора. Додавање другог електрона на хлор захтијева енергију, која се не може повратити стварањем хемијске везе. Резултат је да хлор врло често гради једињења у којима има осам електрона у својој спољашњој љусци (комплетан октет).
Натријумов атом има један електрон у најудаљенијој електронској љусци, а прва и друга љуска поново се пуне са два, односно осам електрона. Да би се уклонио овај спољашњи електрон потребна је само прва енергија јонизације, што износи +495,8 кЈ по молу натријумовог атома, што је мала количине енергије. Насупрот томе, други електрон је у дубљој другој електронској љусци, те је потребна друга енергија јонизације за његово уклањање, која је много већа: +4,562,4 кЈ по молу. Тако ће натријум, у већини случајева, изградити једињење у којем је изгубио један електрон и имати пуну спољну љуску од осам електрона или октет.
Енергија потребна за пренос електрона из атома натријума на атом хлора (разлика од 1. енергије јонизације натријума и електронског афинитета хлора) је мала: 495,8-328,8 = + 167 кЈ мол−1. Ову енергију је лако надокнади енергијом решетке натријум хлорида: –787,3 кЈ мол−1-
Историја
[уреди | уреди извор]У касном 19. веку било је познато да се координациона једињења (раније звана „молекуларна једињења”) стварају комбинацијом атома или молекула на такав начин да се валенце атома задовољавају одвојено.
Године 1893, Алфред Вернер је показао да је број атома или група везан за централни атом („координациони број”) често 4- или 6-валентан; остали познати координациони бројеви су максимално до 8, али су ређи.
Године 1904, Ричард Абег је био један од првих који је проширио концепт координацијског броја на концепт валенције у којем је разликовао атоме као доноре или акцепторе електрона, водећи ка позитивном и негативном стању валенције, што се изврсно уклапа у модерни концепт оксидационог стања. Абег је забележио да разлике између максимума позитивне и негативне валенције хемијских елемената по његовом моделу најчешће износе осам.[1] Гилберт Н. Луис то означава као Абегово правило и користи га да помогне у објашњавању свог модела коцкастог атома и „правила осам”, који су почели да праве разлику између валенције и валенције електрона.[2]
Године 1919, Ервинг Лангмур редефинирао је ове концепте и преименовао у „атом коцкастог октета” и „октетна теорија”.[3] „Октетна теорија” развила се у оно што је данас познато као октетно правило.
Објашњење у квантној теорији
[уреди | уреди извор]Квантна теорија атома објашњава осам електрона као затворене љуске са С2 п6 електронских конфигурација. Конфигурација затворене љуске је она у којој су нижи нивои енергије пуни, а виши нивои празни. На пример, атом неона као основно стање има пуну н = 2 љуску (2с2 2п6) и празну н = 3 љуску. Према правилу октета, атоми непосредно пре и после неона у периодном систему (тј. C, Н, О, Ф, На, Мг и Ал), имају тенденцију да постигну сличну конфигурацију путем добијања, губљења или заједништва електрона.
Атом аргона има аналогну конфигурацију 3с2 3п6. Такође је празна на нивоу 3д, али је на знатно већем енергетском од 3с и 3п (што није слично атому водоника), тако да се 3с2 3п6, за хемијске сврхе и даље сматра као елемент са затвореном љуском. Атоми непосредно пре и након аргона имају тенденцију да постигну ову конфигурацију у једињењима. Постоје неки хипервалентни молекули у којима 3Д ниво може имати улогу у везању, иако је то контроверзно.
Хелијум, према квантној теорији, нема ниво 1п, тако да је 1с2 затворена љуска без п електрона. Атоми пре и после хелијума (Х и Ли) следе дуетно правило, тежећи да имају исту конфигурацију: 1с2 као хелијум.
Изузеци
[уреди | уреди извор]- Некомплетна љуска валенце:
- Седам врста електрона су слободни радикали са неупареним електронима. На пример, метил радикал (ЦХ3) има један неупарени електрон у невезној орбитали на атому угљеника, а без електрона супротног спина у истој орбитали. Други пример је хлорни радикал који настаје од хлорофлуорогљеника (ЦФЦс), познатог по штетном утицају на озонски омотач.
- Шест врста електрона су врло реактивни и кратког даха. Пример су карбени, који имају два незаједничка валентна електрона на истом атому угљеника у триплетном или једноструком стању. Други пример је БХ3, који димеризира у диборат (Б2Х6) да се постигне стабилност.
- Остала правила:
- Дуетно правило прве љуске — племенити гас хелијум има два електрона у спољашњој љусци која је веома стабилна. (Пошто не постоји 1п подљуска, 1 с следи одмах иза 2с и на тај начин љуска 1 може имати највише 2 валентна електрона). Водонику је потребан само један додатни електрон за постизање стабилне конфигурације, а литијум треба да изгуби један.
- За прелазне метале, неке класе молекула имају склоност да се понашају по 18-електронском правилу којем одговара кориштење валентних љуски с, п и д, а орбитале настају везањем и невезујућих орбитала. Међутим, новији теоријски модели подржавају варијанту дуодектетног правила (12 електрона) користећи углавном д и с валентне орбитале.[4] Изузимање п орбитала за атоме прелазних метала аналогно је искључивању д орбитала за хипервалентне молекуле главне групе атома.
Троелектронске везе
[уреди | уреди извор]
Неки стабилни молекулски радикали (нпр. азот оксид, НО) добија конфигурацију октета путем троелектронске везе која доприноси једним заједничким и једним недељеним електроном у октету сваког од везаних атома.[5] У једињењу азот оксид, октет на сваком атому комплетира се са четири електрона од две двоелектронске везе, плус усамљени пар невежућег електрона само на том атому. Веза реда 2,5, сваке двоелектронске везе рачуна се као једна веза, док троелектронска веза има само један заједнички електрон и стога одговара полувези.
Молекулски кисеоник понекад представљен тако као да се понаша по правилу октета с двоструком везом (О=О) садржи два пара заједничких електрона. Међутим, основно стање овог молекула је парамагнетно, што указује на присуство неспарених електрона. Полинг је предложио да овај молекул заправо садржи две троелектронске везе и једну нормалну ковалентну (двоелектронску) везу.[6] Октет се на сваком атому онда састоји од два електрона из сваке троелектронске везе, плус два електрона из ковалентне везе, плус један усамљени пар невежућих електрона.
Хипервалентни молекули
[уреди | уреди извор]Елементи главне групе у трећем и каснијим редовима периодног система могу формирати хиперкоординатне или хипервалентне молекуле у којима је централни атом главне групе везан за више од четири атома. Такав случај је код фосфор-пентахлорида, ПЦл5 и сумпор-хексафлуорида, СФ6. Н апример, код ПЦл5, ако се претпостави пет парова ковалентних веза у којима је пет одвојених електронских парова заједничких, тада фосфор може бити окружен 10-валентним електронима, што „оповргава” октетно правило. У раној фази развоја квантне механике, Лајнус Полинг је предложио да трећередни атоми могу стварати пет веза употребом једне или три п и једне д орбитале или шест веза преко с, три п и две д орбитале.[7] За изградњу пет веза, комбинују се једна с, три п и једна д орбитала за настанак пет сп3д хибридних орбитала, од којих свака има заједнички пар електрона са халогеним атомом, за укупно 10 заједничких електрона, два више него што предвиђа октетно правило.
Сличност са стварањем шест веза, са шест сп3д2 хибридних орбитала ствара се шест веза са 12 заједничких електрона.[8] У овом моделу доступност празних д орбитала користи се за објашњење чињенице да чланови трећег реда атома, као што су фосфор и сумпор могу изградити више од четири ковалентне везе, док су они у другом реду, као што су азот и кисеоник строго ограничени правилом октета.[9]
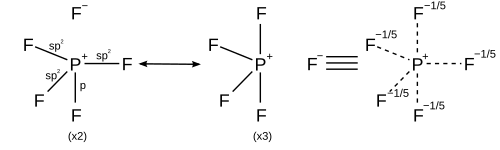
Међутим, други модели описују везање користећи само с и п орбитале, сагласно са правилом октета. Валентне везе у опису ПФ5 користе резонанцу између различитих ПФ4+Ф− структура, тако да је сваки Ф везан ковалентном везом у четири структуре и јонске везе у једној структури. Свака резонантна структура на П има по осам валентних електрона.[10] Опис теорије молекулских орбитала подразумева да је највиша заузета молекулска орбитала невезујућа орбитала која је локализирана на пет атома флуора, уз четири заузете везне орбитале, тако да поново постоји само осам валентних електрона фосфора. Исправност правила октета за хипервалентне молекуле даље подржава и аб инитио прорачун молекулских орбитала, који показује да је мало учешће д функција у вежућим орбиталама.[11][12]
Референце
[уреди | уреди извор]- ^ Абегг, Р. (1904). „Дие Валенз унд дас периодисцхе Сyстем. Версуцх еинер Тхеорие дер Молекуларвербиндунген (Валенцy анд тхе периодиц сyстем – Аттемпт ат а тхеорy оф молецулар цомпоундс)”. Зеитсцхрифт фüр анорганисцхе Цхемие. 39 (1): 330—380. дои:10.1002/заац.19040390125.
- ^ Леwис, Гилберт Н. (1916). „Тхе Атом анд тхе Молецуле”. Јоурнал оф тхе Америцан Цхемицал Социетy. 38 (4): 762—785. дои:10.1021/ја02261а002.
- ^ Лангмуир, Ирвинг (1919). „Тхе Аррангемент оф Елецтронс ин Атомс анд Молецулес”. Јоурнал оф тхе Америцан Цхемицал Социетy. 41 (6): 868—934. дои:10.1021/ја02227а002.
- ^ Френкинг, Гернот; Схаик, Сасон, ур. (мај 2014). „Цхаптер 7: Цхемицал бондинг ин Транситион Метал Цомпоундс”. Тхе Цхемицал Бонд: Цхемицал Бондинг Ацросс тхе Периодиц Табле. Wилеy -ВЦХ. ИСБН 978-3-527-33315-8.
- ^ Харцоурт, Рицхард D., ур. (2015). „Цхаптер 2: Паулинг "3-Елецтрон Бондс", 4-Елецтрон 3-Центре Бондинг, анд тхе Неед фор ан "Инцреасед-Валенце" Тхеорy”. Бондинг ин Елецтрон-Рицх Молецулес: Qуалитативе Валенце-Бонд Аппроацх виа Инцреасед-Валенце Струцтурес. Спрингер. ИСБН 9783319166766.
- ^ L. Паулинг Тхе Натуре оф тхе Цхемицал Бонд (3рд ед., Оxфорд Университy Пресс 1960) цхаптер 10.
- ^ L. Паулинг Тхе Натуре оф тхе Цхемицал Бонд (3рд ед., Оxфорд Университy Пресс 1960) п.63. Ин тхис соурце Паулинг цонсидерс ас еxамплес ПЦл5 анд тхе ПФ6− ион. ISBN 0-8014-0333-2
- ^ Р.Х. Петруцци, W.С. Харwоод анд Ф.Г. Херринг, Генерал Цхемистрy (8тх ед., Прентице-Халл 2002) п.408 анд п.445 ISBN 0-13-014329-4
- ^ Доуглас Б.Е., МцДаниел D.Х. анд Алеxандер Ј.Ј. Цонцептс анд Моделс оф Инорганиц Цхемистрy (2нд ед., Јохн Wилеy 1983) пп.45-47 ISBN 0-471-21984-3
- ^ Housecroft C.E. and Sharpe A.G., Inorganic Chemistry, 2nd ed. (Pearson Education Ltd. 2005), p.390-1
- ^ Miessler D.L. and Tarr G.A., Inorganic Chemistry, 2nd ed. (Prentice-Hall 1999), p.48
- ^ Magnusson, E., J.Am.Chem.Soc. (1990), v.112, p.7940-51 Hypercoordinate Molecules of Second-Row Elements: d Functions or d Orbitals?
