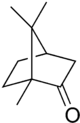
Kamfor
| |
| |
| Nazivi | |
|---|---|
| IUPAC nazivs
1,7,7-trimethylbicyclo
[2.2.1]heptan-2-one | |
| Drugi nazivi
2-bornanone, 2-camphanone
bornan-2-one, Formosa | |
| Identifikacija | |
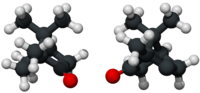
3D model (Jmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.000.860 |
| RTECS | EX1260000 (R) EX1250000 (S) |
| |
| |
| Svojstva | |
| C10H16O | |
| Molarna masa | 152,23 |
| Agregatno stanje | Beli ili bezbojni kristali |
| Gustina | 0,990 (чврсто стање) |
| Tačka topljenja | 179.75 °C (452.9 K) |
| Tačka ključanja | 204 °C (477 K) |
| 0.12 g u 100 ml | |
| Rastvorljivost u hloroform | ~100 g u 100 ml |
| Hiralna rotacija [α]D | +44.1° |
| Opasnosti | |
| Glavne opasnosti | zapaljiv |
| R-oznake | 11-20/21/22-36/37/38 |
| S-oznake | 16-26-36 |
| NFPA 704 | |
| Srodna jedinjenja | |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |
| Reference infokutije | |
Kamfor je smolasta materija, bela ili bezbojna, gorkog ukusa, rashlađujućeg i specifično jakog mirisa. Predstavlja glavni sastojak etarskog ulja kamforovog drveta (Cinnamomum camphora), visokog zimzelenog drveta koje raste u Aziji (posebno na Borneu i Tajvanu), a može se naći i u drvetu -Dryobalanops aromatica}-, džinovskom stablu u šumama Bornea. Po svom hemijskom sastavu, to je terpenoid sa formulom C10H16O. Javlja se i u nekim drugim biljkama iz familije -Lauraceae}-, posebno u jedinkama vrste -Ocotea usambarensis}-. Može biti i vještački spravljeno od terpentinskog ulja. Zbog svog mirisa se koristi kao začin (najčešće u indijskoj kuhinji), ali i u vjerskim obredima i u medicinske svrhe. Rastvara se u masnim uljima, etarskim uljima i etanolu.
Norkamfor je derivat kamfora, u kojem su tri njegove metilne grupe zamijenjene vodonikom.
Izdvajanje[uredi | uredi izvor]
Najveći sadržaj kamfora se nalazi u etarskom ulju koje se dobija destilacijom kore korijena kamforovog drveta. To etarsko ulje sadrži oko 30-50% kamfora. Nakon destilacije, etarsko ulje se hladi, pri čemu se kamfor izdvaja kao talog koji se od tečnosti odvaja centrifugiranjem, a preostala količina kamfora, koja je ostala u tečnom dijelu (ne izdvaja se sav kamfor hlađenjem), izdvaja se takozvanom frakcionom destilacijom.
Upotreba[uredi | uredi izvor]
Kamfor se upotrebljava u obliku rastvora i linimenata (mazila) za utrljavanje kod reumatskih bolova, mialgija, neuralgija. Glavna djelovanja kamfora su iritantno i antiseptično. Ranije se koristio kao stimulans disanja u obliku injekcija ili inhalacija.
Kamfor može izazvati jaku iritaciju praćenu bolovima kod djece, starijih osoba ili preosetljivih osoba svih životnih doba.
Reakcije[uredi | uredi izvor]
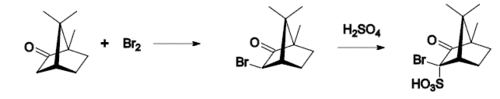
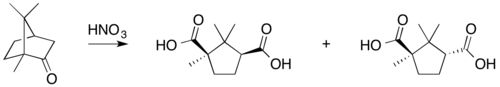
Tipične reakcije kamfora su:
- konverzija u izonitrozokamfor.
Kamfor se može redukovati u izoborneol koristeći natrijum borohidrid.
Izvori[uredi | uredi izvor]
- ^ Susan Budavari, ur. (2001). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (13th izd.). Merck Publishing. ISBN 0911910131.
- ^ Lide David R., ur. (2006). CRC Handbook of Chemistry and Physics (87th izd.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ „CAS No.464-49-3,(1R,4R)-(+)-Camphor Suppliers,MSDS download”.
- ^ „CAS No.464-48-2,l-Camphor Suppliers”.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.