Živa(II) nitrat
| |

| |
| Nazivi | |
|---|---|
| IUPAC nazivs
Živa dinitrat
Živa(II) nitrat | |
| Drugi nazivi
Živin nitrat
| |
| Identifikacija | |
| |
3D model (Jmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.030.126 |
| EC broj | 233-152-3 |
| RTECS | OW8225000 |
| UNII | |
| UN broj | 1625 |
| |
| Svojstva | |
| Hg(NO 3) 2 | |
| Molarna masa | 324,60 g/mol (bezvodno) |
| Agregatno stanje | bezbojni kristali ili beli prah |
| Miris | oštar |
| Gustina | 4,3 g/cm3 (monohidrat) |
| Tačka topljenja | 79 °C (174 °F; 352 K) (monohidrat) |
| rastvorljiv | |
| Rastvorljivost | rastvorljiv u azotnoj kiselini, acetonu, amonijaku, a nerastvorljiv u etanolu |
| −74.0·10−6 cm3/mol | |
| Opasnosti | |
| Bezbednost prilikom rukovanja | ICSC 0980 |
| GHS grafikoni |    
|
| GHS signalna reč | Opasno |
| H272, H300, H310, H330, H373, H410 | |
| Kategorie:Wikipedia:Gefahrstoffkennzeichnung unbekannt ? | |
| NFPA 704 | |
| Tačka paljenja | Nezapaljiv |
| Srodna jedinjenja | |
Drugi anjoni
|
Živa(II) sulfat Živa(II) hlorid |
Drugi katjoni
|
Cink nitrat Kadmijum nitrat |
Srodna jedinjenja
|
Živa(I) nitrat |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
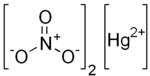
Živa(II) nitrat je neorgansko jedinjenje sa hemijskom formulom Hg(NO
3)
2 i predstavlja so žive(II) i azotne kiseline (HNO
3). Sastoji se od katjona žive Hg2+ i anjona nitrata NO−
3. U slučaju hidratisanih soli, sadrži i kristalnu vodu H
2O, pa može formirati hidrate poput Hg(NO
3)
2·xH
2O.
Bezvodni i hidratni oblici živa(II) nitrata su bezbojni ili beli rastvorljivi kristali koji se ponekad koriste kao reagensi u hemijskim reakcijama. Ovaj spoj se dobija tretiranjem žive vrućom, koncentrovanom azotnom kiselinom. Do sada, ni bezvodni oblik ni monohidrat nisu potvrđeni putem rendgenske kristalografije. [3] Bezvodni materijal je češće u upotrebi.
Živa(II) nitrat je toksična bezbojna ili bela rastvorna kristalna živa(II) so azotne kiseline. Ova materija se koristi za tretiranje krzna. Izlaganje živo(II) nitratu može da proizvede fiziološke bolesti.[4]
Produkcija
[уреди | уреди извор]Živa(II) nitrat se formira reakcijom vruće koncentrovane azotne kiseline sa metalom živa. Razblažena azotna kiselina bi proizvela živa(I) nitrat. Živa(II) nitrat je oksidaciono sredstvo.
Sinteza
[уреди | уреди извор]Živa(II) nitrat se dobija direktnim delovanjem azotne kiseline na metalnu živu. Neophodno je raditi sa viškom azotne kiseline kako bi se sprečilo formiranje živinog(I) nitrata Hg2(NO3)2.
Reakcija je sledeća:
U prisustvu vazduha, azotni monoksid se odmah oksiduje u azot-dioksid tamnocrvene boje.
- Rastvaranje žive u vrućoj, koncentrovanoj azotnoj kiselini:
- ili rastvaranje živinog oksida u razblaženoj azotnoj kiselini:
- Oksidacija živinog(I) nitrata vrućom, koncentrovanom azotnom kiselinom:
- Ili oksidacijom kiseonikom u razblaženoj azotnoj kiselini:
- Reakcija žive sa azot-dioksidom:
Posebne reakcije
[уреди | уреди извор]Sa uream: Kada se u razblaženi rastvor uree doda 1% rastvora živa(II) nitrata, taloži se sledeće jedinjenje:
- CO(NH2)2.Hg(NO3)2·HgO
Fizička svojstva
[уреди | уреди извор]Živa(II) nitrat formira bezbojne kristale.
Rastvorljiv je u hladnoj vodi zakiseljenoj kiselinom, dok se hidrolizuje u vrućoj vodi. Rastvara se u acetonu.
Formira kristalohidrate sastava Hg(NO3)2•n H2O, gde je n = ½, 1, 2, ili 8.
Hemijska svojstva
[уреди | уреди извор]- Bezvodnu so dobijamo sušenjem kristalohidrata u vakuumu:
- Raspada se pri zagrevanju:
- Reaguje sa vodom:
- Reaguje sa bazama:
- Ulazi u reakcije razmene:
- U razblaženoj azotnoj kiselini reverzibilno reaguje sa živom:
Upotreba
[уреди | уреди извор]Živa(II) nitrat se koristi kao oksidaciono sredstvo u organskoj sintezi, kao sredstvo za nitrifikaciju, kao analitički reagens u laboratorijama, u proizvodnji filca i u proizvodnji živinog fulminata. [5] Alternativni kvalitativni Zeiselov test može se izvesti upotrebom živa(II) nitrata umesto srebrovog nitrata, što dovodi do formiranja skarlatno crvenog živa(II) jodida. [6]
Među reakcijama se ubrajaju:
- regeneracija karbonilne grupe; pomešan sa vlažnim silika-gelom, pretvara oksime, hidrazone i semikarbazone u odgovarajuće karbonilne grupe, čak i kada su korišćeni za zaštitu same karbonilne grupe [7]
- nitracija aromatičnih supstrata pod blažim uslovima u odnosu na upotrebu mešavina sumporne i azotne kiseline; na primer, za sintezu pikrinske kiseline [8] (dvostruka funkcija reagensa i katalizatora)
- olefinacija vicinalnih hlorisanih organskih jedinjenja [9]
- titrant za proveru prisustva hlorida u vodi, koristeći bromofenol plavo kao indikator, što je alternativa argentometrijskoj Mohr-ovoj metodi.
- reagens za merkuraiciju (uvođenje žive u supstrat).
Koristi se za pripremu živinog fulminata i kao reagens za dobijanje živinih oksida i drugih soli, kako živinih(II) tako i živinih(I).
Zdravstvene informacije
[уреди | уреди извор]Jedinjenja žive su veoma toksična. Upotreba ovog jedinjenja od strane šeširdžija i posledično trovanje živom kod tih šeširdžija je uobičajena teorija o tome odakle potiče fraza „lud kao šeširdžija“.
Kao rastvorljiva so žive, živa(II) nitrat se brzo apsorbuje pri gutanju i stoga je klasifikovan kao veoma otrovan. Čak i pri minimalnom kontaktu, udisanju prašine ili dodiru sa kožom, potrebna je hitna medicinska pomoć. U telu pokazuje kumulativna svojstva.
Živin nitrat je veoma štetan za biološku ravnotežu u vodenim ekosistemima. Stoga ne sme dospeti u životnu sredinu.
Kao i mnogi neorganski nitrati, živin nitrat je oksidaciono sredstvo. Zbog toga može reagovati burno ili čak eksplozivno u kontaktu sa zapaljivim organskim supstancama, kao što su ugljovodonici, alkohol, ali i sa redukcionim sredstvima. [10]
U medicini se može koristiti kao lek protiv sifilisa; generalno je dobar antiseptik.
Vidi još
[уреди | уреди извор]Reference
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Nolte, M.; Pantenburg, I.; Meyer, G. (9. 12. 2005). „The Monohydrate of Basic Mercuric Nitrate, [Hg(OH)](NO3)(H2O)”. Zeitschrift für anorganische und allgemeine Chemie (на језику: немачки). Wiley Publishing. 632 (1): 111—113. ISSN 0044-2313. doi:10.1002/zaac.200500344. Архивирано из оригинала 27. 11. 2021. г. Приступљено 16. 5. 2022.
- ^ „The Not-So-Mad Hatter: Occupational Hazards of Mercury”.
- ^ „Mercury nitrate monohydrate”. Chemical Book. 2023. Приступљено 30. 6. 2024.
- ^ Wang, Zerong (2010). „Zeisel Determination”. Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons. стр. 3115—3118. ISBN 9780470638859. doi:10.1002/9780470638859.conrr689.
- ^ Surya Kanta De, Synthetic Communications, 2004, Vol34(12) pp2289-2294.
- ^ United States Patent 2,455,322.
- ^ United States Patent 4,393,227: Olefinic compounds are made from their vicinally chlorinated organic precursors by dechlorination with metallic magnesium in the presence of a mercury-based promoter, which may be a water-soluble mercury salt or metallic mercury, and of a catalytic amount of iodine.
- ^ Richard J. Lewis, Sr. (2008). Hazardous Chemicals Desk Reference. John Wiley & Sons. стр. 879. ISBN 0-470-33445-2.
Literatura
[уреди | уреди извор]- Химическая энциклопедия. 4. М.: Советская энциклопедия. Редкол.: Кнунянц И.Л. и др. 1995. ISBN 5-82270-092-4 Проверите вредност параметра
|isbn=: checksum (помоћ). - Справочник химика. 2 (3-е изд., испр изд.). Л.: Химия. Редкол.: Никольский Б.П. и др. 1971.
- Лидин Р.А.; et al. (2000). Химические свойства неорганических веществ: Учеб. пособие для вузов (3-е изд., испр изд.). М.: Химия. ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. (1972). Неорганическая химия. Химия металлов. 2. М.: Мир.
Spoljašnje veze
[уреди | уреди извор]- ATSDR - ToxFAQs: Mercury Архивирано на сајту Wayback Machine (6. октобар 1999)
- ATSDR - Public Health Statement: Mercury Архивирано на сајту Wayback Machine (2. август 2002)














