Рак једњака
| Рак једњака | |
|---|---|
 | |
| Класификација и спољашњи ресурси | |
| Специјалност | онкологија хирургија |
Рак једњака један је од злоћудних (малигних) тумора горњих партија гастроинтестиналног система, који због тенденције ка давању удаљених метастаза има веома лошу прогнозу, без обзира на до сада доступне начине лечења.[1] Најчешћи и најзначајнији облици злоћудних тумора једњака (мишићне цеви чија је улога транспорт хране од уста до желуца) су планоцелуларни карцином и аденокарцином.[2] Планоцелуларни карцином се развија од ћелија епитела једњака, и најчешће је локализован у горњим и средњим сегментима једњака (најчешће у средњој трећини). Аденокарцином настаје из жлезданих ћелија и најчешће је локализован у завршним деловима (дисталној трећини) једњака. У остале злоћудне туморе једњака спадају; карцином вретенастих ћелија, верикозни карцином, псеудосарком, мукопидермоидни карцином, аденосквамозни карцином, цилиндром, примарни карцином светлих ћелија, хориокарцином, карциноидни тумор, сарком и примарни малигни меланом.[1]
Симптоми болести су прогресивна дисфагија и хематемеза, праћене све већим губитком телесне тежине.[3]
Дијагноза се поставља ендоскопијом и потом допуњује компјутеризованом томографијом и ендоскопском ултразвучном сонографијом, ради одређивања стадијума тумора.[4]
Успех лечења зависи од стадијума у коме је откривен туморски процес и укључује комбиновану терапију (операцију са хемотерапијом и зрачењем).
Дугогодишње преживљавање је слабо, изузев код болеснике са јасно локализованим обликом болести.[2]
Анатомија
[уреди | уреди извор]

Једњак или езофагус (лат. oesophagus) мишићно слузокожни је орган дигестивног система, који транспортује храну од ждрела до желуца.[5][6] Цевастог је облика дужине 22-25 cm, који се настављањем на ждрело а завршава у желудачном отвору за једњак кардији (лат. cardia). Завршни отвор једњака удаљен је око 42 cm од почетка усне дупље. Пречник једњака је око 2 cm (кад храна пролази кроз њега), али је на неким местима и мањи.[7][8]
Једњак пролази кроз врат, грудни кош и трбух, па је и подељен на та три дела, вратни, грудни и трбушни део.[5]
- Вратни део једњака
Овај сегмент је почетни део једњака и од манубријума грудне кости прелази у грудни део. Дужне је око 5 cm. Између једњака и преткичмених мишића налази се ретроезофагеални простор, који омогућава покрете једњака при гутању. Испред једњака је душник, а између једњака и душника пролазе повратни гркљански живци (лат. n. laringeus recurrens). Бочно леже режњеви штитне жлезде, каротидне артерије, унутрашње југуларне вене и оба живца вагуса (сваки са по једне стране).[6]
- Грудни део једњака
Овај део једњака је дуг око 15-20 cm и то је његов најдужи део. Подељен је на горњи и доњи грудни део.
Горњи грудни део, се налази у горњем средогруђу (медијастинуму). Овај део се налази иза душника и изнад лука аорте. Леви главни бронх притиска једњак са предње стране и ствара на њему средње сужење. Између задње стране једњака и кичменог стуба, са мишићима налази се ретроезофагеални простор. Задњу страну укршта грудни лимфни канал (лат. ductus thoracicus). Леву страну једњака додирује лук аорте, ствара на њему средње сужење и потискује га удесно. Са леве стране једњака налази се лева заједничка каротидна артерија, такође овом страном у жлебу између једњака и душника пролази и леви повратни гркљански живац. Лева страна једњака додирује и леву плућну марамицу. Десна страна једњака се налази иза душника и додирује десну плућну марамицу. У околини једњака се налазе бројни паратрахеални лимфни чворови.[6]
Доњи грудни део, налази се испод рачве душника и иза срчане марамице, тако да је са предње стране прекривен њом и преко ње додирује леву преткомору и комору срца. Десна плућна артерија такође пролази испред једњака нешто изнад срчане марамице. У доњем делу предњом страном једњака силази леви живац вагус, док десни вагус силази задњом страном једњака. Аортни лук се подвлачи испод једњака и прелази на његову задњу страну. У нивоу дијафрагме грудна аорта је сасвим позади једњака. Задња страна једњака је и у контакту са грудним лимфним каналом и веном азигос.
- Трбушни део
Овај део једњака почиње отвором дијафрагме (пречага) кроз који пролази једњак (лат. hiatus asophageus). Овај део је кратак, 2-4 cm, левкастог облика и обухваћен је мишићима пречаге, која имају улогу сфинктера (затварача) једњака. Завршава се ушћем у желудац (лат. ostium cardiacum).[5]
Епидемиологија
[уреди | уреди извор]
- Морбидитет/морталитет
Карцином једњака, на глобалном нивоу седми је по реду узрок смрти у свету. Јавља се код отприлике 3-6 особе на 100 000 становника, и у сталном је благом порасту, посебно у ендемским областима које имају и већу стопу по глави становника. Стопа петогодишњег преживљавања болесника, у раздобљу од 2001. до 2007. године, била је 19%.[10]
Светска здравствена организација (СЗО) препознаје најмање 23 примарна типа тумора једњака, међу којима су два најчешћа малигна тумора; планоцелуларни карцином (ПЦК) који, према различитим изворима, учествује на глобалном нивоу у укупној неопластичној езофагеалној патологији са око 70-90% случајева, и аденокарцином једњака, који ичествује са око 4 - 10% случајева.[11]
Рак једњака у развијеним земљама света, као што су САД јавља се у око 13.500 случајева, и праћен је смртношћу од око 12.500 случајева годишње. Од наведеног броја планоцелуларни карцином у САД присутан је у око 8.000 случајева годишње. Слични подаци о учесталости овог малигног тумора добијени су и у деловима Азије и Јужној Африци.[12] У неким регионима, као што су области на северу Ирана, неке области јужне Русије и северне Кине, учесталост карцинома једњака може бити јако висок са око 800 случајева на 100.000 становника, док је у Сједињеним Америчким Државама, карцином сквамозних ћелија узрок 95% свих канцера једњака широм света.
Највећи број карцином једњака пореклом је од плочасто слојевитог епитела, мада је у 21. веку број оболелих од аденокарцинома у сталном порасту, нпр. за око 600% у САД, где је за последњих 30 година и превазишао инциденцију ПЦК, и најчешће се јавља током шесте и седме деценије живота.
- Расне и полне разлике
У САД рак једњака је 4-5 пута чешћи у црнаца него у белаца и 2-3 пута чешћи код мушкараца него код жена (мушко женски однос је 3-4 : 1) Аденокарцином чија је учесталост у сталном порасту; четири пута је чешћи у белаца него у црнаца, и чини око 50% свих карцинома једњака у белаца. До 1970, карцинома једњака је био најчешћи тип рака једњака (90-95%), којим су најчешће били погођени хиспано Индијанци који су у анамнези навели дугу историју пушења и конзумирања алкохола.
Учесталост аденокарцинома једњака у Сједињеним Америчким Државама показала је просечан годишњи раст од 1,7% код мушкараца и 1,9% у жена од 1999. до 2008. године.[10]
| „ | Према подацима Регистра за рак Института за за заштиту здравља Србије „Др Милан Јовановић -Батут“ из 2002. године у централној Србији укупан број новооболелих од карцинома једњака износи 148 нових случајева што чини 0,75% регистрованих малигних тумора на годишњем нивоу, при чему је то 1,06% тумора код мушкараца и 0,43% тумора код жена. | ” |
Етиологија
[уреди | уреди извор]Основни фактори ризика за појаву рака једњака су;[13]
- Уживање алкохола и дувана (у било ком облику)
Једна холандска студији, којом је истраживањем било обухваћено 120.852 учесника, показала је комбиноване ефекте пушења и конзумирања алкохола на ризик појаве карцинома једњака. Међу учесницима који су пили 30 грама или више етанола дневно, стопа карцином сквамозних ћелија једњака била је за 4,61 већа у поређењу са апстинентима. Пушача који су конзумирали више од 15 грама/дневно етанола имали су стопу учесталости карцинома једњака која је за 8,05 била већа у односу на непушача који су конзумирали мање од 5 грама/дневно етанола.
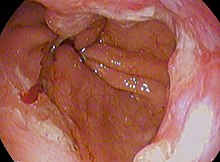
- Ахалазија
Или дисинергија једњака представља дифузни моторни поремећај, који се карактерише ослабљеном перисталтиком и немогућношћу релаксације доњег дела једњака.[14] Јавља се код оба пола (чешће код мушкараца) између 30. и 60. године живота.[15]
- Гастроезофагеални рефлуксне болести, посебно Беретов једњак
Гастроезофагеалне рефлуксне болести једна су од компликација у подручју цилиндричног епитела доњег дела једњака, која настаје због дуготрајног езофагеалног рефлукса.[16] У 75% случајева болест је праћен горушицом, а у 5-15% болесника, са гастро езофагеалним рефлуксом, манифестује са предканцерозним стањем (метаплазијом или појавом желудачног епитела у једњаку), насталог због дуготрајне изложености желудачној киселини цилиндричног епитела хроничним рефлуксом желудачног садржаја. Стање је названо по Норману Барету (Norman Barrett 1903—1979) који је први описао ово стање 1957. године.[17]
- Хумани папилома вирус,
- Унос киселина или база, нпр. код задесних или самоубилачка тровања (са последичним ожиљцима слузокоже једњака),
- Склеротерапија,
- Плумер-Винсонов синдром,
- Зрачење једњака.
- Дефицит витамина и других нутријената
Дефиицит рибофлавин, витамин А и Ц и неких нутријената (молибден, манган, цинк, гвожђе, силицијум, баријум, титанијум и магнезијум), може бити један од фактора за појаву рака једњака. Наиме услед дефицита минерала и витамина може се очекивати повећана инвазија гљивица и контаминација хране микотоксинима.
- Генетски фактори
Генетски чиниоци наводе се као значајни за развој СЦК, иако су (као етиолошки фактор) недовољно истражени.[13][18] Тако се у литератури наводи да 50% болесника са тилозом (палмарном и плантарном хиперкератозом), аутозомно доминантним поремећајем, болује од рак једњака до 45 године старости, а 95% до 55 године старости. Такође генетски изазван полиморфизам ензима који метаболишу алкохол може представљати ризик за неке особе, јер оне не могу спречити оштећења изазвана метаболитима алкохола, као што је ацеталдехид.
Аденокарцином који се најчешће јавља у дисталном делу једњака, понекад је тешко разликовати од аденокарцинома кардије који захвата дистални део једњака. Већина аденокарцинома израста из Беретовог једњака насталог као последица хроничног гастроезофагеалне рефлуксне болести и рефлуксног езофагитиса.
Врсте тумора
[уреди | уреди извор]Аденокарцином једњака
[уреди | уреди извор]Аденокарцином је најчешћи тип рака једњака. Болесници са Беретовим једњаком (који се може развити из гастроезофагеалне рефлуксне болести) испољавају повећани ризик од појаве ове врсте рака. Остали фактори ризика укључују пушење, мушки пол или гојазност.[3]
Остали тумори једњака
[уреди | уреди извор]Мање чести малигни тумори једњака су;
- карцином вретенастих ћелија (слабо диференцирана варијанта планоцелуларог карцинома), варикозни карцином (добро диференцирана варијанта планоцелуларног карцинома):

- псеудосарком,
- мукопидермоидни карцином,
- аденосквамозни карцином,
- цилиндром (аденоидне цистични карцином),
- примарни карцином светлих ћелија,
- хориокарцином,
- карциноидни тумор,
- сарком
- примарни малигни меланом.
Метастатски тумори једњака
[уреди | уреди извор]Метастатски тумори чине око 3% тумора једњака. Меланом и рак дојке најчешће метастазирају у једњак; остали тумори чине рак главе и врата, плућа, желуца, јетре, бубрега, простате, тестиса и костију. Ови тумори обично захватају везивну строму око једњака, док примарни тумори једњака почињу свој раст у мукози или субмукози једњака.[17]
Клиничка слика
[уреди | уреди извор]| Дисфагија |
|
| Губитак тежине |
|
| Ретсростанални бол |
|
| Хематемеза |
|
| Респираторни симптоми |
|
| Остали симптоми |
|
Дијагноза
[уреди | уреди извор]У зависно од тога да ли се ради о отежаном гутању круте или текуће хране, и други поремећаји мотилитета једњака и пратећи знаци и симптоми, потребно је учинити следећа испитивања, која је 2013. године предложило Друштво за грудну хирургију, и тиме помогло клиничкој пракси у дијагностици и лечењу локализованог рака једњака.[4][19] Њихове препоруке су следеће:
- Радиографски преглед једњака и желуца. Преглед треба обавити уз помоћ баријума, заједно са уносом чврстог залогаја (најчешће кекса или таблета). Ако се утврди опструкција, треба учинити ендоскопски преглед
- Ендоскопија (по могућности и биопсија) једна је метода која искључује или потврђује малигни процес. Ако је налаз негативан или ако указује на поремећај мотилитета, потребно је испитати мотилитет једњака.[20]
- Хромоендоскопија (употреба боја). Ово је једна од метода ендоскопије једњака високе резолуције, заснована на спектроскопији, уских подручја снимање (оптичка технологија употребљених филтера побољшава видљивост крвних судова) и аутофлуоресценцији (која користи природну емисију светлости биолошких ткива).
- Компјутеризована томографија или магнетна резонантна томографија. Ове методе обухватају преглед грудног коша и горњег дела трбуха.[21][22]
- Ендоскопска ултрасонографија - повећава тачност скеле туморског процеса.[23][24]
- Аспирација лимфног чвора
- Бронхоскопија. Ова метода се користи код високо позиционираних тумора у једњаку или ако је присутна изражена промуклости или хемоптизије.
-
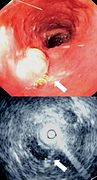
Ендоскопска слика Барретовог једњака, честог прекурсора аденокарцинома једњака
-
Ендоскопија и радијални ендоскопски ултразвук субмукозног тумора у централном делу једњака
-
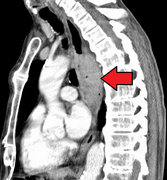
Контрастни ЦТ снимак који показује тумор једњака (коронални поглед)
-
Рак једњака
-
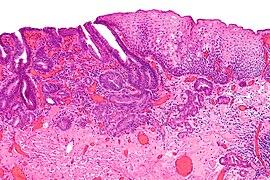
Микрографија хистопатолошког налаза аденокарцинома једњака (тамноплави – горњи леви део слике) и нормалног сквамозног епитела (горе десно на слици)
Диференцијална дијагноза
[уреди | уреди извор]Диференцијална дијагноза рака једњака укључује:[4]
- Болести једњака било ког узрока.
- Компресија једњака из екстерних извора - на пример, увећане лимфне жлезде или карцином бронхија.
- Ахалазија.
- Рак желуца.
- Интрамурални бенигни тумори - нпр, леиомиом.
- Метастатски тумори - најчешће из грудног коша.
Терапија
[уреди | уреди извор]



Терапију би требало да води мултидисциплинарни тим из различитих специјалности.[25] У склопу терапије мора се обезбедити адекватна исхрана и одговарајућа нега зуба. Фактори који утичу на одлуке о начину лечењу укључују:[26]
- стадијум рака,
- ћелијски тип рака: аденокарцином једњака (AKJ), карцином сквамозних ћелија једњака (ЕСЦЦ) и друге специфични облици рака),
- опште стање болесника,
- постојање удруженим болестима.
Генерално, лечење са куративном намером је ограничено на локализовану болест, која је без удаљених метастаза. У таквим случајевима може се размотрити комбиновани приступ који укључује хемотерапију, радиотерапију и операцију. Болест која је широко распрострањена, метастатска или рекурентна лечи се палијативно (хемотерапијом која се може користити за продужење преживљавања, док се третмани као што су радиотерапија или стентирање могу користити за ублажавање симптома и олакшавање гутања).[26]
Хирургија
[уреди | уреди извор]Ако је рак дијагностикован још у раној фази, хируршко лечење са куративном намером може бити могуће. Неки мали тумори који захватају само слузокожу или слузницу једњака могу се уклонити ендоскопском ресекцијом слузокоже (ЕМР).[27][28] Иначе, куративна хирургија лезија у раној фази може да подразумева уклањање целог или дела једњака (езофагектомија). Ово је тешка операција са релативно високим ризиком од смртности или постоперативних потешкоћа. Предности операције су мање јасне у раној фази ЕСЦЦ него код АКЈ.
Постоји велики број хируршких опција, а најбољи избори за одређене ситуације остају предмет истраживања и дискусије.[29][30] Поред карактеристика и локације тумора, други фактори укључују стање пацијента и врсту операције са којом је хируршки тим најискуснији.
Вероватан квалитет живота након лечења је релевантан фактор када се разматра операција.[31] Хируршки исходи су вероватно бољи у великим центрима где се процедуре често изводе. Ако се рак проширио на друге делове тела, езофагектомија се данас нормално не изводи.[тражи се извор]
Езофагектомија је уклањање сегмента једњака; пошто се тиме скраћује дужина преосталог једњака, неки други сегмент дигестивног тракта се повлачи кроз грудну шупљину и умеће. Ово је обично ђелудац или део дебелог црева (дебело црево) или јејунум. Поновно повезивање желуца са скраћеним једњаком назива се езофагогастрична анастомоза.[тражи се извор]
Езофагектомија се може извести на неколико метода. Избор хируршког приступа зависи од карактеристика и локације тумора, као и од преференција хирурга. Недостају јасни докази из клиничких испитивања за које приступи дају најбоље резултате у различитим околностима.[тражи се извор] Прва одлука, у вези са тачком уласка, је између трансхиијалне и трансторакалне процедуре. Новији трансхиијални приступ избегава потребу за отварањем грудног коша; уместо тога хирург улази у тело кроз рез у доњем делу стомака и други на врату. Доњи део једњака се ослобађа од околних ткива и по потреби сече. Желудац се затим гура кроз хијатус једњака (рупа где једњак пролази кроз дијафрагму) и спаја се са преосталим горњим делом једњака на врату.[29]
Традиционални трансторакални приступ улази у тело кроз грудни кош и има бројне варијације. Торакоабдоминални приступ отвара трбушну и торакалну шупљину заједно, двостепени приступ укључује иницијалну лапаротомију и изградњу гастричне сонде, након чега следи десна торакотомија да би се изрезао тумор и створио езофагогастрични отвор. Тростепени приступ додаје трећи рез на врату да би се завршила цервикална анастомоза. Недавни приступи неких хирурга користе оно што се назива проширена езофагектомија, где се више околног ткива, укључујући лимфне чворове, уклања у блоку.[29]
Ако особа уопште не може да прогута, може се уметнути стент за једњак да би једњак остао отворен; стентови такође могу помоћи у оклузији фистула. Назогастрична сонда може бити неопходна за наставак храњења док се лечи тумор, а неким пацијентима је потребна гастростома (отвор за храњење на кожи који омогућава директан приступ стомаку). Последња два су посебно важна ако пацијент има тенденцију да аспирира храну или пљувачку у дисајне путеве, предиспонирајући за аспирациону пнеумонију.
Хемотерапија и радиотерапија
[уреди | уреди извор]Хемотерапија зависи од типа тумора, али има тенденцију да буде заснована на цисплатину (или карбоплатину или оксалиплатину) сваке три недеље са флуороурацилом (5-ФУ) или континуирано или сваке три недеље.[32]
Радиотерапија се примењује пре, током или после хемотерапије или операције, а понекад и самостално за контролу симптома. Код пацијената са локализованом болешћу, али контраиндикацијама за операцију, радикална радиотерапија се може користити заједно са куративом.
Прогноза
[уреди | уреди извор]Болесници код који је у преоперативном статусу присутан коморбидитет,Komorbiditet[н. 1] и присуство или одсуство метастаза имају јаке предикторе лошег исхода лечења. Зато прогноза код раја једњака, пре свега карцинома, варира у зависности од фазе у којој се болест налази и клиничке слике.[17]
Укупна стопа преживљавања од пет година уочена је код 20-25% у свим фазама болести. Ако је код болесника присутна промена на лимфним чворовима прогноза је још слабија. Стопа преживљавања код оба типа карцинома је иста. Студија спроведена код 1.085 болесника који су подвргнути езофаготомији показала је да је стопа смртности 4% а стопа преживљавања 23%. Код болесника код којих је примењена преоперативна хеморадиотерапија, прогнозирано побољшање општег стања болести уочен је код 48% случајева.[2]
Напомене
[уреди | уреди извор]Извори
[уреди | уреди извор]- ^ а б Micev, M; Cosic-Micev, M (2010). „Pathology and pathobiology of the oesophageal carcinoma”. Acta Chirurgica Iugoslavica. 57 (2): 15—26. PMID 20954310. doi:10.2298/ACI1002015M.
- ^ а б в Dubecz, Attila; Gall, Isabell; Solymosi, Norbert; Schweigert, Michael; Peters, Jeffrey H.; Feith, Marcus; Stein, Hubert J. (2012). „Temporal Trends in Long-Term Survival and Cure Rates in Esophageal Cancer: A SEER Database Analysis”. Journal of Thoracic Oncology. 7 (2): 443—7. PMID 22173700. S2CID 38917824. doi:10.1097/JTO.0b013e3182397751..
- ^ а б Ku GY, Ilson DH. Cancer of the esophagus. In: Niederhuber JE, Armitage JO, Kastan MB, Doroshow JH, Tepper JE, eds. Abeloff's Clinical Oncology. 6th ed. Philadelphia, PA: Elsevier; 2020:chap 71.
- ^ а б в Nelson R. New Clinical Guidelines Issued for Esophageal Cancer. Medscape Medical News. medscape.com
- ^ а б в Богдановић, Драгослав. Анатомија грудног коша. Савремена администрација.
- ^ а б в Susan Standring, ур. (2009) [1858]. Gray's anatomy: The Anatomical Basis of Clinical Practice, Expert Consult. illustrated by Richard E. M. Moore (40 изд.). Churchill Livingstone. ISBN 978-0-443-06684-9.
- ^ Богдановић, Драгослав. Анатомија грудног коша. Савремена администрација.
- ^ Susan Standring, ур. (2009) [1858]. Gray's anatomy: The Anatomical Basis of Clinical Practice, Expert Consult. illustrated by Richard E. M. Moore (40 изд.). Churchill Livingstone. ISBN 978-0-443-06684-9.
- ^ „WHO Disease and injury country estimates”. World Health Organization. 2009. Приступљено 11. 11. 2009.
- ^ а б Whittemore, edited by David Schottenfeld, Joseph F. Fraumeni Jr.; associate editors, Graham A. Colditz, Jonathan M. Samet, Alice S. Cancer epidemiology and prevention. 2006. (3rd ed.). Oxford: Oxford University Press. p. 697.
- ^ Kachala R (септембар 2010). „Systematic review: epidemiology of oesophageal cancer in Sub-Saharan Africa”. Malawi Medical Journal. 22 (3): 65—70. PMC 3345777
 . PMID 21977849. doi:10.4314/mmj.v22i3.62190.
. PMID 21977849. doi:10.4314/mmj.v22i3.62190.
- ^ Blot, W. J.; Devesa, S. S.; Kneller, R. W.; Fraumeni Jr, J. F. (1991). „Rising incidence of adenocarcinoma of the esophagus and gastric cardia”. JAMA. 265 (10): 1287—1289. PMID 1995976. doi:10.1001/jama.1991.03460100089030..
- ^ а б Ribiero UJr; Posner, M. C.; Safatle-RibeiroAV; et al. (1996). „Risk factors for squamous cell carcinoma of the oesophagus.”. British Journal of Surgery. 83 (9): 1174—85. PMID 8983603.
- ^ „Ахалазија једњака”. Архивирано из оригинала 16. 12. 2007. г. Приступљено 21. 12. 2007.
- ^ „Кардиоспазам”. Архивирано из оригинала 2. 12. 2017. г. Приступљено 21. 12. 2007.
- ^ Fock KM, Poh CH. Gastroesophageal reflux disease. J Gastroenterol. 2010 Jun 29.
- ^ а б в van Baal JW; Milano, F; Rygiel, A. M.; Bergman JJ; Rosmolen, W. D.; van Deventer SJ; Wang, K. K.; Peppelenbosch, M. P.; Krishnadath KK. (2005). „A comparative analysis by SAGE of gene expression profiles of Barrett's esophagus, normal squamous esophagus, and gastric cardia.”. Gastroenterology. 129 (4): 1274—81. PMID 16230080. doi:10.1053/j.gastro.2005.07.026..
- ^ Cai L, You N-C Y, Lu H; et al. (2006). „Dietary selenium intake,aldehyde dehydrogenase-2 and x-ray repair crosscomplementing1 genetic polymorphisms and the risk ofesophageal squamous carcinoma”. Cancer. (106)..
- ^ Varghese TK Jr, Hofstetter WL, Rizk NP, Low DE, Darling GE, Watson TJ; et al. (јул 2013). „The society of thoracic surgeons guidelines on the diagnosis and staging of patients with esophageal cancer”. Ann Thorac Surg. 96 (1): 346—56. PMID 23752201. doi:10.1016/j.athoracsur.2013.02.069..
- ^ Mazzeo, S.; Caramella, D.; Gennai, A.; Giusti, P.; Neri, E.; Melai, L.; Cappelli, C.; Bertini, R.; Capria, A. (2003-10-28). „Multidetector CT and virtual endoscopy in the evaluation of the esophagus”. Abdominal Imaging. 29 (1). ISSN 0942-8925. doi:10.1007/s00261-003-0074-2.
- ^ Picus, D.; Balfe, D. M.; Koehler, R. E.; Roper, C. L.; Owen, J. W. (фебруар 1983). „Computed tomography in the staging of esophageal carcinoma”. Computed Tomography in the Staging of Esophageal Carcinoma. Radiology. 146 (2): 433—8. PMID 6849089. S2CID 41029136. doi:10.1148/radiology.146.2.6849089.
- ^ Räsänen, J. V.; Sihvo, E. I.; Knuuti, M. J.; Minn, H. R.; Luostarinen, M. E.; Laippala, P.; Viljanen, T.; Salo, J. A. (октобар 2003). „Prospective analysis of accuracy of positron emission tomography, computed tomography, and endoscopic ultrasonography in staging of adenocarcinoma of the esophagus and the esophagogastric junction”. Annals of Surgery Oncol. 10 (8): 954—60. PMID 14527917. S2CID 1290644. doi:10.1245/ASO.2003.12.002..
- ^ Massari, M.; Cioffi, U.; De Simone, M.; Lattuada, E.; Montorsi, M.; Segalin, A.; Bonavina, L. (април 1997). „Endoscopic ultrasonography for preoperative staging of esophageal carcinoma”. Surg Laparosc Endosc. 7 (2): 162—5. PMID 9109251..
- ^ Heidemann, J.; Schilling, M. K.; Schmassmann, A.; Maurer, C. A.; Büchler, M. W. (2000). „Accuracy of endoscopic ultrasonography in preoperative staging of esophageal carcinoma”. Dig Surg. 17 (3): 219—24. PMID 10867453. S2CID 26061023. doi:10.1159/000018838.
- ^ Tobias JS, Hochhauser D (2010). Cancer and its Management (6th изд.). John Wiley & Sons. стр. 257. ISBN 978-1-118-71325-9.
- ^ а б Pennathur, Arjun; Gibson, Michael K; Jobe, Blair A; Luketich, James D (2013). „Oesophageal carcinoma”. The Lancet. 381 (9864): 400—412. ISSN 0140-6736. doi:10.1016/s0140-6736(12)60643-6.
- ^ Fernández-Esparrach G, Calderón A, de la Peña J, Díaz Tasende JB, Esteban JM, Gimeno-García AZ, et al. (април 2014). „Endoscopic submucosal dissection”. Endoscopy. 46 (4): 361—370. PMID 24671864. doi:10.1055/s-0034-1364921
 .
.
- ^ Sun F, Yuan P, Chen T, Hu J (мај 2014). „Efficacy and complication of endoscopic submucosal dissection for superficial esophageal carcinoma: a systematic review and meta-analysis”. Journal of Cardiothoracic Surgery. 9: 78. PMC 4052291
 . PMID 24885614. doi:10.1186/1749-8090-9-78
. PMID 24885614. doi:10.1186/1749-8090-9-78  .
.
- ^ а б в Mendenhall WM, Werning JW, Pfister DG (2011). „Ch Chapter 72: Treatment of head and neck cancer”. Ур.: DeVita Jr VT, Lawrence TS, Rosenberg SA. DeVita, Hellman, and Rosenberg's Cancer: Cancer: Principles & Practice of Oncology (9th изд.). Philadelphia, Pa: Lippincott Williams & Wilkins. стр. 729—780. ISBN 978-1-4511-0545-2. Online edition, with updates to 2014
- ^ Berry MF (мај 2014). „Esophageal cancer: staging system and guidelines for staging and treatment”. Journal of Thoracic Disease. 6 (Suppl 3): S289—S297. PMC 4037413
 . PMID 24876933. doi:10.3978/j.issn.2072-1439.2014.03.11.
. PMID 24876933. doi:10.3978/j.issn.2072-1439.2014.03.11.
- ^ Parameswaran R, McNair A, Avery KN, Berrisford RG, Wajed SA, Sprangers MA, Blazeby JM (септембар 2008). „The role of health-related quality of life outcomes in clinical decision making in surgery for esophageal cancer: a systematic review”. Annals of Surgical Oncology. 15 (9): 2372—2379. PMID 18626719. S2CID 19933001. doi:10.1245/s10434-008-0042-8.
- ^ Ross P, Nicolson M, Cunningham D, Valle J, Seymour M, Harper P, et al. (април 2002). „Prospective randomized trial comparing mitomycin, cisplatin, and protracted venous-infusion fluorouracil (PVI 5-FU) With epirubicin, cisplatin, and PVI 5-FU in advanced esophagogastric cancer”. Journal of Clinical Oncology. 20 (8): 1996—2004. PMID 11956258. doi:10.1200/JCO.2002.08.105.
Литература
[уреди | уреди извор]- Богдановић, Драгослав. Анатомија грудног коша. Савремена администрација.
- Minimally invasive oesophagectomy for cancer or high-grade dysplasia of the oesophagus; NICE Interventional Procedure Guideline, September 2011
- Hanna, W.C.; Sudarshan, M.; Roberge, D.; David, M.; Waschke, K.A.; Mayrand, S.; Alcindor, T.; Ferri, L.E. (2012). „What is the Optimal Management of Dysphagia in Metastatic Esophageal Cancer?”. Current Oncology. 19 (2): 60—66. PMC 3320233
 . PMID 22514498. doi:10.3747/co.19.892..
. PMID 22514498. doi:10.3747/co.19.892.. - Trastuzumab for the treatment of HER2-positive metastatic gastric cancer; NICE Technology Appraisal Guideline, November 2010
Спољашње везе
[уреди | уреди извор]| Класификација | |
|---|---|
| Спољашњи ресурси |
- Карцином једњака — www. patient.info (језик: енглески)
 | Молимо Вас, обратите пажњу на важно упозорење у вези са темама из области медицине (здравља). |
Грешка код цитирања: Постоје ознаке <ref> за групу с именом „н.“, али нема одговарајуће ознаке <references group="н."/>