Ванадат

У хемији, ванадат је једињење које садржи оксоањон ванадијума генерално у свом највишем оксидативном стању од +5. Најједноставнији ванадатни јон је тетраедрални, ортованадат, ВО3−
4 ањон, који је присутан у е.г. натријум ортованадату и растворима V2О5 у јакој бази (пХ > 13 [1]). Конвенционално овој јон је представљан са једном двоструком везом, међутим то је резонантна форм пошто је јон регуларни тетраедрон са четири еквивалентна атома кисеоника.
Осим тога постоји опсег полиоксованадатних јона који обухватају дискретне јоне и "инфинитне" полимерне јоне.[2] Такође постоје ванадати, као што је родијум ванадат, РхВО4, који имају статистичку рутилну структуру где Рх3+ и V5+ јони рандомно заузимају Ти4+ позиције у рутилној решетци,[3] која није решетка катијона и балансирајућих ванадатних ањона, него мешовити оксид.
У хемијској номенклатури кад ванадат формира део имена, то означава да једињење садржи ањон са централним атомом ванадијума, е.г. амонијум хексафлуорованадат је тривијално име за једињење (НХ4)3ВФ6 Са ИУПАЦ именом амонијум хексафлуоридованадат(III).
Примери ванадатних јона[уреди | уреди извор]
Примери јона су:
- ВО3−
4 "ортованадат", тетраедралан.[2] - V
2О4−
7 "пированадат", ВО4 тетраедри са заједничким угловима, слично дихроматном јону[2] - V
3О3−
9, цикличан са ВО4 тетраедрима са заједничким угловима[4] - V
4О4−
12, цикличан са ВО4 тетраедрима са заједничким угловима[5] - V
5О3−
14, ВО4 тетраедри са заједничким угловима[6] - V
10О6−
28 "декаванадат", ВО6 октаедар са заједничким уголвима и ивицама [2] - V
12О4−
32[2] - V
13О3−
34, спојени ВО6 октаедар [7] - V
18О12−
42[8]
Примери полимерних “инфинитних” јона су
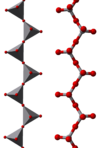 |
 |
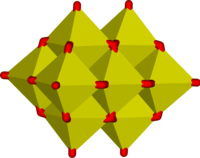 |
У овим јонима ванадијум испољава тетраедралну, квадратно пирамидалну и октахедралну координацију. У том погледу ванадијум је сличан са волфраматом и молибдатом, док хром има ограниченији опсег јона.
Водени раствори[уреди | уреди извор]
Растварањем ванадијум пентоксида у јако базном воденом раствору се формира безбојни ВО3−
4 јон. Закишељавањем овај раствор постепено постаје тамнији уз промену боје до нараџасте и црвене око пХ 7. Смеђи хидратисани V2О5 преципитира око пХ 2, поновним растварањем се формира светло жути раствор који садржи [ВО2(Х2О)4]+ јон. Број и идентитет оксиањона који постоје између пХ 13 и 2 зависи од пХ као и концентрације. На пример, протонација ванадата иницира серију кондензација, чиме се формирају полиоксованадатни јони:[2]
- пХ 9–12; ХВО2−
4, V
2О4−
7 - пХ 4–9; Х
2ВО−
4, V
4О4−
12, ХВ
10О5−
28 - пХ 2–4; Х3ВО4, Х
2V
10О4−
28
Фармаколошка својства[уреди | уреди извор]
Ванадат је потентан инхибитор АТПаза ћелијске мембране, као што је На+/К+-АТПаза и Ца2+-АТПаза (ПМЦА). Међутим, он не инхибира друге АТПазе, као што су СЕРЦА (Ца2+-АТПаза сарко/ендопласмичног ретикулума), актомиозинска АТПаза и митохондријска АТПаза.[10][11][12]
Референце[уреди | уреди извор]
- ^ Цоттон Ф. Алберт; Wилкинсон Геоффреy; Мурилло Царлос А; Боцхманн, Манфред (1999). Адванцед Инорганиц Цхемистрy (6тх изд.). Неw Yорк: Wилеy-Интерсциенце. ИСБН 0-471-19957-5.
- ^ а б в г д ђ е Греенwоод, Норман Н.; Еарнсхаw, Алан (1997). Цхемистрy оф тхе Елементс (II изд.). Оxфорд: Буттерwортх-Хеинеманн. ИСБН 0080379419.
- ^ Wеллс А.Ф. (1984) Струцтурал Инорганиц Цхемистрy 5тх едитион Оxфорд Сциенце Публицатионс ISBN 0-19-855370-6
- ^ Hamilton E. E.; Fanwick P.E.; Wilker J.J. (2002). „The Elusive Vanadate (V3O9)3−: Isolation, Crystal Structure, and Nonaqueous Solution Behavior”. J. Am. Chem. Soc. 124 (1): 78. doi:10.1021/ja010820r.
- ^ G.-Y. Yang; D.-W. Gao; Y. Chen; J.-Q. Xu; Q.-X. Zeng; H.-R. Sun; Z.-W. Pei; Q. Su, Y. Xing; Y.-H. Ling; H.-Q. Jia (1998). „[Ni(C10H8N2)3]2[V4O12]·11H2O”. Acta Crystallographica C. 54 (5): 616. doi:10.1107/S0108270197018751.
- ^ V. W. Day; Walter G. Klemperer; O. M. Yaghi (1989). „A new structure type in polyoxoanion chemistry: synthesis and structure of the V
5O3−
14 anion”. J. Am. Chem. Soc. 111 (12): 4518. doi:10.1021/ja00194a068. - ^ Hou D.; Hagen K.D.; Hill C.L. (1992). „Tridecavanadate, [V13O34]3−, a new high-potential isopolyvanadate”. J. Am. Chem. Soc. 114 (14): 5864. doi:10.1021/ja00040a061.
- ^ Müller A.; Sessoli R.; Krickemeyer E.; Bögge H.; Meyer J.; Gatteschi D.; Pardi L.; Westphal J.; Hovemeier K.; Rohlfing R.; Döring J; Hellweg F.; Beugholt C.; Schmidtmann M. (1997). „Polyoxovanadates: High-Nuclearity Spin Clusters with Interesting Host-Guest Systems and Different Electron Populations. Synthesis, Spin Organization, Magnetochemistry, and Spectroscopic Studies”. Inorg. Chem. 36 (23): 5239. doi:10.1021/ic9703641.
- ^ Jouanneau, S.; Verbaere, A.; Guyomard, D. (2003). „On a new calcium vanadate: synthesis, structure and Li insertion behaviour”. Journal of Solid State Chemistry. 172: 116. Bibcode:2003JSSCh.172..116J. doi:10.1016/S0022-4596(02)00164-0.
- ^ Luo D.; Nakazawa M.; Yoshida Y.; Cai J.; Imai S. (2000). „Effects of three different Ca2+ pump ATPase inhibitors on evoked contractions in rabbit aorta and activities of Ca2+ pump ATPases in porcine aorta”. General Pharmacology: The Vascular System. 34 (3): 211—220. doi:10.1016/S0306-3623(00)00064-1.
- ^ Bowman B.J.; Slayman C.W. (1979). „The Effects of Vanadate on the Plasma Membrane ATPase of Neurospora crassa”. Journal of Biological Chemistry. 254 (8): 2928—2934. PMID 155060.
- ^ Aureliano, Manuel; Crans, Debbie C. (2009). "Decavanadate and oxovanadates: Oxometalates with many biological activities". Journal Inorganic Biochemistry 103: 536–546. doi:10.1016/j.jinorgbio.2008.11010.
