Benzaldehid
| |||
| Nazivi | |||
|---|---|---|---|
| Drugi nazivi
Fenilmetanal
Benzenkarboksaldehid Benzoinski aldehid | |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.002.601 | ||
| KEGG[1] | |||
| UNII | |||
| |||
| Svojstva | |||
| C7H6O | |||
| Molarna masa | 106,12 g·mol−1 | ||
| Agregatno stanje | bezbojna tečnost | ||
| Gustina | 1,0415 g/ml, tečnost | ||
| Tačka topljenja | −26°C | ||
| Tačka ključanja | 178.1°C | ||
| 0.6 g/100 ml (20°C) | |||
| Viskoznost | 1.4 cP (25°C) | ||
| Termohemija | |||
Std entalpija
formiranja (ΔfH⦵298) |
−36.8 kJ/mol | ||
| Std entalpija sagorevanja ΔcH |
−3525.1 kJ/mol | ||
| Opasnosti | |||
| Bezbednost prilikom rukovanja | J. T. Baker | ||
EU klasifikacija (DSD)
|
Štetan (Xn) | ||
| R-oznake | R22 | ||
| S-oznake | (S2), S24 | ||
| NFPA 704 | |||
| Tačka paljenja | 63°C | ||
| Srodna jedinjenja | |||
Srodna jedinjenja
|
Benzil alkohol Benzojeva kiselina | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
Benzaldehid (C6H5CHO) je organsko jedinjenje koje se sastoji od benzenskog prstena sa formil supstituentom. On je najjednostavniji aromatični aldehid i jedan od najkorisnijih u pogledu industrijske primene. Ova bezbojna tečnost ima karakterističan prijatan bademu sličan miris. Benzaldehid je primarna komponenta gorkog bademovog ulja i može se ekstrahovati iz brojnih drugih prirodnih izvora.[4]
Proizvodnja
[uredi | uredi izvor]Benzaldehid se moše dobiti na više načina. Procenjuje se da je tokom 1980-thi 18 miliona kilograma proizvedeno godišnje u Japanu, Evropi, i Severnoj Americi, i očekuje se da će se taj nivo proizvodenje nastaviti. Trenutno su hlorinacija u tečnoj fazi i oksidacija toluena glavni načini dobijanja. Brojne druge metode su bile razvijene, kao što je parcijalna oksidacija benzil alkohola, alkalna hidroliza benzal hlorida, i karbonilacija benzena.[5]
Reakcije
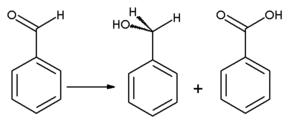
[uredi | uredi izvor]Oksidacijom se benzaldehid konvertuje u bezmirisnu benzojevu kiselinu, koja je česta nečistoća u laboratorijskim uzorcima. Benzil alkohol se može formirati iz benzaldehida hidrogenacijom. Reakcija benzaldehida sa bezvodnim natrijum acetatom i acetatnim anhidridom proizvodi cinaminsku kiselinu, dok se alkoholni kalijum cijanid može koristiti za katalizu kondenzacije benzaldehida u benzoin. Benzaldehid podleže disproporcionaciji pri tretmanu sa koncentrovanim alkalijama (Kanizarova reakcija): jedan molekul aldehida se redukuje u korespondirajući alkohol, a drugi molekul se istovremeno oksiduje u natrijum benzoat.
Upotreba
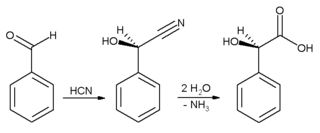
[uredi | uredi izvor]On se često koristi za davanje bademovog ukusa. Benzaldehid se koristi prvenstveno kao prekurzor za druga organska jedinjenje, od lekova do plastičnih aditiva. Anilinska boja malahitno zeleno se priprema iz benzaldehid i dimetilanilina. On je takođe prekurzor pojedinih akridinskih boja. Putem aldolne kondenzacije, benzaldehid se konvertuje u derivate cinamaldehida i stirena. Sinteza mandelinske kiseline počinje od benzaldehida:
Prvo se doda hidrocijanatna kiselina benzaldehidu, i rezultujući nitril se naknadno hidrolizuje do mandelinske kiseline. Gornja reakcija prikazuje samo jedan od dva formirana enantiomera.
Референце
[uredi | uredi izvor]- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ „United States Patent 1416128 - Process of treating nut kernels to produce food ingredients.” (PDF).
- ^ Friedrich Brühne and Elaine Wright “Benzaldehyde” in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. . doi:10.1002/14356007.a03_463. Недостаје или је празан параметар
|title=(помоћ)