Хемијска реакција


Хемијске реакције представљају трајне промене у структури полазних супстанци (реактаната или реагујућих супстанци) и настајање нових супстанци (производа) које се по саставу и својствима разликују од полазних супстанци.[1][2][3][4] Класично, хемијске реакције обухватају промене које укључују само положај електрона у формирању и прекиду хемијских веза између атома, без промене језгара (без промене присутних елемената), а често се могу описати хемијском једначином. Нуклеарна хемија је поддисциплина хемије која укључује хемијске реакције нестабилних и радиоактивних елемената где се могу јавити и електронске и нуклеарне промене.
Супстанце које су у почетку укључене у хемијску реакцију називају се реактанти или реагенси. Хемијске реакције обично карактеришу хемијске промене, а оне дају један или више производа, који обично имају својства различита од реактаната. Реакције се често састоје од низа појединачних поткорака, такозваних елементарних реакција, а информације о тачном току деловања део су механизма реакције. Хемијске реакције су описане хемијским једначинама, које симболично представљају почетне материјале, крајње производе, а понекад и међупроизводе и реакционе услове.
Хемијске реакције се дешавају карактеристичном брзином реакције при датој температури и хемијској концентрацији. Типично, брзине реакције се повећавају са порастом температуре јер је на располагању више топлотне енергије да би се постигла енергија активације неопходна за прекидање веза између атома.
Реакције се могу одвијати ка унапред или уназад, све док се не окончају или постигну равнотежу. Реакције које се настављају у правцу према напред да би се приближиле равнотежи често се описују као спонтане и не захтевају унос слободне енергије да би се одвијале. Неспонтане реакције захтевају унос слободне енергије да би одвијале (примери укључују пуњење батерије применом спољног извора електричне енергије, или фотосинтезу вођену апсорпцијом електромагнетног зрачења у облику сунчеве светлости).
Реакција се може класификовати као редокс кад у њој долази до оксидације и редукције, и супротно ако нема оксидације и редукције. Већина једноставних редокс реакција може се класификовати као реакција комбинације, разградње или појединачног померања.
Током хемијске синтезе користе се различите хемијске реакције да би се добио жељени производ. У биохемији узастопни низ хемијских реакција (где је производ једне реакције реактант следеће реакције) формира метаболичке путеве. Ове реакције често катализују протеински ензими. Ензими повећавају стопе биохемијских реакција, тако да су метаболичке синтезе и разградње које су немогуће у уобичајеним условима, могу појавити на температурама и концентрацијама присутним у ћелији.
Општи концепт хемијске реакције проширен је на реакције између ентитета мањих од атома, укључујући нуклеарне реакције, радиоактивне распаде и реакције између елементарних честица, како је описано квантном теоријом поља.
Историја
[уреди | уреди извор]
Хемијске реакције попут сагоревања у ватри, ферментације и редукције руда до метала биле су познате још у антици. Почетне теорије о трансформацији материјала развили су грчки филозофи, као што је Теорија четири елемента Емпедокла, наводећи да је било која супстанца састављена од четири основна елемента - ватре, воде, ваздуха и земље. У средњем веку хемијске трансформације проучавали су алхемичари. Они су нарочито покушали да олово претворе у злато, за шта су користили реакције олова и легура олова и бакра са сумпором.[5]
Вештачка производња хемијских супстанци већ је била централни циљ средњовековних алхемичара.[6] Примери укључују синтезу амонијум хлорида из органских супстанци како је описано у делима (око 850–950) који се приписују Џабир ибн Хајану,[7] или производњи минералних киселина попут сумпорне и азотне киселине од каснијих алхемичара, почев од око 1300.[8] Производња минералних киселина подразумевала је загревање сулфатних и нитратних минерала као што су бакар сулфат, стипса и шалитра. У 17. веку Јохан Рудолф Глаубер је производио хлороводоничну киселину и натријум сулфат реакцијом сумпорне киселине и натријум хлорида. Развојем процеса оловне коморе 1746. и Леблановог процеса, омогућавајући велику производњу сумпорне киселине и натријум карбоната, хемијске реакције су уведене у индустрију. Даља оптимизација технологије сумпорне киселине резултирала је контактним процесом 1880-их,[9] а Хаберов процес је развијен 1909–1910 за синтезу амонијака.[10]
Од 16. века истраживачи, међу којима су Жан Баптиста ван Хелмонт, Роберт Бојл и Исак Њутн, покушавали су да успоставе теорије експериментално посматраних хемијских трансформација. Флогистонску теорију предложио је 1667. године Јохан Јоахим Бехер. Њом је претпостављено постојање елемента сличног ватри названог „флогистон“, који се налазио у запаљивим телима и ослобађао током сагоревања. То се показало погрешним, што је 1785. године доказао Антоан Лавоазје који је пронашао тачно објашњење сагоревања као реакције са кисеоником из ваздуха.[11]
Жозеф Луј Ге-Лисак је препознао 1808. да гасови увек реагују у одређеном међусобном односу. На основу ове идеје и атомске теорије Џона Далтона и Жозефа Пруста је развио закон сталних односа маса, што је касније резултирало концептима стехиометрије и хемијских једначина.[12]
Подела хемијских реакција
[уреди | уреди извор]Хемијске реакције се деле у три групе и то:
- Оксидо-редукционе реакције
- Комплексне реакције (мења се координациони број), које се деле на три подргупе:
- комплексне реакције у ужем смислу
- протолитичке реакције
- реакције преципитације и растварања
- Хемијске реакције при којима долази до дисоцијације и асоцијације молекула, атома и јона.
Најпознатији типови реакција
[уреди | уреди извор]- Реакције синтезе су хемијске реакције при којима из атома и молекула различитих супстанци настају молекули нових супстанци, опште једначине:
- А+Б=АБ
- Реакције анализе су хемијске реакције при којима се молекули једне супстанце разлажу на атоме или молекуле других супстанци, опште једначине:
- АБ-А+Б
- Реакције просте измене су просте хемијске реакције у којима атоми просте супстанце замењују атоме елемената у молекулима сложене супстанце, опште једначине::
- АБ+Ц=АЦ+Б
- Реакције двоструких измена су хемијске реакције у којима молекули различитих супстанци реагују, а као производ реакције добијају се нове сложене супстанце.
- Реакције супституције су хемијске реакције у којима се један атом у молекулу замењује другим атомом.
- Реакције адиције су хемијске реакције код којих се врши везивање молекула једне супстанце на молекул друге супстанце.
- Реакције полимеризације су хемијске реакције карактеристичне за незасићена једињења, при којима долази до изградње великих молекула који се састоје из неколико полазних молекула.
Енергетске промене у хемијским реакцијама
[уреди | уреди извор]Хемијске реакције одигравају се са променом супстанци и са одређеним топлотним ефектом, при чему се ослобађа енергија или троши (везује или отпушта). Уколико се приликом реакције троши или ослобађа топлота онда се говори о термохемијским реакцијама. Количина топлоте која се у току хемијске реакције ослобађа или везује назива се топлота реакције.
Хемијске реакције које се одигравају ослобађањем топлоте називају се егзотермне реакције. Хемијске реакције које се одигравају са везивањем топлоте називају се ендотермне реакције. Ако је хемијска реакција у једном смеру ендотермна у другом је егзотермна и обрнуто.
Једначине
[уреди | уреди извор]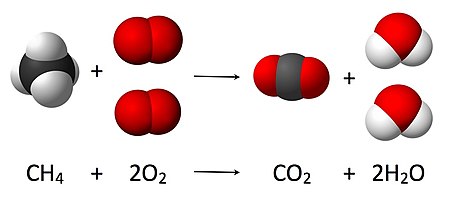
4 + 2O
2 → CO
2 + 2 H
2O, коефицијент 2 мора се ставити испред гаса кисеоника на страни реактаната и испред воде на страни производа, како се према закону одржања масе, количина сваког елемента не би променила током реакције
Хемијске једначине се користе за графичку илустрацију хемијских реакција. Оне се састоје од хемијских или структурних формула реактаната са леве стране и производа са десне стране. Раздвојени су стрелицом (→) која означава смер и врсту реакције; стрелица се чита као реч „даје“.[13] Врх стрелице показује смер у коме се реакција одвија. Двострука стрелица (⇌) која показује у супротним смеровима се користи за равнотежне реакције. Једначине треба да буду избалансиране према стехиометрији, број атома сваке врсте треба да буде исти на обе стране једначине. Ово се постиже скалирањем броја укључених молекула (A, B, C и D у шематском примеру испод) одговарајућим целим бројевима a, b, c и d.[14]
- a A + b B → c C + d D
Сложеније реакције су представљене реакционим шемама, које поред полазних материјала и производа показују важне интермедијере или прелазна стања. Такође, неки релативно мањи додаци реакцији могу бити назначени изнад стрелице реакције; примери таквих додатака су вода, топлота, осветљење, катализатор, итд. Слично, неки мањи производи се могу ставити испод стрелице, често са знаком минус.
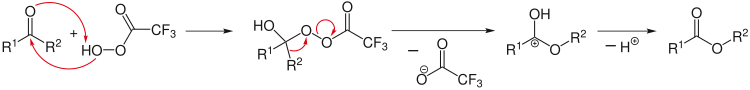
Ретросинтетичка анализа се може применити за дизајнирање сложене реакције синтезе. Овде анализа почиње од производа, на пример цепањем одабраних хемијских веза, да би се дошло до могућих почетних реагенаса. У ретро реакцијама се користи посебна стрелица (⇒).[15]
Елементарне реакције
[уреди | уреди извор]Елементарна реакција је најмања подела на коју се хемијска реакција може разложити. Она нема међупроизвода.[16] Већина експериментално посматраних реакција је изграђена од многих елементарних реакција које се дешавају паралелно или секвенционо. Стварни редослед појединачних елементарних реакција познат је као реакциони механизам. Елементарна реакција укључује неколико молекула, обично један или два, због мале вероватноће да се неколико молекула сретне у датом тренутку.[17]

Најважније елементарне реакције су унимолекуларне и бимолекуларне реакције. Само један молекул је укључен у унимолекуларну реакцију; трансформише се изомеризацијом или дисоцијацијом у један или више других молекула. Такве реакције захтевају додавање енергије у облику топлоте или светлости. Типичан пример унимолекуларне реакције је цис-транс изомеризација, у којој се цис-форма једињења претвара у транс-форму или обрнуто.[18]
У типичној реакцији дисоцијације, веза у молекулу се цепа (пуца) што доводи до два молекуларна фрагмента. Цепање може бити хомолитичко или хетеролитичко. У првом случају, веза се дели тако да сваки производ задржава електрон и постаје неутрални радикал. У другом случају, оба електрона хемијске везе остају са једним од производа, што резултира наелектрисаним јонима. Дисоцијација игра важну улогу у покретању ланчаних реакција, као што су водоник-кисеоник или реакције полимеризације.
- Dissociation of a molecule AB into fragments A and B
У бимолекуларним реакцијама, два молекула се сударају и реагују један са другим. Њихово спајање се назива хемијска синтеза или реакција адиције.
Друга могућност је да се само део једног молекула преноси на други молекул. Ова врста реакције се јавља, на пример, у редокс и кисело-базним реакцијама. У редокс реакцијама, пренесена честица је електрон, док је у кисело-базним реакцијама протон. Ова врста реакције се такође назива метатеза.
на пример
Хемијска равнотежа
[уреди | уреди извор]Већина хемијских реакција је реверзибилна; односно могу и теку у оба смера. Директна и реверзна реакција се такмиче једна са другом и разликују се по брзинама реакције. Ове брзине зависе од концентрације и стога се мењају са временом реакције: реверзна брзина се постепено повећава и постаје једнака брзини прве реакције, успостављајући хемијску равнотежу. Време за постизање равнотеже зависи од параметара као што су температура, притисак и укључени материјали, а одређено је минималном слободном енергијом. У равнотежи, Гибсова слободна енергија мора бити нула. Зависност од притиска може се објаснити Ле Шатељеовим принципом. На пример, повећање притиска услед смањења запремине узрокује да се реакција помери на страну са мање молова гаса.[19]
Реакциони принос се стабилизује у равнотежи, али се може повећати уклањањем производа из реакционе смеше или променити повећањем температуре или притиска. Промена концентрација реактаната не утиче на константу равнотеже, али утиче на положај равнотеже.
Термодинамика
[уреди | уреди извор]Хемијске реакције су одређене законима термодинамике. Реакције се могу одвијати саме од себе ако су ексергонске, односно ако ослобађају слободну енергију. Повезана промена слободне енергије реакције се састоји од промена две различите термодинамичке величине, енталпије и ентропије:[20]
- .
- G: слободна енергија, H: енталпија, T: температура, S: ентропија, Δ: разлика (промена између реактаната и производа)
Реакције могу бити егзотермне, где је ΔH негативно и енергија се ослобађа. Типични примери егзотермних реакција су сагоревање, таложење и кристализација, у којима се уређене чврсте материје формирају из неуређених гасовитих или течних фаза. Насупрот томе, у ендотермним реакцијама, топлота се узима из околине. Ово се може десити повећањем ентропије система, често кроз формирање гасовитих или растворених реакционих производа, који имају већу ентропију. Пошто се ентропијски члан у промени слободне енергије повећава са температуром, многе ендотермне реакције се пожељно одвијају на високим температурама. Насупрот томе, многе егзотермне реакције као што је кристализација се пожељно дешавају на нижим температурама. Промена температуре понекад може да обрне знак енталпије реакције, као што је угљен моноксидна редукција молибден диоксида:
- ;
Ова реакција стварања угљен-диоксида и молибдена је ендотермна на ниским температурама, а са повећањем температуре постаје све мања.[21] ΔH° је нула на 1855 K, а реакција постаје егзотермна изнад те температуре.
Промене температуре такође могу да обрну тенденцију правца реакције. На пример, реакцију промене воденог гаса
фаворизују ниске температуре, али њену реверзну реакцију фаворизују високе температуре. Промене смера реакције се дешава на 1100 K.[21]
Реакције се такође могу окарактерисати њиховом променом унутрашње енергије, која узима у обзир промене ентропије, запремине и хемијских потенцијала. Ово последње зависи, између осталог, од активности укључених супстанци.[22]
- U: унутрашња енергија, S: ентропија, p: притисак, μ: хемијски потенцијалl, n: број молекула, d: ознака мале промене
Види још
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ IUPAC. „chemical reaction”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II изд.). Oxford: Butterworth-Heinemann. ISBN 0080379419.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ Weyer, J. (1973). „Neuere Interpretationsmöglichkeiten der Alchemie”. Chemie in Unserer Zeit. 7 (6): 177—181. doi:10.1002/ciuz.19730070604.
- ^ See Newman, William R. (2004). Promethean Ambitions: Alchemy and the Quest to Perfect Nature. Chicago: University of Chicago Press. ISBN 9780226575247.
- ^ Kraus, Paul (1942—1943). Jâbir ibn Hayyân: Contribution à l'histoire des idées scientifiques dans l'Islam. I. Le corpus des écrits jâbiriens. II. Jâbir et la science grecque. Cairo: Institut Français d'Archéologie Orientale. ISBN 9783487091150. OCLC 468740510., vol. II, pp. 41–42.
- ^ Karpenko, Vladimír; Norris, John A. (2002). „Vitriol in the History of Chemistry”. Chemické listy. 96 (12): 997—1005.
- ^ Friedman, Leonard J.; Friedman, Samantha J. (2008). The History of the Contact Sulfuric Acid Process (PDF). Boca Raton, Florida: Acid Engineering & Consulting, Inc.
- ^ Stranges, Anthony N. (2000). „Germany's synthetic fuel industry, 1935–1940”. Ур.: Lesch, John E. The German Chemical Industry in the Twentieth Century. Kluwer Academic Publishers. стр. 170. ISBN 978-0-7923-6487-0.
- ^ Brock 1997, стр. 34–55
- ^ Brock 1997, стр. 104–107
- ^ Myers, Richard (2009). The Basics of Chemistry. Greenwood Publishing Group. стр. 55. ISBN 978-0-313-31664-7.
- ^ IUPAC. „chemical reaction equation”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Corey, E.J. (1988). „Robert Robinson Lecture. Retrosynthetic thinking?essentials and examples”. Chemical Society Reviews. 17: 111—133. doi:10.1039/CS9881700111.
- ^ IUPAC. „elementary reaction”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Frenking, Gernot (2006). „Elementarreaktionen”. Römpp Chemie-Lexikon. Thieme.
- ^ Kandori, Hideki (2006). „Retinal Binding Proteins”. Ур.: Dugave, Christophe. Cis-trans Isomerization in Biochemistry. Wiley-VCH. стр. 56. ISBN 978-3-527-31304-4.
- ^ Atkins, p. 114.
- ^ Atkins, стр. 106–108
- ^ а б „F*A*C*T - REACTION-Web”. www.crct.polymtl.ca.
- ^ Atkins, стр. 150
Литература
[уреди | уреди извор]- Atkins, Peter W.; Julio de Paula (2006). Physical Chemistry (4th изд.). Weinheim: Wiley-VCH. ISBN 978-3-527-31546-8.
- Brock, William H. (1997). Viewegs Geschichte der Chemie (на језику: немачки). Braunschweig: Vieweg. ISBN 978-3-540-67033-9.
- Brückner, Reinhard (2004). Reaktionsmechanismen (на језику: немачки) (3rd изд.). München: Spektrum Akademischer Verlag. ISBN 978-3-8274-1579-0.
- Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic chemistry. Academic Press. ISBN 978-0-12-352651-9.
- „Chemical Action”. Encyclopædia Britannica (на језику: енглески). 6 (11 изд.). 1911. стр. 26—33.
- Fox, Jeffrey L. (1. 1. 1979). „Antibody reagents revolutionizing immunology”. Chemical & Engineering News Archive. стр. 15—17. doi:10.1021/cen-v057n001.p015.
- Ishino, S; Ishino, Y (29. 8. 2014). „DNA polymerases as useful reagents for biotechnology: the history of developmental research in the field”. Frontiers in Microbiology. 5: 465. PMC 4148896
 . PMID 25221550. doi:10.3389/fmicb.2014.00465.
. PMID 25221550. doi:10.3389/fmicb.2014.00465. - Kenakin, T; Bylund, DB; Toews, ML; Mullane, K; Winquist, RJ; Williams, M (1. 1. 2014). „Replicated, replicable and relevant-target engagement and pharmacological experimentation in the 21st century”. Biochemical Pharmacology. 87 (1): 64—77. PMID 24269285. doi:10.1016/j.bcp.2013.10.024.
- Lindsley, CW (25. 9. 2014). „2013 Philip S. Portoghese Medicinal Chemistry Lectureship: drug discovery targeting allosteric sites”. Journal of Medicinal Chemistry. 57 (18): 7485—7498. PMC 4174999
 . PMID 25180768. doi:10.1021/jm5011786.
. PMID 25180768. doi:10.1021/jm5011786. - Baker, Monya (9. 1. 2017). „Deceptive curcumin offers cautionary tale for chemists”. Nature. 541 (7636): 144—145. Bibcode:2017Natur.541..144B. PMID 28079090. doi:10.1038/541144a
 .
. - Dahlin, JL; Walters, MA (јул 2014). „The essential roles of chemistry in high-throughput screening triage”. Future Medicinal Chemistry. 6 (11): 1265—1290. PMC 4465542
 . PMID 25163000. doi:10.4155/fmc.14.60.
. PMID 25163000. doi:10.4155/fmc.14.60. - Baell, JB; Holloway, GA (8. 4. 2010). „New substructure filters for removal of pan assay interference compounds (PAINS) from screening libraries and for their exclusion in bioassays.”. Journal of Medicinal Chemistry. 53 (7): 2719—2740. CiteSeerX 10.1.1.394.9155
 . PMID 20131845. doi:10.1021/jm901137j.
. PMID 20131845. doi:10.1021/jm901137j. - Detavernier, Christophe; Dendooven, Jolien; Sree, Sreeprasanth Pulinthanathu; Ludwig, Karl F.; Martens, Johan A. (2011-10-17). „Tailoring nanoporous materials by atomic layer deposition”. Chemical Society Reviews. 40 (11): 5242—5253. ISSN 1460-4744. PMID 21695333. doi:10.1039/C1CS15091J.
- Xie, Qi; Deng, Shaoren; Schaekers, Marc; Lin, Dennis; Caymax, Matty; Delabie, Annelies; Qu, Xin-Ping; Jiang, Yu-Long; Deduytsche, Davy; Detavernier, Christophe (2012-06-22). „Germanium surface passivation and atomic layer deposition of high-kdielectrics—a tutorial review on Ge-based MOS capacitors”. Semiconductor Science and Technology. 27 (7): 074012. ISSN 0268-1242. doi:10.1088/0268-1242/27/7/074012.
Спољашње везе
[уреди | уреди извор]- „Substrates for AFM, STM”. www.emsdiasum.com. Приступљено 2019-12-01.
- „Report of the National Institutes of Health (NIH) Working Group on Research Tools”. NIH. 4. 6. 1998. Архивирано из оригинала 16. 8. 2000. г.









