Dihloroacetilen

| |
 Dihloroacetilen
(sa Tetrahloroetilenom kao stabilizatorom) | |
| Називи | |
|---|---|
| IUPAC назив
Dihloroacetilen
| |
| Други називи
DCA, dihloroacetilen
| |
| Идентификација | |
3Д модел (Jmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.149.197 |
| RTECS | AP1080000 |
| UNII | |
| |
| |
| Својства | |
| C2Cl2 | |
| Моларна маса | 94,927[3] |
| Агрегатно стање | bezbojna uljasta tečnost [3] |
| Мирис | neprijatan, sladak |
| Густина | 1,26 g/cm3 |
| Тачка топљења | −66 to −64 °C (−87 to −83 °F; 207 to 209 K) |
| Тачка кључања | 33 °C (91 °F; 306 K) eksplodira |
| nerastvorljiv | |
| Растворљивост | rastvorljiv u acetonu, etanolu, etru |
| Опасности | |
| Главне опасности | eksplozivno, potencijalno kancerogeno [3] |
| Границе изложености здравља у САД (NIOSH): | |
PEL (дозвољено)
|
ništa [3] |
REL (препоручено)
|
Ca C 0.1 ppm (0.4 mg/m3)[3] |
IDLH (тренутна опасност)
|
Ca (N.D.)[3] |
| Сродна једињења | |
Други анјони
|
Acetilen, Dibromoacetilen, Difluoroacetilen, Dijodoacetilen |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |
Dihloroacetilen (DCA) je organohlorno jedinjenje hlora i ugljenika, sa formulom C2Cl2.[4] To je bezbojna, eksplozivna tečnost koja ima sladak i „neprijatan“ miris. [5]
Istorija[уреди | уреди извор]
Ovo jedinjenje se prvi put pominje 1918. godine tokom sinteze tolana sa početnim materijalima kalcijum karbida, hlora i benzola. [6] Prvi preparati iz proizvodnje su opisani 1930. godine sa jedne strane od trihloroetilena u prisustvu kalijum hidroksida i kalcijum oksida na130 °C (266 °F; 403 K) [7] i sa druge strane od etina i hlora. [8]
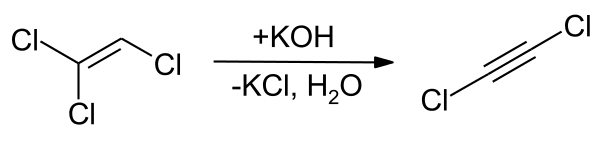
Ekstrakcija i prezentacija[уреди | уреди извор]
Veliki broj varijanti predstavljanja dihloroacetilena bazira se na dejstvu hidroksida alkalnih metala ili alkalnih lužina na trihloroetilen. [9] Dehidrohalogenizacija trihloroetilena je takođe moguća korišćenjem litijum bis(trimetilsilil)amida na −70 °C (−94 °F; 203 K) Ova sinteza u prisustvu dietil etra rezultira stabilnijim 1:1 aduktom. [10] Proizvodnja visokog prinosa može se postići reakcijom trihloroetilena sa kalijum hidridom u prisustvu katalitičke količine metanola u tetrahidrofuranu. [11] Direktno hlorisanje etina se postiže korišćenjem kalijum hipohlorita. [12]

Proizvodnja[уреди | уреди извор]
Dihloracetilen je prvi put sintetizovan 1930. [4]
Eterični rastvori dihloroacetilena su relativno stabilni i takav rastvor se može bezbedno dobiti dehidrohlorisanjem trihloroetilena. Popularna procedura koristi kalijum hidrid kao bazu: [13]
- Cl2C=CHCl + KH → ClC≡CCl + KCl + H2
Potreban je trag metanola.
Takođe je generisan (i korišćen na licu mesta) korišćenjem litijum diizopropilamida u anhidrovanim uslovima [14] kao i kalijum-hidroksida. [15] Dihloracetilen se može pojaviti i biti stabilan na vazduhu u koncentracijama do 200 delova na milion ako su prisutna druga jedinjenja, kao što je etar, sa kojim formira azeotrop (tačka ključanja od 32 °C (90 °F; 305 K)), i trihloroetilen [16] takođe je prisutan. [17]
Dodatni putevi[уреди | уреди извор]
To je nusproizvod u proizvodnji viniliden hlorida.[18] Na primer, može se formirati od trihloroetilena. [19][20] Takođe je moguće proizvesti dihloroacetilen iz trihloroetilena u niskim koncentracijama propuštanjem trihloroetilena kroz azot na 120 °C (248 °F; 393 K) u prisustvu suvog kalijum hidroksida. [21]
Reakcije[уреди | уреди извор]
Dihloroacetilen reaguje sa kiseonikom dajući fosgen : [21]
- ClC≡CCl + O2 → Cl2CO + CO
Dihloroacetilen, pošto je elektrofilan, dodaje nukleofile, kao što su amini:
- ClC≡CCl + R2NH → Cl(H)C=CCl(NR2)
Fizička svojstva[уреди | уреди извор]
Bezbojna isparljiva tečnost.
Hemijska svojstva[уреди | уреди извор]
Eksplodira i zapali se u kontaktu sa vazduhom i temperaturama ispod +800 °C (1.470 °F; 1.070 K):
i iznad +800 °C (1.470 °F; 1.070 K) zbog raspadanja fosgena i oslobađanja zapaljivog ugljen-monoksida:
Karakteristike[уреди | уреди извор]
Dihloroacetilen je veoma lako isparljiva tečnost koja već pri normalnom pritisku ključa 32 °C (90 °F; 305 K). [22] Molarna entalpija isparavanja je 27,4 kJ mol-1 [23] Sa molarnom entalpijom formiranja od 199 kJ mol-1 , to je visoko endotermno jedinjenje [23] koje ima tendenciju da eksplodira i spontano se zapali na vazduhu. [24][25] Stabilno jedinjenje 1:1 sa dietil etrom koji sadrži 55,4% dihloroacetilena je neeksplozivno i stabilno na vazduhu. [24] [25] [26]
Upotreba[уреди | уреди извор]
Jedinjenje se ne koristi komercijalno zbog visokog štetnog uticaja na zdravlje i hemijske nestabilnosti. [27] U organskoj sintezi, 1:1 adukt sa dietil etrom se može koristiti za uvođenje vinil etinila ili dihlorovinil funkcije u organske molekule. [10] Implementacija sa imidazolom daje N-(1,2-dihlorovinil)-imidazol. [10]

Biološka uloga i toksičnost[уреди | уреди извор]
Veoma je toksičan. To je posredna supstanca u formiranju dioksina.
Dihloroacetilen uzrokuje neurološke poremećaje, [18] između ostalih problema. [28][29] Studije na mužjacima pacova i zečeva su pokazale da udisanje dihloroacetilena može izazvati tubularnu nekrozu, fokalnu nekrozu i druge nefrotoksične efekte. Pored toga, zečevi kojima je dat dihloroacetilen imali su hepatotoksične i neuropatološke efekte. Udisanje dihloroacetilena takođe uzrokuje benigne tumore jetre i bubrega kod pacova. Hemikalija je takođe izazvala povećan broj limfoma. [18] Takođe uzrokuje gubitak težine kod životinja.[28] 3,5% doze dihloroacetilena ostaje u leševima mužjaka Vistar pacova. [18] LC50 izloženih miševa dihloroacetilenu su 124 delova po milionu za izlaganje udisanjem tokom 1 sata i 19 delova po milionu za izlaganje udisanjem tokom 6 sati. [21] Hemikalija se unosi pretežno kroz sisteme zavisne od glutationa. Glutation takođe reaguje sa njim. Hepatične i bubrežne glutation S-transferaze služe kao katalizatori ove reakcije. Dok je dihloroacetilen nefrotoksičan kod pacova, ne pokazuje znake nefrotoksičnosti kod ljudi. [16]
Dihloracetilen ima mutagene efekte na "Salmonella tiphimurium". [18]
Maksimalna bezbedna koncentracija dihloroacetilena u vazduhu je 0,1 delova po milionu. [30] Nije bezbedno čuvati dihloroacetilen u neposrednoj blizini kalijuma, natrijuma ili aluminijumskog praha. [5]
Kao i trihloroetilen, dihloroacetilen se metaboliše u S-(1,2-dihlorovinil)-L - cistein (DCVC) in vivo . [31][32]
Prema Ministarstvu saobraćaja, zabranjeno je slanje dihloroacetilena. [5]
Vidi još[уреди | уреди извор]
Reference[уреди | уреди извор]
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б в г д ђ NIOSH Џепни водич хемијских хазарда. „#0188”. Nacionalni institut za bezbednost i zdravlje na radu (NIOSH).
- ^ а б Henning Hopf; Bernhard Witulski (1995). „Functionalized Acetylenes in Organic Synthesis - The Case of the 1-Cyano- and the 1-Halogenoacetylenes”. Ур.: Stang, Peter J.; Diederich, François. Modern Acetylene Chemistry. Weinheim: VCH. стр. 33—66. ISBN 9783527615261. doi:10.1002/9783527615278.ch02.
- ^ а б в Pohanish, Richard P. (2011), Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens, William Andrew, ISBN 9781437778694
- ^ Clinton Davidson: Tolane chlorides from calcium carbide, chlorine and benzene. In: Journal of the American Chemical Society. 40, Nr. 2, 1918, S. 397–400, doi:10.1021/ja02235a009.
- ^ Erwin Ott, Walter Ottemeyer, Kurt Packendorff: Über das Dichlor-acetylen. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 63, Nr. 8, 1930, S. 1941–1944, doi:10.1002/cber.19300630810.
- ^ US 0
- ^ „Trichlorethen”. Römpp Online (на језику: немачки). Приступљено 27. novembar 2014.
- ^ а б в Kende, A.S.; Fludzinski, P.: A Convenient Laboratory Synthesis of Dichloroacetylene. In: Synthesis. 1982, 455–456. doi:10.1055/s-1982-29831.
- ^ Jean Noel Denis, Albert Moyano, Andrew E. Greene: Practical synthesis of dichloroacetylene. In: The Journal of Organic Chemistry. 52, Nr. 15, 1987, S. 3461–3462, doi:10.1021/jo00391a059.
- ^ Fritz Straus, Leo Kollek, Walther Heyn: Über den Ersatz positiven Wasserstoffs durch Halogen. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 63, 1930, S. 1868–1885, doi:10.1002/cber.19300630739.
- ^ Denis, Jean Noel; Moyano, Albert; Greene, Andrew E. (1987). „Practical synthesis of dichloroacetylene”. The Journal of Organic Chemistry. 52 (15): 3461—3462. doi:10.1021/jo00391a059.
- ^ „Dichlorovinylation of an Enolate: 8-Ethynyl-8-Methyl-1,4-Dioxaspiro[4.5]Dec-6-Ene”. Organic Syntheses. 64: 73. 1986. doi:10.15227/orgsyn.064.0073.
- ^ Siegel, J.; Jones, Richard Arvin.; Kurlansik, L. (1970). „Safe and Convenient Synthesis of Dichloroacetylene”. The Journal of Organic Chemistry. 35 (9): 3199. doi:10.1021/jo00834a090.
- ^ а б Valacchi, Giuseppe; Davis, Paul A., ур. (1. 1. 2008), Oxidants in Biology: A Question of Balance, Springer Science+Business Media, ISBN 9781402083990
- ^ Proceedings, Aerospace Medical Research Laboratory, 1966
- ^ а б в г д „Dichloroacetylene” (PDF), IARC Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Humans, 39: 369—78, 1986, PMID 3465694
- ^ John T. James; Harold L. Kaplan; Martin E. Coleman (1996), B5 Dichloroacetylene, ISBN 978-0-309-05629-8, doi:10.17226/5435, hdl:2060/19970023991
 , Приступљено 3. 7. 2013
, Приступљено 3. 7. 2013
- ^ Greim, H; Wolff, T; Höfler, M; Lahaniatis, E (1984), „Formation of dichloroacetylene from trichloroethylene in the presence of alkaline material--possible cause of intoxication after abundant use of chloroethylene-containing solvents”, Archives of Toxicology, 56 (2): 74—7, PMID 6532380, S2CID 19576314, doi:10.1007/bf00349074
- ^ а б в Reichert, D.; Ewald, D.; Henschler, D. (1975), „Generation and inhalation toxicity of dichloroacetylene”, Food and Cosmetics Toxicology, 13 (5): 511—5, PMID 1201833, doi:10.1016/0015-6264(75)90004-8
- ^ Record of Dichloracetylen in the GESTIS Substance Database from the IFA
- ^ а б Jeffrey A. Manion: Evaluated Enthalpies of Formation of the Stable Closed Shell C1 and C2 Chlorinated Hydrocarbons. In: Journal of Physical and Chemical Reference Data. 31, Nr. 1, 2002, S. 123–172, doi:10.1063/1.1420703.
- ^ а б John Wotiz, Francis Huba, Robert Vendley: Notes- α-Chloroacetylenes. In: The Journal of Organic Chemistry. 26, Nr. 5, 1961, S. 1626–1627, doi:10.1021/jo01064a600.
- ^ а б P.G. Urben; M.J. Pitt: Bretherick's Handbook of Reactive Chemical Hazards. 6. Edition, Vol. 1, Butterworth/Heinemann 1999, ISBN 0-7506-3605-X, S. 229.
- ^ Erwin Ott: Über das Dichloracetylen, III. Mitteil.: Darstellung und einige Vorlesungsversuche mit der gefahrlos zu handhabenden Molekülverbindung mit Äther. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 75, Nr. 12, 1942, S. 1517–1522, doi:10.1002/cber.19420751215.
- ^ IARC monographs on the evaluation of the carcinogenic risk of chemicals to humans: Dichloroacetylene, 39 (1986), 369–78.
- ^ а б Dichloroacetylene, 18. 11. 2010, Приступљено 3. 7. 2013
- ^ Dichloroacetylene, Приступљено 3. 7. 2013
- ^ Hazardous Material Fact Sheet (PDF), април 1997, Приступљено 4. 7. 2013
- ^ Purich, Daniel L., ур. (15. 9. 2009), Advances in Enzymology and Related Areas of Molecular Biology, Amino Acid Metabolism, John Wiley & Sons, ISBN 9780470123973
- ^ Kanhai, Wolfgang; Dekant, Wolfgang; Henschler, Dietrich (јануар 1989). „Metabolism of the nephrotoxin dichloroacetylene by glutathione conjugation”. Chemical Research in Toxicology. 2 (1): 51—56. ISSN 0893-228X. PMID 2519231. doi:10.1021/tx00007a009. eISSN 1520-5010.
Literatura[уреди | уреди извор]
- Trifu, Roxana Melita (1999), „Dichloroacetylene”, Homopolymers of Dihaloacetylenes (Ph.D. Thesis), стр. 57, Bibcode:1999PhDT.......149T, ISBN 978-0-549-39503-4[мртва веза]
- Промышленные хлорорганические продукты: Справочник. - М.: Химия, 1978. - С. 157-158
- Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей. - 7-е изд., Т.1. - Л.: Химия, 1976. - С. 248-249


