Бензојева киселина
| |||
 Кристали бензојеве киселине
| |||
| Називи | |||
|---|---|---|---|
| IUPAC назив
Benzoic acid
| |||
| Други називи | |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| 3DMet | Б00053 | ||
| Бајлштајн | 636131 | ||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.562 | ||
| EC број | 200-618-2 | ||
| Е-бројеви | Е210 (конзерванси) | ||
| Гмелин Референца | 2946 | ||
| КЕГГ[1] | |||
| МеСХ | бензоиц+ацид | ||
| RTECS | ДГ0875000 | ||
| УНИИ | |||
| |||
| Својства | |||
| C7H6O2 | |||
| Моларна маса | 122,12 g·mol−1 | ||
| Агрегатно стање | безбојна кристална материја | ||
| Густина | 1,27 g/cm3[4] | ||
| Тачка топљења | 12.238 °C (22.060 °F; 12.511 K) | ||
| Тачка кључања | 250 °C (482 °F; 523 K) | ||
| 2.9 g/L[4] | |||
| Киселост (пКа) | 4.21 | ||
| Индекс рефракције (nD) | 1.5397 | ||
| Структура | |||
| Кристална решетка/структура | Моноклинична | ||
| Облик молекула (орбитале и хибридизација) | планаран | ||
| Диполни момент | 1.72 D u dioksanu | ||
| Opasnosti | |||
| Opasnost u toku rada | Iritacija | ||
| Bezbednost prilikom rukovanja | JT Baker | ||
| NFPA 704 | |||
| Tačka paljenja | 121 °C (250 °F)[4] | ||
| 570 °C (1.058 °F; 843 K) | |||
| Srodna jedinjenja | |||
Srodne karboksilna kiselina
|
Fenolne kiseline Aminobenzojeve kiseline, Nitrobenzojeve kiseline | ||
Srodna jedinjenja
|
Benzaldehid, Benzil alkohol, Benzoil hlorid, Benzilamin, Benzamid | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Референце инфокутије | |||
Бензојева киселина,[6][7] C7H6O2 (или C6H5COOH), је безбојна кристална материја. Она је најједноставнија ароматична карбоксилна киселина. Име је изведено од бензоинске смоле, која је дуго времена била једини извор бензојеве киселине. Њене соли се користе као прехрамбени презервативи. Бензојева киселина је важан прекурзор за синтезу многих других органских супстанци. Соли и естри бензојеве киселине су познати као бензоати.
Историја[уреди | уреди извор]
Бензојева киселина је откривена у шеснаестом веку. Сува дестилација бензоинске смоле је прво описана од стране Нострадамуса (1556), и накнадно у радовима Алексиус Педемонтануса (1560) и Блаиз де Вигенера (1596).[8]
Производња[уреди | уреди извор]
Индустријска припрема[уреди | уреди извор]
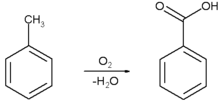
Бензојева киселина се комерцијално производи парцијалном оксидацијом толуена кисеоником. Процес се катализује кобалт или манган нафтенатима. Процес користи јефтине сировине и производи висок принос.
Лабораторијска синтеза[уреди | уреди извор]
Бензојева киселина је јефтина и широко доступна, тако да лабораторијска синтеза бензојеве киселине првенствено има педагошку вредност.
У свим синтезама, бензојева киселина се може пречистити рекристализацијом из воде услед њене високе растворљивости у топлој и мале растворљивости у хладној води. Одсуство органских растварача у рекристализацији чини овај експеримент посебно безбедним. Други могући рекристализациони растварачи су сирћетна киселина, бензен, ацетон, петролеум етар, и мешавина етанола и воде.[9]
Путем хидролизе[уреди | уреди извор]
Као и сваки други нитрил или амид, бензонитрил и бензамид се могу хидролизовати до бензојеве киселине или њених коњугованих база у киселим или базним условима.
Из бензалдехида[уреди | уреди извор]
Базом индукована диспропортионација бензалдехида, Канизарова реакција, производи једнаке количине бензоата и бензил алкохола. Алкохол може бити одстрањен дестилацијом.
Фармакокинетика[уреди | уреди извор]
Метаболички путеви метамфетамина
|
Референце[уреди | уреди извор]
- ^ Јоанне Wиxон; Доуглас Келл (2000). „Wебсите Ревиеw: Тхе Кyото Енцyцлопедиа оф Генес анд Геномес — КЕГГ”. Yеаст. 17 (1): 48—55. дои:10.1002/(СИЦИ)1097-0061(200004)17:1<48::АИД-YЕА2>3.0.ЦО;2-Х.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б в г Record in the GESTIS Substance Database from the IFA
- ^ „Melting point of benzoic acid”. Архивирано из оригинала 26. 10. 2011. г. Приступљено 18. 07. 2011.
- ^ Шурањи, Терезија; Цанић, Велимир (1977). „Испитивање пропионатних, фталатних и бензоатних комплекса церијума (III)”. Гласник Хемијског друштва Београд. 42: 538.
- ^ Гласник Српске академије наука. Београд. 1953. стр. 261.
- ^ Neumüller O-A (1988). Römpps Chemie-Lexikon (6 изд.). Stuttgart: Frankh'sche Verlagshandlung. ISBN 978-3-440-04516-9. OCLC 50969944.
- ^ D. D. Perrin; W. L. F. Armarego (1988). Purification of Laboratory Chemicals (3rd изд.). Pergamon Press. стр. 94. ISBN 978-0-08-034715-8.
Dodatna literatura[уреди | уреди извор]
- Cosmetic Ingredient Review Expert Panel Bindu Nair (2001). „Final Report on the Safety Assessment of Benzyl Alcohol, Benzoic Acid, and Sodium Benzoate”. Int J Tox. 20 (Suppl. 3): 23—50. PMID 11766131. doi:10.1080/10915810152630729.
- Neumüller O-A (1988). Römpps Chemie-Lexikon (6 изд.). Stuttgart: Frankh'sche Verlagshandlung. ISBN 978-3-440-04516-9. OCLC 50969944.
- D. D. Perrin; W. L. F. Armarego (1988). Purification of Laboratory Chemicals (3rd изд.). Pergamon Press. стр. 94. ISBN 978-0-08-034715-8.