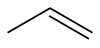
Propen
| |||
| |||
| Nazivi | |||
|---|---|---|---|
| Preferisani IUPAC naziv
Propen[1] | |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003.693 | ||
| KEGG[2] | |||
| RTECS | UC6740000 | ||
| UNII | |||
| UN broj | 1077 U tečnom naftnom gasu: 1075 | ||
| |||
| |||
| Svojstva | |||
| C3H6 | |||
| Molarna masa | 42,08 g·mol−1 | ||
| Agregatno stanje | Bezbojni gas | ||
| Gustina | 1,81 kg/m3, гас (1,013 bar, 15 °C) 1,745 kg/m3, гас (1,013 bar, 25 °C) 613,9 kg/m3, течност | ||
| Tačka topljenja | −185,2 °C (−301,4 °F; 88,0 K) | ||
| Tačka ključanja | −47,6 °C (−53,7 °F; 225,6 K) | ||
| 0,61 g/m3 | |||
| Magnetna susceptibilnost | -31,5·10−6 cm³/mol | ||
| Viskoznost | 8,34 µPa·s na 16,7 °C | ||
| Struktura | |||
| Dipolni moment | 0,366 D (gas) | ||
| Opasnosti | |||
| Bezbednost prilikom rukovanja | External MSDS | ||
EU klasifikacija (DSD)
|
  
| ||
| R-oznake | 12 | ||
| S-oznake | 9-16-33 | ||
| NFPA 704 | |||
| Tačka paljenja | −108 °C (−162 °F; 165 K) | ||
| Srodna jedinjenja | |||
Srodna alkenska jedinjenja;
srodne grupe |
Etilen, izomeri butilena; alil, propenil | ||
Srodna jedinjenja
|
Propan, propin propadien, 1-propanol 2-propanol | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |||
| Reference infokutije | |||
Propilen, takođe poznat pod IUPAC-ovim imenom kao propen, je organsko jedinjenje hemijske formule C3H6. To je drugo po jednostavnosti jedinjenje iz grupe alkena iz klase ugljovodonika, od kojih je etilen (eten) najjednostavniji. Pod normalnim uslovima propilen je gas bez boje i mirisa.[5] (U komercijalni gas se dodaju tragovi merkaptana ili sličnih jedinjenja neprijatnog i prodornog mirisa da bi se gas, ako procuri lako osetio po mirisu. Propilen može da se dobije gasifikacijom uglja ali se uglavnom proizvodi krekovanjem sirove nafte. Propilen je jedna od najvažnijih sirovina u petrohemijskoj industriji. Najvažnija upotreba je kao monomera u proizvodnji polipropilena.[6]
Produkcija[uredi | uredi izvor]
Parno krekovanje[uredi | uredi izvor]
Dominantna tehnologija za proizvodnju propilena je krekovanje parom. Ista tehnologija se primenjuje od etana do etilena. Ove dve konverzije su procesi #2 i #1 u hemijskoj industriji, sudeći po njihovom opsegu.[7] U ovom procesu, propan se podvrgava dehidrogenaciji. Nusproizvod je vodonik:
- CH3CH2CH3 → CH3CH=CH2 + H2
Prinos propena je oko 85 m%. Nusproizvodi se obično koriste kao gorivo za reakciju dehidrogenacije propana. Parno krekovanje je jedan od energetski najintenzivnijih industrijskih procesa.
Sirovina je nafta ili propan, posebno na Blikom Istoku, gde postoji obilje propana iz naftnih/gasnih operacija.[8] Propen se može izdvojiti frakcionom destilacijom iz mešavina ugljovodonika dobijenih krekingom i drugim procesima rafinacije; propen za rafineriju je ima čistoču od 50 do 70%.[9] U Sjedinjenim Državama, gas iz škriljaca je glavni izvor propana.
Tehnologija konverzije olefina[uredi | uredi izvor]
U Filipsovoj triolefinskoj ili tehnologiji olefinske konverzije propilen se interkonvertuje sa etilenom i 2-butenima. Koriste se renijumski i molibdenski katalizatori:[10]
- CH2=CH2 + CH3CH=CHCH3 → 2 CH2=CHCH3
Tehnologija je zasnovana na reakciji metateze olefina otkrivenoj u Filipsovoj naftnoj kompaniji.[11][12] Postižu se prinosi propena od oko 90 tež.%.
Fluidno katalitičko krekovanje[uredi | uredi izvor]
Fluidno katalitički kreking (FCC) visoke jačine koristi tradicionalnu tehnologiju u oštrim uslovima (veći odnos katalizatora i ulja, veće brzine ubrizgavanja pare, više temperature, itd) kako bi se maksimizovala količina propena i drugih lakih proizvoda. Jedinica FCC procesa visoke jačine se obično napaja gasnim uljima (parafinima) i ostacima i proizvodi oko 20-25 m% propena na sirovini zajedno sa većim količinama motornog benzina i destilacionih nusproizvoda. Ovi visokotemperaturni procesi su skupi i imaju visok ugljični otisak. Iz ovih razloga, alternativni putevi za dobijanje propilena i dalje privlače pažnju.[13]
Tržište i istraživanje[uredi | uredi izvor]
Proizvodnja propena je ostala statična na oko 35 miliona tona (samo u Evropi i Severnoj Americi) od 2000. do 2008. godine, ali je u porastu u istočnoj Aziji, pre svega u Singapuru i Kini.[14] Ukupna svetska proizvodnja propena je trenutno oko polovine manja od etilena.
Upotreba konstruisanih enzima je istražena, ali nema komercijalnu vrednost.[15]
Upotrebe[uredi | uredi izvor]
Propen je drugi najvažniji početni proizvod u petrohemijskoj industriji posle etilena. To je sirovina za širok spektar proizvoda. Proizvođači polipropilena troše skoro dve trećine svetske proizvodnje.[16] Krajnja upotreba polipropilena uključuje filmove, vlakna, kontejnere, ambalažu, poklopce i zatvarače. Propen se takođe koristi za proizvodnju važnih hemikalija kao što su propilen oksid, akrilonitril, kumen, butiraldehid i akrilna kiselina. U 2013. godini oko 85 miliona tona propena je prerađeno širom sveta.[16]
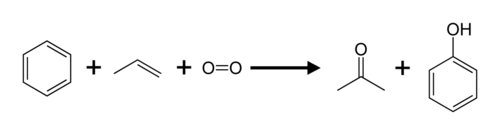
Propen i benzol se kumenskim procesom pretvaraju u aceton i fenol.
Propen se takođe koristi za proizvodnju izopropanola (propan-2-ol), akrilonitrila, propilen oksida i epihlorohidrina.[17] Industrijska proizvodnja akrilne kiseline uključuje katalitičku delimičnu oksidaciju propena.[18] Propen je takođe intermedijer u jednostepenoj selektivnoj oksidaciji propana u akrilnu kiselinu.[19][20][21][22] U industriji i zanatstvu, propen se koristi kao alternativno gorivo acetilenu u zavarivanju i rezanju, lemljenju i zagrevanju metala u svrhu savijanja. On je postao standard u Bernzomatik proizvodima i drugim zamenama za MAPP,[23] sada kada pravi MAPP gas više nije dostupan.
Reakcije[uredi | uredi izvor]
Propen podseća na druge alkene po tome što se relativno lako podvrgava reakcijama adicije na sobnoj temperaturi. Relativna slabost njegove dvostruke veze objašnjava njenu tendenciju da reaguje sa supstancama koje mogu ostvariti ovu transformaciju. Reakcije alkena obuhvataju: 1) polimerizaciju, 2) oksidaciju, 3) halogenaciju i hidrohalogenaciju, 4) alkilaciju, 5) hidrataciju, 6) oligomerizaciju i 7) hidroformilaciju.
Kompleksi prelaznih metala[uredi | uredi izvor]
Osnova za hidroformilaciju, metatezu alkena i polimerizaciju su kompleksi metal-propilen, koji su intermedijeri u ovim procesima. Propilen je prohiralan, što znači da vezivanje reagensa (kao što je metalni elektrofil) za C=C grupu daje jedan od dva enantiomera.
Polimerizacija[uredi | uredi izvor]
Većina propena se koristi za formiranje polipropilena, veoma važne robe termoplastike, kroz polimerizaciju lančanog rasta.[16] U prisustvu odgovarajućeg katalizatora (obično Zigler-Nata katalizatora), propen će se polimerizovati. Postoji više načina da se to postigne, kao što je korišćenje visokog pritiska za suspendovanje katalizatora u rastvoru tečnog propena, ili propuštanje gasovitog propena kroz reaktor sa fluidizovanim slojem.[24]
Sagorevanje[uredi | uredi izvor]
Propen gori na sličan način kao i drugi alkeni. U prisustvu dovoljnog ili prekomernog kiseonika, propen gori i formira vodu i ugljen-dioksid.
- 2 C3H6 + 9 O2 → 6 CO2 + 6 H2O
Osobine[uredi | uredi izvor]
| Osobina | Vrednost |
|---|---|
| Broj akceptora vodonika | 0 |
| Broj donora vodonika | 0 |
| Broj rotacionih veza | 0 |
| Particioni koeficijent[25] (ALogP) | 1,3 |
| Rastvorljivost[26] (logS, log(mol/L)) | -0,3 |
| Polarna površina[27] (PSA, Å2) | 0,0 |
Reference[uredi | uredi izvor]
- ^ „Front Matter”. Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. str. 31. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001.
- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Lide David R., ur. (2006). CRC Handbook of Chemistry and Physics (87th izd.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ „Propylene”.
- ^ Giovanni Maggini (2013-04-17). „Technology Economics: Propylene via Propane Dehydrogenation, Part 3”. Slideshare.net. Pristupljeno 2013-11-12.
- ^ Ashford’s Dictionary of Industrial Chemicals, Third edition, (2011) ISBN 978-0-9522674-3-0, pages 7766-9
- ^ „Product Safety Assessment(PSA): Propylene”. Dow Chemical Co. Arhivirano iz originala 2013-06-22. g. Pristupljeno 2011-07-11.
- ^ Ghashghaee, Mohammad (2018). „Heterogeneous catalysts for gas-phase conversion of ethylene to higher olefins”. Rev. Chem. Eng. 34 (5): 595—655. S2CID 103664623. doi:10.1515/revce-2017-0003.
- ^ Banks, R. L.; Bailey, G. C. (1964). „Olefin Disproportionation. A New Catalytic Process”. Industrial & Engineering Chemistry Product Research and Development. 3 (3): 170—173. doi:10.1021/i360011a002.
- ^ Lionel Delaude; Alfred F. Noels (2005). „Metathesis”. Kirk-Othmer Encyclopedia of Chemical Technology. Weinheim: Wiley-VCH. ISBN 978-0471238966. doi:10.1002/0471238961.metanoel.a01.
- ^ Schiffer, Zachary J.; Manthiram, Karthish (2017). „Electrification and Decarbonization of the Chemical Industry”. Joule. 1: 10—14. doi:10.1016/j.joule.2017.07.008. hdl:1721.1/124019
 .
.
- ^ Amghizar, Ismaël; Vandewalle, Laurien A.; Van Geem, Kevin M.; Marin, Guy B. (2017). „New Trends in Olefin Production”. Engineering. 3 (2): 171—178. doi:10.1016/J.ENG.2017.02.006
 .
.
- ^ de Guzman, Doris (12. 10. 2012). „Global Bioenergies in bio-propylene”. Green Chemicals Blog. Arhivirano iz originala 04. 11. 2021. g. Pristupljeno 01. 11. 2021.
- ^ a b v „Market Study: Propylene (2nd edition), Ceresana, December 2014”. ceresana.com. Arhivirano iz originala 02. 12. 2020. g. Pristupljeno 2015-02-03.
- ^ Budavari, Susan, ur. (1996). „8034. Propylene”. The Merck Index, Twelfth Edition. New Jersey: Merck & Co. str. 1348—1349.
- ^ J.G.L., Fierro (Ed.) (2006). Metal Oxides, Chemistry and Applications. CRC Press. str. 414—455.
- ^ Naumann d'Alnoncourt, Raoul; Csepei, Lénárd-István; Hävecker, Michael; et al. (mart 2014). „The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts”. Journal of Catalysis. 311: 369—385. doi:10.1016/j.jcat.2013.12.008. hdl:11858/00-001M-0000-0014-F434-5
 .
.
- ^ Amakawa, Kazuhiko; Kolen'Ko, Yury V.; Villa, Alberto; et al. (7. 6. 2013). „Multifunctionality of Crystalline MoV(TeNb) M1 Oxide Catalysts in Selective Oxidation of Propane and Benzyl Alcohol”. ACS Catalysis. 3 (6): 1103—1113. doi:10.1021/cs400010q. hdl:11858/00-001M-0000-000E-FA39-1.
- ^ Hävecker, Michael; Wrabetz, Sabine; Kröhnert, Jutta; et al. (januar 2012). „Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid”. Journal of Catalysis. 285 (1): 48—60. doi:10.1016/j.jcat.2011.09.012. hdl:11858/00-001M-0000-0012-1BEB-F
 .
.
- ^ Csepei, Lénárd-István (2011). Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts. str. 3—24, 93. doi:10.14279/depositonce-2972.
- ^ For example, "MAPP-Pro"
- ^ Heggs, T. Geoffrey (2011-10-15), Wiley-VCH Verlag GmbH & Co. KGaA, ur., „Polypropylene”, Ullmann's Encyclopedia of Industrial Chemistry (na jeziku: engleski), Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, str. o21_o04, ISBN 978-3-527-30673-2, doi:10.1002/14356007.o21_o04, Pristupljeno 2021-07-09
- ^ Ghose, A.K.; Viswanadhan V.N. & Wendoloski, J.J. (1998). „Prediction of Hydrophobic (Lipophilic) Properties of Small Organic Molecules Using Fragment Methods: An Analysis of AlogP and CLogP Methods”. J. Phys. Chem. A. 102: 3762—3772. doi:10.1021/jp980230o.
- ^ Tetko IV, Tanchuk VY, Kasheva TN, Villa AE (2001). „Estimation of Aqueous Solubility of Chemical Compounds Using E-State Indices”. Chem Inf. Comput. Sci. 41: 1488—1493. PMID 11749573. doi:10.1021/ci000392t.
- ^ Ertl P.; Rohde B.; Selzer P. (2000). „Fast calculation of molecular polar surface area as a sum of fragment based contributions and its application to the prediction of drug transport properties”. J. Med. Chem. 43: 3714—3717. PMID 11020286. doi:10.1021/jm000942e.
Literatura[uredi | uredi izvor]
- Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I izd.). Oxford University Press. ISBN 978-0-19-850346-0.
- Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th izd.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
Spoljašnje veze[uredi | uredi izvor]
- „Spacecraft finds propylene on Saturn moon, Titan”. UPI.com. 2013-09-30. Pristupljeno 2013-11-12.
- „Cassini finds ingredient of household plastic on Saturn moon”. Spacedaily.com. Pristupljeno 2013-11-12.