Legura

Legura je smeša dva ili više elemenata od kojih je barem jedan metal. Legirajući elementi mogu da sa osnovnim metalom formiraju jednu fazu, tzv. čvrsti rastvor (jednofazne legure) ili više različitih faza (višefazni sistemi). Osobine jednofaznih legura zavise uglavnom od hemijskog sastava tj. udela legirajućeg elementa, dok kod višefaznih legura oblik, veličina i raspodela različitih faza mikrostruktura igraju odlučujuću ulogu.
Legura ima osobine metala ali one mogu biti znatno različite od osobina čistih komponenata iz kojih se legura sastoji. Osobine legura se mogu promeniti odnosno poboljšati mehaničkom ili termičkom obradom, kao npr. valjanjem, kovanjem, žarenjem, kaljenjem ili otpuštanjem. Neke od legura koje se koriste u svakodnevnom životu: Nerđajući čelik (Fe, Cr, Ni), Liveno gvožđe (Fe, C, Si), Mesing (Cu, Zn), Alpaka (Zn, Cu, Ni), Duraluminijum (Mg, Al, Si, Cu), Bronza (Sn, Cu), Magnalijum (Al, Mg), Amalgam (Hg, Sn, Au).
Elementi se dodaju osnovnom metalu da indukuju tvrdoću, izdržljivost ili druga željena svojstva. Većina metala i legura može biti očvrsnuta stvaranjem nepravilnosti u njihovoj kristalnoj strukturi. Ovi defekti nastaju tokom plastične deformacije čekanjem, savijanjem, itd. i trajne su ako se metal ne rekristalizuje. U suprotnom, neke legure mogu takođe da promene svojstva zagrevanjem. Gotovo svi metali se mogu omekšati žarenjem koji rekristališe leguru i popravlja nedostatke, ali ne toliko koliko se može očvršćavati kontrolisanim zagrevanjem i hlađenjem. Mnoge legure aluminijuma, bakra, magnezijuma, titana i nikla mogu se u određenoj meri ojačati nekim metodom termičke obrade, ali mali broj njih odgovara na to u istom procenty kao čelik.
Legure su definisane karakterom metalnog vezivanja.[1] Sastojci legure se obično mere u procentima mase za praktične primene, a u atomskim frakcijama za osnovne naučne studije. Legure se obično klasifikuju kao supstitucione ili međuprostorne legure, u zavisnosti od atomskog rasporeda koji formira leguru. One se dalje mogu klasifikovati kao homogene (sastoje se od jedne faze), heterogene (sastoje se od dve ili više faza) ili intermetalne.
Terminologija
[uredi | uredi izvor]
Kao imenica, termin legura se koristi da opiše mešavinu atoma u kojoj je primarni sastojak metal. Kada se koristi kao glagol, termin se odnosi na čin mešanja metala sa drugim elementima. Primarni metal se naziva baza, matrica ili rastvarač. Sekundarni sastojci se često nazivaju rastvorenim materijama. Ako postoji mešavina samo dve vrste atoma (ne računajući nečistoće) kao što je legura bakra i nikla, onda se to naziva binarna legura. Ako postoje tri vrste atoma koji formiraju smešu, kao što su gvožđe, nikl i hrom, onda se to naziva ternarna legura. Legura sa četiri sastojka je kvaternarna legura, dok se petodelna legura naziva kvinarna legura. Pošto procenat svakog sastojka može da varira, sa bilo kojom mešavinom, čitav opseg mogućih varijacija se naziva sistem. U tom pogledu, svi različiti oblici legure koje sadrže samo dva sastojka, kao što su gvožđe i ugljenik, nazivaju se binarnim sistemom, dok sve kombinacije legura moguće sa trojnom legurom, kao što su legure gvožđa, ugljenika i hroma, naziva se ternarnim sistemom.[2]
Legura je tehnički nečist metal, ali kada se govori o legurama, termin nečistoće obično označava nepoželjne elemente. Takve nečistoće se unose iz osnovnih metala i legirajućih elemenata, ali se uklanjaju tokom obrade. Na primer, sumpor je uobičajena nečistoća u čeliku. Sumpor se lako kombinuje sa gvožđem da bi formirao gvožđe sulfid, koji je veoma krt, stvarajući slabe tačke u čeliku.[3] Litijum, natrijum i kalcijum su uobičajene nečistoće u legurama aluminijuma, koje mogu imati štetne efekte na strukturni integritet odlivaka. Nasuprot tome, inače čisti metali koji jednostavno sadrže neželjene nečistoće često se nazivaju „nečisti metali“ i obično se ne nazivaju legurama. Kiseonik, prisutan u vazduhu, lako se kombinuje sa većinom metala i formira metalne okside; posebno na višim temperaturama koje se sreću tokom legiranja. Tokom procesa legiranja se često vodi velika pažnja da se uklone suvišne nečistoće, korišćenjem flukseva, hemijskih aditiva ili drugih metoda ekstrakcijske metalurgije.[4]
U praksi, neke legure se koriste toliko predominantno u odnosu na njihove osnovne metale da se naziv primarnog sastojka takođe koristi kao naziv legure. Na primer, zlato od 14 karata je legura zlata sa drugim elementima. Slično tome, srebro koje se koristi u nakitu i aluminijum koji se koristi kao strukturni građevinski materijal su takođe legure.
Termin „legura” se ponekad koristi u svakodnevnom govoru kao sinonim za određenu leguru. Na primer, automobilski točkovi napravljeni od legure aluminijuma obično se nazivaju jednostavno „felnama od legure“, iako su u stvarnosti čelici i većina drugih metala u praktičnoj upotrebi takođe legure. Čelik je toliko uobičajena legura da se mnogi predmeti napravljeni od njega, poput točkova, buradi ili nosača, jednostavno nazivaju imenom predmeta, podrazumevajući da je napravljen od čelika. Kada su napravljeni od drugih materijala, obično se navode kao takvi (tj. „bronzani točak“, „plastično bure“ ili „drveni nosač“).
Teorija
[uredi | uredi izvor]Legiranje metala se vrši kombinovanjem sa jednim ili više drugih elemenata. Najčešći i najstariji proces legiranja se izvodi zagrevanjem osnovnog metala iznad njegove tačke topljenja, a zatim rastvaranjem rastvorenih materija u rastopljenu tečnost, što može biti moguće čak i ako je tačka topljenja rastvorene supstance daleko veća od one baze. Na primer, u svom tečnom stanju, titanijum je veoma jak rastvarač sposoban da rastvori većinu metala i elemenata. Pored toga, lako apsorbuje gasove poput kiseonika i sagoreva u prisustvu azota. Ovo povećava mogućnost kontaminacije sa bilo koje kontaktne površine, te se mora rastopiti zagrevanjem u vakuumu, i koristeći specijalne, vodeno hlađene, bakarne tiglove.[5] Međutim, neki metali i rastvorci, kao što su gvožđe i ugljenik, imaju veoma visoke tačke topljenja i drevnim ljudima je bilo nemoguće da se istope. Stoga, legiranje (posebno intersticijalno legiranje) takođe može biti izvedeno sa jednim ili više sastojaka u gasovitom stanju, kao što se slučaj u visokoj peći za proizvodnju sirovog gvožđa (tečno-gas), nitriranje, karbonitriranje ili drugi oblici očvršćavanja kućišta (čvrsto-gas), ili proces cementacije koji se koristi za pravljenje blister čelika (čvrsto-gas). To se takođe se može ostvariti sa jednim, više ili sa sva tri konstituenta u čvrstom stanju, kao što je rađeno u drevnim metodama zavarivanja po uzoru (čvrsto-čvrsto), smičućim čelikom (čvrsto-čvrsto) ili proizvodnjom čeličnog liva (čvrsto-tečnost), mešanje elemenata putem difuzije u čvrstom stanju.
Dodavanjem drugog elementa metalu, razlike u veličini atoma stvaraju unutrašnje napone u rešetki metalnih kristala; ovi naponi koji često poboljšavaju njegova svojstva. Na primer, kombinacija ugljenika sa gvožđem proizvodi čelik, koji je jači od gvožđa, njegovog primarnog elementa. Električna i toplotna provodljivost legura je obično niža od provodljivosti čistih metala. Fizička svojstva, kao što su gustina, reaktivnost, Jangov modul legure, možda se neće mnogo razlikovati od karakteristika njenog osnovnog elementa, ali inženjerska svojstva kao što su zatezna čvrstoća,[6] duktilnost i smična čvrstoća mogu se značajno razlikovati od korespondirajućih svojstava sastavnih materijali. Ovo je ponekad rezultat veličine atoma u leguri, jer veći atomi vrše kompresivnu silu na susedne atome, a manji atomi vrše silu zatezanja na svoje susede, pomažući leguri da se odupre deformaciji. Ponekad legure mogu pokazati značajne razlike u ponašanju čak i kada su prisutne male količine jednog elementa. Na primer, nečistoće u poluprovodničkim feromagnetnim legurama dovode do različitih svojstava, kao što su prvi predvideli Vajt, Hogan, Sal, Tijan Obri i Nakamura.[7][8] Neke legure se prave topljenjem i mešanjem dva ili više metala. Bronza, legura bakra i kalaja, bila je prva otkrivena legura tokom praistorijskog perioda, sada poznatog kao bronzano doba. Ona je tvrđa od čistog bakra i prvobitno se koristila za pravljenje alata i oružja, ali je kasnije zamenjena metalima i legurama sa boljim svojstvima. U kasnijim vremenima bronza je korišćena za ukrase, zvona, statue i ležajeve. Mesing je legura napravljena od bakra i cinka.
Za razliku od čistih metala, većina legura nema jednu tačku topljenja, već opseg topljenja tokom kojeg je materijal mešavina čvrste i tečne faze (bljuzga). Temperatura na kojoj počinje topljenje naziva se solidus, a temperatura kada je topljenje tek završeno naziva se likvidus. Za mnoge legure postoji određena proporcija legure (u nekim slučajevima više od jedne), koja se naziva ili eutektička smeša ili peritektički sastav, koji leguri daje jedinstvenu i nisku tačku topljenja i nema prelaza tečna/čvrsta bljuzgavica.
Legure koje se obrađuju toplotom
[uredi | uredi izvor]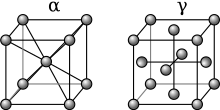

Elementi za legiranje se dodaju osnovnom metalu da bi se indukovala tvrdoća, žilavost, duktilnost ili druga željena svojstva. Većina metala i legura može da se očvrsne stvaranjem defekata u njihovoj kristalnoj strukturi. Ovi defekti nastaju tokom plastične deformacije čekićem, savijanjem, ekstrudiranjem i tako dalje, i trajni su osim ako se metal ne rekristališe. U suprotnom, neke legure takođe mogu imati promenjena svojstva termičkom obradom. Skoro svi metali se mogu omekšati žarenjem, koje rekristalizuje leguru i popravlja nedostatke. To se donekle može ostvariti očvršćavanjem putem kontrolisanog zagrevanja i hlađenja. Mnoge legure aluminijuma, bakra, magnezijuma, titanijuma i nikla mogu biti ojačane do određenog stepena nekim metodom termičke obrade, ali malo njih reaguje na to u istom stepenu kao i čelik.[9]
Gvožđe je osnovni metal legure gvožđa i ugljenika poznate kao čelik. Ono prolazi kroz promenu u rasporedu (alotropiji) atoma svoje kristalne matrice na određenoj temperaturi (obično između 1.500 °F (820 °C) i 1.600 °F (870 °C), u zavisnosti od sadržaja ugljenika). Ovo omogućava manjim atomima ugljenika da uđu u međuprostore kristala gvožđa. Kada dođe do ve difuzije, za atome ugljenika se kaže da su u rastvoru u gvožđu, formirajući posebnu, homogenu, kristalnu fazu koja se zove austenit. Ako se čelik polako hladi, ugljenik može da difunduje iz gvožđa i postepeno će se vratiti na alotrop niske temperature. Tokom sporog hlađenja, atomi ugljenika više neće biti tako rastvorljivi u gvožđu, i biće primorani da se talože iz rastvora, stvarajući jezgra koncentrovanijeg oblika karbida gvožđa (Fe3C) u prostorima između čistih kristala gvožđa. Čelik tada postaje heterogen, jer se formira od dve faze, faze gvožđe-ugljenik koja se zove cementit (ili karbida) i čistog ferita gvožđa. Takva toplotna obrada proizvodi čelik koji je prilično mekan. Međutim, ako se čelik brzo ohladi, atomi ugljenika neće imati vremena da se difunduju i talože kao karbid, već će biti zarobljeni unutar kristala gvožđa. Kada se brzo ohladi, dolazi do transformacije bez difuzije (martenzita), u kojoj atomi ugljenika postaju zarobljeni u rastvoru. Ovo uzrokuje da se kristali gvožđa deformišu dok kristalna struktura pokušava da se promeni u stanje niske temperature, ostavljajući te kristale veoma čvrste, ali mnogo manje duktilne (krhkije).
Dok visoka čvrstoća čelika nastaje kada je sprečena difuzija i taloženje (formiranje martenzita), većina legura za termičku obradu su legure koje očvršćavaju taloženjem, koje zavise od difuzije legirajućih elemenata da bi se postigla njihova čvrstoća. Kada se zagreju da bi se formirao rastvor, a zatim brzo ohlade, ove legure postaju mnogo mekše nego normalne, tokom transformacije bez difuzije, ali zatim očvršćavaju kako stare. Rastvorene supstance u ovim legurama će se vremenom taložiti, formirajući intermetalne faze, koje je teško razlikovati od osnovnog metala. Za razliku od čelika, u kome se čvrsti rastvor razdvaja na različite kristalne faze (karbid i ferit), legure koje očvršćavaju taloženjem formiraju različite faze unutar istog kristala. Ove intermetalne legure izgledaju homogene u kristalnoj strukturi, ali imaju tendenciju da se ponašaju heterogeno, postajući tvrde i pomalo krte.[9]
Reference
[uredi | uredi izvor]- ^ Callister, W.D. "Materials Science and Engineering: An Introduction" 2007, 7th edition, John Wiley and Sons, Inc. New York, Section 4.3 and Chapter 9.
- ^ Bauccio, Michael (1003). ASM metals reference book.. ASM International. ISBN 0-87170-478-1.
- ^ Verhoeven, John D. (2007). Steel Metallurgy for the Non-metallurgist. ASM International. str. 56. ISBN 978-1-61503-056-9. Arhivirano iz originala 2016-05-05. g.
- ^ Davis, Joseph R (1993). ASM Specialty Handbook: Aluminum and Aluminum Alloys. str. 211.. ASM International.. ISBN 978-0-87170-496-2.
- ^ Metals Handbook: Properties and selection By ASM International – ASM International 1978 Page 407
- ^ Mills, Adelbert Phillo (1922). Materials of Construction: Their Manufacture and Properties., John Wiley & sons, inc, originally published by the University of Wisconsin, Madison
- ^ Hogan, C. (1969). „Density of States of an Insulating Ferromagnetic Alloy”. Physical Review. 188 (2): 870—874. Bibcode:1969PhRv..188..870H. doi:10.1103/PhysRev.188.870.
- ^ Zhang, X.; Suhl, H. (1985). „Spin-wave-related period doublings and chaos under transverse pumping”. Physical Review A. 32 (4): 2530—2533. Bibcode:1985PhRvA..32.2530Z. PMID 9896377. doi:10.1103/PhysRevA.32.2530.
- ^ a b Dossett, Jon L. and Boyer, Howard E (2006). Practical heat treating. str. 1—14.. ASM International.. ISBN 1-61503-110-3.
Literatura
[uredi | uredi izvor]- Buchwald, Vagn Fabritius (2005). Iron and steel in ancient times. Det Kongelige Danske Videnskabernes Selskab. ISBN 978-87-7304-308-0.
Spoljašnje veze
[uredi | uredi izvor]- Roberts-Austen, William Chandler; Neville, Francis Henry (1911). „Alloys”. Encyclopædia Britannica (na jeziku: engleski) (11 izd.).
 „Alloy”. The American Cyclopædia. 1879.
„Alloy”. The American Cyclopædia. 1879.
