Radikal (hemija)
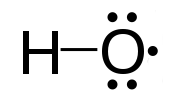
Radikali (slobodni radikali) su atomi, molekuli, ili joni sa nesparenim elektronima u spoljašnjoj ljuski.[1][2][3] Slobodni radikali mogu da budu pozitivni, negativni, ili bez naelektrisanja. Nespareni elektroni daju radikalima hemijsku reaktivnost. Smatra se da su slobodni radikali u telu jedan od uzroka degenerativnih bolesti, starenja i kancera.
Slobodni radikali su značajni za sagorevanje, atmosfersku hemiju, polimerizaciju, hemiju plazme, biohemiju, i mnoge druge hemijske procese. U hemijskoj biologiji, superoksid i azot-monoksid regulišu mnoštvo procesa, kao što je kontrola vaskularnog tona. Radikali mogu da budu i glasnici posredstvom fenomena zvanog redoks signalizacija. Radikal može da bude zarobljen unutar kaveza rastvarača, ili da budu na neki drugi način vezani.
Hemijske reakcije
[uredi | uredi izvor]U hemijskim jednačinama, slobodni radikali se često označavaju tačkom stavljenom neposredno iza simbola atoma:
- Gasoviti hlor se može razložiti ultravioletnom svetlošću čime se formiraju radikali hlora.
Reakcioni mehanizmi radikala koriste jednostranu strelu za prikazivanje kretanja elektrona:
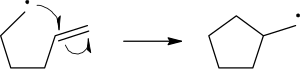
Homolitičko raskidanje veze se prikazuje strelom koja nalikuje kuki za ribu, da bi se napravila razlika od uobičajenog kretanja dva elektrona, što se prikazuje standardnom zakrivljenom strelom. Treba napomenuti da se drugi elektron raskidajuće veze takođe pomera da formira par sa napadujićem elektronom radikala; to nije eksplicitno prikazano u ovom slučaju.
Slobodni radikali uzimaju učešća u adiciji i supstituciji radikala kao reaktivni intermedijari. Lančane reakcije u kojima učestvuju slobodni radikali se obično dele u tri procesa.
- Reakcije inicijacije rezultuju u povećanju broja slobodnih radikala.
- Reakcije propagacije su reakcije u kojima se totalni broj slobodnih radikala ne menja.
- Reakcije terminacije dovode do umanjenja broja slobodnih radikala. Tipično dva slobodna radikala formiraju stabilnije vrste, npr.: 2Cl·→ Cl2
Nastajanje
[uredi | uredi izvor]
Radikali nastaju delovanjem:
- visoke temperature (termolitičko raspadanje veza)
- ultraljubičastog zračenja, koje deluje tako što se kovalentne veze homolitički raspadaju (fotoliza)
- rendgenskim i drugim jonizujućim zračenjem
- elektrohemijski putem oksidacije odnosno redukcije
Za iniciranje reakcije radikalizacije pri hemijskim sintezama često se u reakcionu smesu dodaje „starter radikal”. Pri tome se radi o molekulu koji se naročito lahko cepa na radikale, na primer kada se osvetli ultraljubičastim svetlom. Primeri takvih jedinjenja su: azobisizobutironitril, dibenzoilperoksid, dilauroilperoksid, di-tert-butilperoksid, diizopropilperoksidikarbonat i kalijum peroksodisulfat.[4]

Radikali su ili (1) nastali od spin-uparenih molekula ili (2) od drugih radikala. Radikali nastaju od spin-uparenih molekula homolizom slabih veza ili prenosom elektrona, takođe poznatim kao redukcija. Radikali nastaju od ostalih radikala reakcijama supstitucije, adicije i eliminacije.
Formiranje radikala od spin-uparenih molekula
[uredi | uredi izvor]Homoliza
[uredi | uredi izvor]
Homoliza stvara dva nova radikala od spin-uparenog molekula raskidajući kovalentnu vezu, ostavljajući svaki od fragmenata sa jednim od elektrona u vezi.[5] Budući da je za prekid hemijske veze potrebna energija, homoliza se javlja pri dodatku toplote ili svetlosti. Energija disocijacije veza povezana sa homolizom zavisi od stabilnosti datog jedinjenja, i neke slabe veze mogu da se homolizuju na relativno nižim temperaturama.
Neke reakcije homolize su posebno važne jer služe kao inicijator za druge reakcije radikala. Jedan takav primer je homoliza halogena, koja se javlja pod svetlošću i služi kao pokretačka snaga reakcija radikalne halogenizacije.
Još jedna zapažena reakcija je homoliza dibenzoil peroksida, koja rezultira stvaranjem dva benzoiloksi radikala i deluje kao inicijator mnogih radikalnih reakcija.[6]
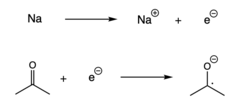
Redukcija
[uredi | uredi izvor]Radikali se takođe mogu formirati kada se jedan elektron doda spin-upareni molekul, što rezultira prenosom elektrona.[7] Ova reakcija, koja se naziva i redukcija, obično se odvija kada alkalni metal donira elektron drugom spin-uparenom molekulu.
Formiranje radikala od drugih radikala
[uredi | uredi izvor]Apstrajcija
[uredi | uredi izvor]

Apstrakcija vodonika opisuje reakciju u kojoj se atom vodonika sa svojim jednim elektronom uklanja sa vodonik donirajućeg molekulom (npr. kalaj ili silicijum hidrid).[8] Apstrakcija proizvodi novi radikal i novi spin-upareni molekul. Ovo se razlikuje od homolize, koja rezultira u dva radikala iz jednog spin-uparenog molekula i ne uključuje radikal kao reaktant. Vodonična apstrakcija je fundamentalni proces u hemiji radikala, jer služi kao završni korak širenja u mnogim hemijskim reakcijama, pretvarajući radikale ugljenika u stabilne molekule. Slika desno prikazuje apstrakciju radikala između benzoiloksi radikala i molekula vodonik bromida, što rezultira proizvodnjom molekula benzojeve kiseline i radika broma.
Adicija
[uredi | uredi izvor]Radikalna adicija opisuje reakciju kada se radikalu doda spin-upareni molekul da bi se formirao novi radikal.[9] Slika desno prikazuje dodavanje radikla broma u alken. Radikalno dodavanje sledi antimarkovnikovljevo pravilo, gde se supstituent dodaje manje supstituisanom atomu ugljenika.
Eliminacija
[uredi | uredi izvor]
Eliminacija radikala se može posmatrati kao reverzna radikalnoj adiciji. U eliminaciji radikala, nestabilno radikalno jedinjenje se raspada u spin-upareni molekul i novo radikalno jedinjenje. Ispod je prikazan primer reakcije eliminacije radikala, gde se benzoiloksi radikal raspada na fenilni radikal i molekul ugljen dioksida.[10]
Reaktivnost
[uredi | uredi izvor]Reaktivni radikali
[uredi | uredi izvor]Većina radikala reaguje egzergono. Oni su izrazito reaktivni i kao takvi vrlo kratko „žive” (kraće od jedne sekunde). Neupareni elektroni obično se pri tom nalaze na atomima ugljenika, azota, kiseonika i žive ili na halogenim elementima.
Nereaktivni radikali
[uredi | uredi izvor]
Poznati su takođe i radikali koji ne reaguju odmah pri nastanku te mogu postojati tokom određenog vremenskog perioda pa čak se mogu i izolovati kao zasebne supstance. Jedan od takvih „stabilnih” radikala jeste trifenilmetil radikal. Kao i drugi nereaktivni radikali, i on se sa svojim dimerom u rastvoru nalazi u ravnoteži. Dimer trifenilmetil radikala nije heksafeniletan, kao što je Gomberg mislio,[11] već 3-difenilmetilen-6-trifenilmetil-cikloheksa-1,4-dien.[12] Faktori koji vode do stabilnih radikala su, prema nekim teorijama rezonantna stabilizacija (mezomerija), a prema drugim „zastoj” u dimerizaciji, na primer putem steričnih, sofisticiranih supstituenata. Stabilni radikali pronađeni su i u prirodi. Tako na primer enzim ribonukleotidreduktaza sadrži tirozil radikal čije vreme poluraspada iznosi oko četiri dana.
Ugljenikovi radikali
[uredi | uredi izvor]Radikali u čijem središtu se nalazi atom ugljenika pokazuju povećanje stabilnosti sledećim redom: primarni C atom < sekundarni < tercijarni, što je posledica induktivnog efekta i hiperkonjugacije. Osim toga ugljenikov radikal sa sp³ hibridizovanom orbitalom stabilni je od radikalnog centra, u kojem je ugljenik iskazuje sp² ili sp hibridizaciju. Aril ili alil grupe takođe stabilizuju radikale.
Primeri
[uredi | uredi izvor]- Molekularni kiseonik O2 – ova molekula kiseonika sadrži dva nesparena elektrona (biradikal •O-O•; prema Luisovoj formuli O=O daje situaciju vezivanja koja nije potpuna niti je u potpunosti tačna) a nastaje u magnetnom polju kao paramagnetni triplet. Iako su mogućnosti reagovanja ovog biradikala ograničene, jer po principu održanja spina pri hemijskim reakcijama u većini slučajeva je potrebno da se prethodno pobude do singleta kiseonika.
- Azot monoksid •NO – radikal poznat kao supstanca za prenos signala u organizmu. Azot monoksid je sastavni deo nitroznih gasova.
- Hidroksil radikal •OH – jedan od najreaktivnijih i najznačajnijih radikala u atmosferi (važan pri razgradnji supstanci koje zagađuju atmosferu)
- Radikali hlora Cl• – nastaju homolitičkim raspadom veze između dva atoma u molekularnom hloru (Cl2) i veoma su reaktivni međuproizvod pri fotohlorisanju alkana kao i hlorisanju bočnih lanaca aromatskih jedinjenja sa supstituisanim alkil grupama. Ovi radikali se otpuštaju i delovanjem svetlosti na hlorofluorougljenike i učestvuju u razaranju ozonskog omotača.
- Radikali broma Br• – nastaju homolitičkim raspadom veza između dva atoma u molekularnom bromu (Br2) i veoma su reaktivni međuproizvod pri fotobromiranju alkana kao i bromiranju bočnih lanaca aromatskih jedinjenja sa supstituisanim alkil grupama
- TEMPO – stabilni organski radikal, koji se između ostalog koristi i kao oksidaciono sredstvo
U biologiji
[uredi | uredi izvor]Radikali, tačnije reaktive vrste kiseonika, igraju važnu ulogu u brojnim biološkim procesima, a neki od njih mogu i izazvati oštećenja ćelija, što između ostalog može dovesti i do razvoja kancerogenih oboljenja. Oksidativni procesi raznih supstanci u organizmu, koji se odvijaju pod uticajem slobodnih radikala, po mnogim mišljenjima odgovorni su za nastanak arteroskleroze, Alchajmerove bolesti, oštećenja jetre izazvane unosom alkohola u organizam kao i emfizem zbog korištenja duvanskih proizvoda. Od unutarćelijskih signalnih puteva, koji se aktiviraju slobodnim radikalima, signalni put NF-κB je jedan od najznačajnijih.
Zaštita od delovanja radikala je od životne važnosti za organizam, pa zbog toga telo sadrži vrlo efikasne odbrambene mehanizme i mehanizme koje mu omogućavaju popravak u obliku enzima, hormona i drugih supstanci, koje umanjuju i sprečavaju štetno delovanje radikala. Među tim odbrambenim mehanizmima su antioksidansi poput epigalokatehin galata, superoksid dismutaze, vitamina A, C i E; koenzima Q10; flavonoida poput taksifolina[13] i antocijanina. Osim ovih, smatra se da bilirubin i mokraćna kiselina takođe mogu neutralizovati slobodne radikale. Hormon melatonin važi za supstancu koja „hvata” radikale odgovorne za oksidativni stres. Jedan od najsnažnijih poznatih antioksidansa, hidridni jon H−, igra važnu ulogu u ciklusu limunske kiseline kao i u mnogim metaboličkim redoks-reakcijama.
U okvirima „teorije starenja”, slobodni radikali igraju ulogu u procesima starenja organizma. Prema toj teoriji,[14] radikali se proučavaju kao delujuće supstance protiv oksidativnog stresa „odgovornog” za starenje. Istraživanja su pokazala da su ćelije ptica značajno otpornije na delovanje slobodnih radikala. Međutim, pošto je proučavan samo uticaj sintetičkih antioksidanasa, ne bi trebalo izvoditi zaključke o mogućim efektima konzumiranja voća i povrća. Godine 2007. uredništvo Žurnala Američkog medicinskog društva (AMA) pozvalo je na daljnja ispitivanja delovanja radikala kako bi se utvrdili efekti vitamina C i selena na starenje.[15] Veoma detaljna i nekoliko puta ažurirana analiza britanskog udruženja Kokran (2007–2012) mogla bi pružiti konačan dokaz da nema pozitivnih efekata prehrambenih dodataka (suplemenata) koji sadrže vitamin C; čak suprotno, smrtnost u proučavanoj grupi osoba bila je neznatno veća od smrtnosti kontrolne grupe.[16]
Reference
[uredi | uredi izvor]- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Morrison Robert Thornton; Boyd Robert Neilson (2006). Organic chemistry. Engelwood Cliffs, New Jersey: Prentice Hall. ISBN 8120307658.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ M. D. Lechner; K. Gehrke; E. H. Nordmeier (2009). Makromolekulare Chemie (на језику: немачки) (4 изд.). Birkhäuser Verlag. стр. 54. ISBN 978-3-7643-8890-4.
- ^ Clayden, Jonathan. (2012). Organic chemistry. Greeves, Nick., Warren, Stuart G. (2nd изд.). Oxford: Oxford University Press. ISBN 978-0-19-927029-3. OCLC 761379371.
- ^ „Diacyl Peroxides”. polymerdatabase.com. Приступљено 2020-12-08.
- ^ „IV. Nonchain Reactions: Radical Formation by Electron Transfer”. Chemistry LibreTexts (на језику: енглески). 2015-01-21. Приступљено 2020-12-08.
- ^ „II. Atom Abstraction”. Chemistry LibreTexts (на језику: енглески). 2015-01-11. Приступљено 2020-12-08.
- ^ „Radical Additions: Anti-Markovnikov Product Formation”. Chemistry LibreTexts (на језику: енглески). 2013-10-02. Приступљено 2020-12-08.
- ^ Su, Wei-Fang (2013), Su, Wei-Fang, ур., „Radical Chain Polymerization”, Principles of Polymer Design and Synthesis, Lecture Notes in Chemistry (на језику: енглески), Berlin, Heidelberg: Springer, 82, стр. 137—183, ISBN 978-3-642-38730-2, doi:10.1007/978-3-642-38730-2_7

- ^ Gomberg M. (1. 7. 1901). „On Trivalent Carbon.”. Journal of the American Chemical Society (на језику: енглески). 23 (7): 496—502. doi:10.1021/ja02033a015.
- ^ Siegfried Hauptmann (1985). Organische Chemie (2 изд.). Leipzig: VEB Deutscher Verlag für Grundstoffindustrie. стр. 281. ISBN 3-342-00280-8.
- ^ Yu. A. Vladimirov; E. V. Proskurnina; E. M. Demin; N. S. Matveeva; O. B. Lubitskiy; A. A. Novikov; D. Yu. Izmailov; A. N. Osipov; V. P. Tikhonov; V. E. Kagan (2009). „Dihydroquercetin (taxifolin) and other flavonoids as inhibitors of free radical formation at key stages of apoptosis”. Biochemistry (Moskva). 74 (3): 301—307. PMID 19364325. doi:10.1134/S0006297909030092.
- ^ Kenneth B. Beckmann; Bruce N. Ames (1. 4. 1998). „The Free Radical Theory of Aging Matures”. Phys. Rev. 78 (2): 547—581. doi:10.1152/physrev.1998.78.2.547.
- ^ Goran Bjelakovic; Dimitrinka Nikolova; Lise Lotte Gluud; Rosa G. Simonetti; Christian Gluud (28. 1. 2007). „Mortality in Randomized Trials of Antioxidant Supplements for Primary and Secondary Prevention”. JAMA: The Journal of the American Medical Association. 297 (8): 842—857. doi:10.1001/jama.297.8.842.
- ^ G. Bjelakovic; D. Nikolova; L. L. Gluud; R. G. Simonetti; C. Gluud (2012). „Antioxidant supplements for prevention of mortality in healthy participants and patients with various diseases”. Cochrane database of systematic reviews (Online). 3: CD007176. ISSN 1469-493X. PMID 22419320. doi:10.1002/14651858.CD007176.pub2.

