Etan
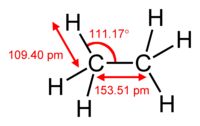
| |||
| |||
| |||
| Nazivi | |||
|---|---|---|---|
| Preferisani IUPAC naziv
Etan[1] | |||
| Sistemski IUPAC naziv
Dikarben (nije preporučeno[1]) | |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| Bajlštajn | 1730716 | ||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.741 | ||
| EC broj | 200-814-8 | ||
| Gmelin Referenca | 212 | ||
| MeSH | Ethane | ||
| RTECS | KH3800000 | ||
| UNII | |||
| UN broj | 1035 | ||
| |||
| |||
| Svojstva | |||
| C2H6 | |||
| Molarna masa | 30,07 g·mol−1 | ||
| Agregatno stanje | Bezbojan gas | ||
| Miris | Bez mirisa | ||
| Gustina |
544,0 kg/m−3 (течност на -88,5 °C) | ||
| Tačka topljenja | −182,8 °C; −296,9 °F; 90,4 K | ||
| Tačka ključanja | −88,5 °C; −127,4 °F; 184,6 K | ||
| 56,8 mg L−1[5] | |||
| Napon pare | 3,8453 MPa (na 21,1 °C) | ||
| kH | 19 nmol Pa−1 kg−1 | ||
| Kiselost (pKa) | 50 | ||
| Baznost (pKb) | -36 | ||
| Konjugovana kiselina | Etanijum | ||
| Magnetna susceptibilnost | -37,37·10−6 cm³/mol | ||
| Termohemija | |||
| Specifični toplotni kapacitet, C | 52,49 J K−1 mol−1 | ||
Standardna entalpija
stvaranja (ΔfH |
−84 kJ mol−1 | ||
Std entalpija
sagorevanja (ΔcH⦵298) |
−1561,0–−1560,4 kJ mol−1 | ||
| Opasnosti | |||
| Bezbednost prilikom rukovanja | inchem.org | ||
| GHS piktogrami | 
| ||
| GHS signalne reči | Opasnost | ||
| H220, H280 | |||
| P210, P410+403 | |||
| NFPA 704 | |||
| Tačka paljenja | −135 °C (−211 °F; 138 K) | ||
| 472 °C (882 °F; 745 K) | |||
| Eksplozivni limiti | 2.9–13% | ||
| Srodna jedinjenja | |||
Srodna alkani
|
|||
Srodna jedinjenja
|
|||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |||
| Reference infokutije | |||
Etan je zasićeni ugljovodonik iz homologog reda alkana sa molekulskom formulom C2H6. Pri standardnoj temperaturi i pritisku, etan je bezbojan, bezmirisan gas. Etan se u prirodi javlja kao jedan od sastojaka zemnog gasa. Dobija se iz produkata prerade nafte i kamenog uglja. Njenova glavna primena je kao sirovina za produkciju etilena.
Srodna jedinjenja mogu biti formirana zamenom atoma vodonika sa drugom funkcionalnom grupom; etanski deo većeg molekula se naziva etil grupa. Na primer, etilna grupa povezana sa hidroksilnom grupom daje etanol, alkohol u napicima.
Istorija[uredi | uredi izvor]

Etan je prvi put sintetisao 1834 godine Majkl Faradej, koristeći elektrolizu rastvora kalijum acetata. On je pogrešno smatrao da je ugljovodonični proizvod ove reakcije metan i nije to dalje istraživao.[7] Tokom perioda 1847–1849, u nastojanju da potvrde teoriju radikala organske hemije, Herman Kolbe i Edvard Frankland proizveli su etan redukcijom propionitrila (etil cijanida)[8] i etil jodida[9] kalijumovim metalom, i kao Faradej, putem elektrolize vodenih acetata. Međutim, oni su pogrešno smatrali da je proizvod reakcije metil radikal, a ne dimer metila, etan. Ovu grešku je 1864. godine ispravio Karl Šorlemer, koji je pokazao da je proizvod svih ovih reakcija zapravo etan.[10] Etan je oktrio rastvoren u pensilvanijskoj lakoj nafti Edmund Ronalds 1864. godine.[11][12]
Naziv etan je izveden iz IUPAC nomenklature organske hemije. „Et” je izvedeno iz nemačke reči za pitki alkohol (etanol),[13] a „-an” ukazuje na prisustvo jednostruke veze između atoma ugljenika.
Osobine[uredi | uredi izvor]
Na standardnoj tempreraturi i pritisku, etan je bezbojan, bezmirisan gas. On ima tačku ključanja od −88,5 °C (−127,3 °F) i tačku topljenja od −182,8 °C (−297,0 °F). Čvrsti etan postoji u nekoliko alotropskih modifikacija.[14] Pri hlađenju pod normalnim pritiskom, prva modifikacija koja se pojavljuje je plastični kristal, koji se kristalizuje u kubnom sistemu. U toj formi, pozicije atoma vodonika nisu fiksne; molekuli mogu slobodno da rotiraju oko duge ose. Hlađenjem etana ispod oko 89,9 K (−183,2 °C; −297,8 °F) dovodi do prelaza u monoklinički metastabilni etan II (prostorna grupa P 21/n).[15] Etan je u veoma maloj meri rastvoran u vodi.
Hemija[uredi | uredi izvor]
Etan se može posmatrati kao dve spojene metil grupe, tj. dimer metil grupa. U laboratoriji, etan može biti sintetisan Kolbeovom elektrolizom. U ovoj tehnici, vodeni rastvor acetatne soli se elektrolizuje. Na anodi, acetat se oksiduje da bi se proizveli ugljen dioksid i metil radikali, i visoko reaktivni metil radikali se udružuju da bi proizveli etan:
Sinteza oksidacijom anhidrida sirćetne kiseline peroksidima je konceptualno slična.
Hemija etana uključuje uglavnom reakcije slobodnih radikala. Etan može da reaguje sa halogenima, posebno hlorom i bromom, putem halogenacije slobodnih radikala. Ova reakcija se odvija putem propagacije etil radikala:
Budući da halogenirani etani mogu da podlegnu daljoj halogenaciji slobodnim radikalima, ovaj proces dovodi do mešavine nekoliko halogenisanih proizvoda. U hemijskoj industriji se koriste selektivnije hemijske reakcije za formiranje bilo kog haloalkana sa dva ugljenika.
Sagorevanje[uredi | uredi izvor]
Kompletnim sagorevanjem etana oslobađa se 1559,7 kJ/mol, ili 51,9 kJ/g, toplote, i nastaje ugljen dioksid i voda prema hemijskoj jednačini
Sagorevanje se isto tako može odvijati bez viška kiseonika, pri čemu se formira smeša amorfnog ugljenika i ugljen monoksida.
- 2 C2H6 + 3 O2 → 4 C + 6 H2O + energija
- 2 C2H6 + 5 O2 → 4 CO + 6 H2O + energija
- 2 C2H6 + 4 O2 → 2 C + 2 CO + 6 H2O + energija itd.
Sagorevanje se odvija putem kompleksne serije reakcija slobodnih radikala. Računarske simulacije hemijske kinetike sagorevanja etana obuhvataju stotine reakcija. Jedna važna serija reakcija u sagorevanju etana je kombinovanje etil radikala sa kiseonikom, i naknadni raspad rezultirajućeg peroksida u etoksi i hidroksil radikale.
Glavni proizvodi koji sadrže ugljenik nepotpunog sagorevanja etana su jedinjenja ugljenika kao što su ugljen monoksid i formaldehid. Jedan važan put kojim se ugljenik-ugljenik veza u etanu razlaže, čime se dobijaju ti jednougljenični proizvodi, je razgradnja etoksi radikala u metil radikal i formaldehid, koji se opet mogu podvrgnuti daljoj oksidaciji.
- C2H5O• → CH3• + CH2O
Neki od manje zastupljenih produkata u nepotpunom sagorevanju etana su acetaldehid, metan, metanol, i etanol. Na višim temperaturama, a posebno u opsegu 600—900 °C (1.112—1.652 °F), etilen je značajan pridukat. On nastaje putem reakcija kao što je ova:
Slične reakcije (sa drugim agensim, osim kiseonika, kao vodonični apstraktor) se odvijaju u produkciji etilena iz etana u parnom krekovanju.
Etanska barijera[uredi | uredi izvor]
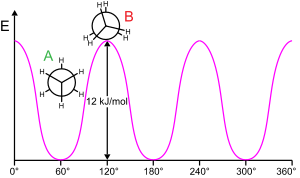
Rotacija molekularne podstrukture oko rotirajuće veze obično zahteva energiju. Minimalna energija za proizvodnju rotacije od 360 stepeni naziva se rotaciona barijera.
Etan pruža klasičan, jednostavan primer takve rotacione barijere, koja se ponekad naziva „etanskom barijerom”. Među najranijim eksperimentalnim dokazima ove barijere (pogledajte dijagram levo) su oni dobijeni modelovanjem entropije etana.[17] Tri vodonika na svakom kraju su slobodna da se vrte oko centralne veze ugljenik-ugljenik kada im se obezbedi dovoljna energija za prevazilaženje barijere. Fizičko poreklo barijere još uvek nije potpuno rešeno,[18] iako je preklapanje (razmena) odbijanja[19] između atoma vodonika na suprotnim krajevima molekula možda najjači kandidat, sa stabilizirajućim efektom hiperkonjugacije na raspoređenoj konformaciji koja doprinosi fenomenu.[20] Teorijske metode koje koriste odgovarajuću polaznu tačku (ortogonalne orbitale) potvrđuju da je hiperkonjugacija najvažniji faktor u nastanku barijere rotacije etana.[21][22]
Još su tokom perioda 1890-1891 hemičari predložili da molekuli etana preferiraju raspoređenu konformaciju sa krajevima molekula udaljenim jedani od drugih.[23][24][25][26]
Produkcija[uredi | uredi izvor]
Posle metana, etan je druga po veličini komponenta prirodnog gasa. Prirodni gas iz različitih gasnih polja varira u sadržaju etana od manje od 1% do više od 6% po zapremini. Pre 1960-ih, etan i veći molekuli obično nisu bili odvajani od metanske komponente prirodnog gasa, već su jednostavno sagorevani zajedno s metanom kao gorivom. Danas je etan važna petrohemijska sirovina i odvaja se od ostalih komponenti prirodnog gasa u većini dobro razvijenih gasnih polja. Etan se takođe može odvojiti iz naftnog gasa, mešavine gasovitih ugljovodonika koji se proizvode kao nusproizvod prerade nafte. Međutim, ekonomija izgradnje i operacije pogona za preradu može da bude promenjena. Ako relativna vrednost slanja neprerađenog prirodnog gasa potrošaču prevazilazi vrednost ekstrakcije etana, moguće je da se ekstrakcija etana ne vrši, što može da dovede do operativnih problema pri primeni gasa izmenjenog kvaliteta u nizvodnim sistemima.
Etan se najefikasnije odvaja od metana utečnjavanjem na kriogenskim temperaturama. Postoje različite strategije hlađenja: najekonomičniji proces koji se trenutno koristi u širokoj upotrebi koristi turboekspander, i može povratiti više od 90% etana u prirodnom gasu. U ovom procesu, ohlađeni gas se ekspandira kroz turbinu, smanjujući temperaturu na oko −100 °C (−148 °F). Na ovoj niskoj temperaturi, gasoviti metan se može izdvojiti iz tečnog etana i težih ugljovodonika destilacijom. Daljom destilacijom se zatim razdvaja etan od propana i težih ugljovodonika.
Laboratorijski se dobija elektrolizom koncentrovanog rastvora acetata:
Reference[uredi | uredi izvor]
- ^ a b Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. str. 4. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001. „Similarly, the retained names ‘ethane’, ‘propane’, and ‘butane’ were never replaced by systematic names ‘dicarbane’, ‘tricarbane’, and ‘tetracarbane’ as recommended for analogues of silane, ‘disilane’; phosphane, ‘triphosphane’; and sulfane, ‘tetrasulfane’.”
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ „Ethane – Compound Summary”. PubChem Compound. USA: National Center for Biotechnology Information. 16. 9. 2004. Pristupljeno 7. 12. 2011.
- ^ Lide, D. R., ur. (2005). CRC Handbook of Chemistry and Physics (86th izd.). Boca Raton (FL): CRC Press. str. 8.88. ISBN 0-8493-0486-5.
- ^ „Le coq”. elysee.fr (na jeziku: francuski). 16. 11. 2012. Pristupljeno 29. 8. 2023.
|first1=zahteva|last1=u Authors list (pomoć) - ^ Faraday, Michael (1834). „Experimental researches in electricity: Seventh series”. Philosophical Transactions. 124: 77—122. doi:10.1098/rstl.1834.0008.
- ^ Kolbe, Hermann; Frankland, Edward (1849). „On the products of the action of potassium on cyanide of ethyl”. Journal of the Chemical Society. 1: 60—74. doi:10.1039/QJ8490100060.
- ^ Frankland, Edward (1850). „On the isolation of the organic radicals”. Journal of the Chemical Society. 2 (3): 263—296. doi:10.1039/QJ8500200263.
- ^ Schorlemmer, Carl (1864). „Ueber die Identität des Aethylwasserstoffs und des Methyls”. Annalen der Chemie und Pharmacie. 132 (2): 234. doi:10.1002/jlac.18641320217.
- ^ Roscoe, H.E.; Schorlemmer, C. (1881). Treatise on Chemistry. 3. Macmillan. str. 144—145.
- ^ Watts, H. (1868). Dictionary of Chemistry. 4. str. 385.
- ^ „the definition of ethyl”. Dictionary.com. Pristupljeno 12. 3. 2016.
- ^ Van Nes, G.J.H.; Vos, A. (1978). „Single-crystal structures and electron density distributions of ethane, ethylene and acetylene. I. Single-crystal X-ray structure determinations of two modifications of ethane” (PDF). Acta Crystallographica Section B. 34 (6): 1947. doi:10.1107/S0567740878007037.
- ^ „Ethane as a solid”. Paarpraxis-rheinmain.de. Arhivirano iz originala 10. 5. 2017. g. Pristupljeno 16. 12. 2016.
- ^ J, McMurry (2012). Organic chemistry (8 izd.). Belmont, CA: Brooks. str. 95. ISBN 9780840054449.
- ^ Kemp, J. D.; Pitzer, Kenneth S. (1937). „The Entropy of Ethane and the Third Law of Thermodynamics. Hindered Rotation of Methyl Groups”. Journal of the American Chemical Society. 59 (2): 276. doi:10.1021/ja01281a014.
- ^ Ercolani, G. (2005). „Determination of the Rotational Barrier in Ethane by Vibrational Spectroscopy and Statistical Thermodynamics”. J. Chem. Educ. 82 (11): 1703—1708. Bibcode:2005JChEd..82.1703E. doi:10.1021/ed082p1703.
- ^ Pitzer, R.M. (1983). „The Barrier to Internal Rotation in Ethane”. Acc. Chem. Res. 16 (6): 207—210. doi:10.1021/ar00090a004.
- ^ Mo, Y.; Wu, W.; Song, L.; Lin, M.; Zhang, Q.; Gao, J. (2004). „The Magnitude of Hyperconjugation in Ethane: A Perspective from Ab Initio Valence Bond Theory”. Angew. Chem. Int. Ed. 43 (15): 1986—1990. doi:10.1002/anie.200352931.
- ^ Pophristic, V.; Goodman, L. (2001). „Hyperconjugation not steric repulsion leads to the staggered structure of ethane”. Nature. 411 (6837): 565—8. PMID 11385566. doi:10.1038/35079036.
- ^ Schreiner, P. R. (2002). „Teaching the right reasons: Lessons from the mistaken origin of the rotational barrier in ethane”. Angewandte Chemie International Edition. 41 (19): 3579—81, 3513. PMID 12370897. doi:10.1002/1521-3773(20021004)41:19<3579::AID-ANIE3579>3.0.CO;2-S.
- ^ Bischoff, CA (1890). „Ueber die Aufhebung der freien Drehbarkeit von einfach verbundenen Kohlenstoffatomen”. Chem. Ber. 23: 623. doi:10.1002/cber.18900230197.
- ^ Bischoff, CA (1891). „Theoretische Ergebnisse der Studien in der Bernsteinsäuregruppe”. Chem. Ber. 24: 1074. doi:10.1002/cber.189102401195.
- ^ Bischoff, CA (1891). „Die dynamische Hypothese in ihrer Anwendung auf die Bernsteinsäuregruppe”. Chem. Ber. 24: 1085. doi:10.1002/cber.189102401196.
- ^ Bischoff, C.A.; Walden, P. (1893). „Die Anwendung der dynamischen Hypothese auf Ketonsäurederivate”. Berichte der deutschen chemischen Gesellschaft. 26 (2): 1452. doi:10.1002/cber.18930260254.





