Портал:Fizička hemija/Izabrani članak
Izabrani članci [uredi izvor]
Januar[uredi izvor]

Cirkularni dihroizam (CD) zasniva se na različitoj apsorpciji desno i levo kružno polarizovane svetlosti koja je posledica strukturne asimetrije. Uređene strukture imaju CD signale dok neuređene nemaju. CD spektroskopija je metoda koja se koristi za utvrđivanje optičke izomerije molekula, a i za određivanje sekundarne i tercijarne strukture proteina.
Februar[uredi izvor]
Rendgenska strukturna analiza (RSA) je tehnika za ispitivanje kristalnih supstanci, koja koristi difrakcionu sliku (difraktogram) dobijenu rasejavanjem rendgenskog zračenja (X-зрачења) na ispitivanom kristalu. Osnovni cilj RSA je određivanje kristalne i molekulske strukture (dužine veza između atoma, uglovi među vezama, apsolutne konformacije...) ispitivanog uzorka.
Rendgenskom strukturnom analizom moguće je odrediti strukturu velikog broja jedinjenja, koja se mogu naći u kristalnom obliku. Za složenija jedinjenja, kao što su različiti makromolekuli (DNK, proteini) potrebno je kombinovati ovako dobijene rezultate sa rezultatima dobijenim drugim analitičkim tehnikama, kao što je nuklearna magnetna rezonancija (NMR), i računarskim simulacijama da bi se dobila jasna slika o strukturi datih jedinjenja.
Kristalna struktura i mikrostruktura su u uskoj vezi s fizičkim i hemijskim svojstvima supstancije, pa je važnost rendgenske strukturne analize velika u nizu grana ljudske delatnosti. Utoliko je rentgenska strukturna analiza našla brojne primene u fizici i hemiji čvrstog stanja, hemiji, kristalohemiji, biohemiji, mineralogiji i biologiji, a izuzetnu primjenu ima u metalurgiji, keramičkoj, farmaceutskoj i uopšte hemijskoj industriji.
Mart[uredi izvor]

Hormon (od Grčkog όρμή - pokrenuti, probuditi) je hemijski je hemijski glasnik između ćelija (ili grupe ćelija). To su organska jedinjenja različite hemijske prirode, koja deluju u malim količinama. Njihovo delovanje je specifično pa nedostatak dovodi do karakterističnih promena u organizmu. Svi višećelijski organizmi organizmi proizvode hormone (uključujući biljke - (fitohormoni)).
Funkcija hormona je da služi kao signal do ciljne ćelije; aktivnost hormona je determinisana načinom sekrecije i prenosnim signalom primajućeg tkiva. Hemijski glasnici, koje sintetizuju neuroni čine neuro-hormone, a druge posebne ćelije sintetizuju "klasične" hormone. Najpoznatiji životinjski hormoni su proizvedeni u endokrinim žlezdama kičmenjaka, ali hormoni se proizvode u skoro svakom organskom sistemu i tkivu u životinjskom telu.
April[uredi izvor]
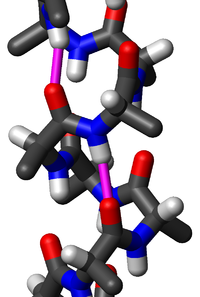
Alfa heliks (α-heliks) je desnogira zavojita konformacija koja podseća na oprugu, kod koje svaka alfa-amino (N–H) grupa stvara vodoničnu vezu sa alfa-karbosilnom (C=O) grupom aminokiseline 4 ostatka ranije ( vodonična veza).
Polipeptidni lanac može formirati različite vrste heliksa koje se razlikuju po broju uvijanja lanca i po razmaku između uvijenih segmenata polipeptida u heliksu. One se obrazuju spontano, jer su energetski najsiromašnije, a time i najstabilnije konformacije proteina. Heliks mogu da obrazuju i L- i D-aminokiseline, ali samo jedne ili druge jer heliks ne može da se obrazuje od peptidnog lanca koji sadrži smešu ostataka L- i D-aminokiselina. Heliksi mogu biti desnogiri i levogiri, zavisno od toga na koju stranu se uvrće proteinski lanac; desnogiri heliks je određen pravcem u kome se okreću prsti desne ruke kada se palac postavi na osu heliksa u pravcu u kome se on gradi. L-aminokiseline su češće u prirodi i one mogu da obrazuju i levogiri i desnogiri heliks, ali većina poznatih heliksa u prirodi su desnogiri. Međutim, samo jedna heliksna konformacija istovremeno zadovoljava optimalne uslove uvijanja koja daje osnovu za lako uspostavljanje intramolekulskih vodoničnih veza između bliskih konstituenata peptidne veze. Ta forma se naziva α-heliks i najčešće je prisutna u proteinima živih sistema.
Maj[uredi izvor]
Nuklearno magnetno rezonantna spektroskopija (NMR) je svestrana spektroskopska disciplina koja može da registruje signale atoma iz različitih položaja u molekulu i pri tome da svaki signal dovede u vezu sa nekom od poznatih spinskih interakcija, glavnim izvorima podataka o molekulskoj strukturi i dinamici. NMR spektroskopija je danas, uz rendgeno-strukturnu analizu (kristalografiju x-zraka), jedina metoda kojom može da se odredi struktura biopolimera sa razlaganjem na atomskom nivou.
Juni[uredi izvor]
Anfinsenova hipoteza (takođe poznata i kao termodinamička hipoteza) je postulat u biofizičkoj hemiji postavljen od strane američkog hemičara Kristijana B. Anfinsena. Hipoteza tvrdi da je, bar za male globularne proteine, nativna konformacija određena minimumom Gibsove slobodne energije sistema i tako predstavlja, termodinamički gledano, najstabilniju konformaciju. Iz ove hipoteze sledi da je nativnu konformaciju proteina moguće odrediti polazeći samo od primarne aminokiselinske sekvence i opštih fizičko-hemijskih principa. Anfinsen je zajedno sa saradnicima došao do gore iznesenih zaključaka nakon niza eksperimenata izvedenih pedesetih godina dvadesetog veka i za ova otkrića je dobio Nobelovu nagradu 1972. godine.
Juli[uredi izvor]

Enzimska kinetika je oblast koja izučava brzine hemijskih reakcija katalizovanih enzimima. Proučavanje i poznavanje enzimske kinetike daje uvid u mehanizme po kojima se odvijaju ove reakcije. Između ostalog stiče se uvid i u njihovu ulogu u metabolizmu, u to kako je njihova aktivnost kontrolisana u ćelijama i kako droge i otrovi mogu inhibirati njihovu aktivnost.
Enzimi su molekuli koji upravljaju drugim molekulima-enzimskim supstratima. Supstrati se vezuju za aktivno mesto na enzimu i transformišu se u proizvode kroz niz stupnjeva koji čine mehanizam date enzimske reakcije. Neki enzimi mogu vezivati više supstrata i/ili davati više produkata, a primer za to je proteaza koja delujući na jedan protein daje dva polipeptidna proizvoda. Sa druge strane postoje enzimi kao što je DNK polimeraza, koja vezuje nukleotide u DNK. Iako se ovi mehanizmi uglavnom sastoje od velikog broja stupnjeva, jedan karakterističan stupanj određuje ukupnu kinetiku procesa i zove se odlučujući stupanj. Odlučujući stupanj može biti hemijska reakcija ili strukturna promena enzima ili supstrata, koja prati oslobađanje produkta iz enzima.
Poznavanje strukture enzima ima veliki značaj zato što može nagovestiti kako će se tokom katalize vezivati supstrat i enzim, koje promene će se događati tokom reakcije, pa čak i koja je uloga pojedinačnih aminokiselinskih ostataka u mehanizmu.
Avgust[uredi izvor]
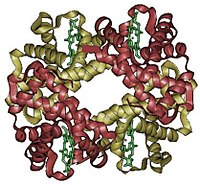
Hemoglobin je metaloprotein za prenos kiseonika koji sadrži gvožđe i nalazi se u crvenim krvnim zrncima kod kičmenjaka. Hemoglobin prenosi kiseonik iz pluća ili škrga u ostale delove tela, kao što su npr. mišići. On povećava prenosni kapacitet za kiseonik u litru krvi sa 5 na 250 ml/l. Hemoglobin ima i ključnu ulogu i pri prenosu CО2 i vodonikovih jona.
Ime hemoglobin se sastoji od reči hem i globin, i na taj način pokazuje da je hemoglobin globularni protein koji sadrži hem grupu. Hem grupa se sastoji od organskog dela i atoma gvožđa koji je odgovoran za vezivanje kiseonika.
Empirijska hemijska formula najčešćeg ljudskog hemoglobina je C2952H4664N812O832S8Fe4.
Septembar[uredi izvor]

Mioglobin je citoplazmatični globularni hemoprotein koji se sastoji od jednog polipeptidnog lanca koji sadrži 154 aminokiseline. To je relativno mali protein, Mr=17.600. Prisutan je u mišićnim ćelijama srca i oksidativnim vlaknima skeletnih mišića. Ime je dobio po mestu nalaženja (grč. myo- označava povezanost sa mišićima) i obliku (globularni protein). Karakteriše ga funkcionalna sličnost sa hemoglobinom. Kao i hemoglobin, i mioglobin vezuje kiseonik (O2) u oba smera i na taj način olakšava transport O2 od crvenih krvnih zrnaca do mitohondrija mišića za vreme pojačane metaboličke aktivnosti, ili može poslužiti kao rezervoar O2 za vreme hipoksije ili anoksije. Za razliku od hemoglobina, monomer mioglobina sa jednim O2 vezujućim mestom, ima hiperboličnu O2-saturacionu krivu karakterističnu za normalnu Mihaelis-Menten enzimsku kinetiku, pravilniju nego sigmoidnu krivu koja je viđena kod tetrameričnog hemoglobina.
Polipeptidni lanac mioglobina je savijen u obliku kolevke, tako da ljulja prostetičnu grupu hem. Vezivanje kiseonika zavisi od oksidacionog stanja gvožđa u hemu. Ono je +2 u hemu i to je oblik koji vezuje kiseonik. Ako Fe pređe iz +2 u +3 oksidaciono stanje nastaće metamioglobin koji ne vezuje kiseonik. Slobodan hem u rastvoru će odmah reagovati sa kiseonikom, ali će kiseonik brzo oksidovati atom gvožđa u Fe3+. Mioglobin obavlja tri kritične funkcije: ljulja hem, štiti gvožđe u hemu od oksidacije i obezbeđuje cep u koji kiseonik može da stane.
Oktobar[uredi izvor]

Proteini su molekuli aminokiselina povezani peptidnom vezom i to određenim redosledom koji se naziva aminokiselinska sekvenca. Pod primarnom strukturom proteina podrazumeva se, osim njegove aminokiselinske sekvence, i broj polipeptidnih nizova iz kojih se molekul datog proteina sastoji, kao i broj i položaj disulfidnih mostova u njemu.
Posle biosinteze proteini podležu procesima post-translacionih modifikacija u kojim dolazi do kovalentnog vezivanja pojedinih komponenti za bočne ostatke aminokiselina. U primarnoj strukturi proteina sadržano je obilje informacija na osnovu kojih su formirani moderni koncepti u biohemiji. Određivanje primarne strukture proteina jedan je od tipičnih poslova kojima se biohemičari bave.
Novembar[uredi izvor]

Kristalna struktura je karakteristika čvrstih tela, koja je određena pravilnom strukturom čestica od kojih je telo građeno. Ovakva čvrsta tela čiji su atomi ili atomske grupe pravilno prostorno raspoređene nazivamo kristalima. Pravilnosti postorne raspoređenosti atoma se izražavaju i kod eksternih osobina kristala, npr. kod kristala natrijum hlorida (kuhinjske soli). Vidljivo je da svaki kristal natrijum hlorida predstavlja gotovo savršenu kocku. U ovom slučaju se ta pravilnost proteže na veliki deo, odnosno na celi komad ispitivanog materijala, pa se ta osobona naziva makrokristalnošću, a materijal - monokristal. U protivnom slučaju tj. kada se pravilnost proteže na malu oblast materijala, tada kristalnost postoju u malim razmerama pa se osobina naziva polikristalnošću, a materijal - polikristal. Kristalna struktura daje čvrstim materijalima veću mehaničku čvrstinu, dok sa druge strane nepravilna (amorfna) struktura utiče na žilavost. Proces promene agregatnog stanja supstance, iz tečnog u čvrsto, pri čemu dolazi do formiranja kristala koji imaju pravilnu strukturu se naziva kristalizacija.

