Arsenatna kiselina
| |

| |
| Nazivi | |
|---|---|
| IUPAC naziv
Arsenatna kiselina
| |
| Drugi nazivi
Ortoarsenatna kiselina
Desikant L-10 Zotoks | |
| Identifikacija | |
3D model (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.029.001 |
| KEGG[1] | |
| RTECS | CG0700000 |
| UNII | |
| |
| Svojstva | |
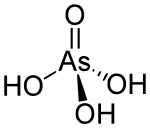
| H3AsO4 | |
| Molarna masa | 141,94 g/mol |
| Agregatno stanje | Beli providni kristali, higroskopni. |
| Gustina | 2,5 g/cm3 |
| Tačka topljenja | 355 °C (671 °F; 628 K) |
| Tačka ključanja | razlaže se ≥ 100 °C |
| 16.7 g/100 mL | |
| Rastvorljivost | rastvorna u alkoholu |
| Kiselost (pKa) | 2.19, 6.94, 11.5 |
| Struktura | |
| Oblik molekula (orbitale i hibridizacija) | Tetraedralna |
| Opasnosti | |
EU klasifikacija (DSD)
|
Toksična (T) Opasna po životnu sredinu (N) |
| R-oznake | R23/25, R45, R50/53 |
| S-oznake | S53, S45, S60, S61 |
| NFPA 704 | |
| Tačka paljenja | Nije zapaljiva |
| Srodna jedinjenja | |
Drugi anjoni
|
Fosforna kiselina |
Drugi katjoni
|
Natrijum arsenat |
Srodna jedinjenja
|
Arsenitna kiselina Arsenik pentoksid |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Arsenatna kiselina je hemijsko jedinjenje sa formulom H3AsO4, ili AsO(OH)3. Ova bezbojna kiselina je arsenični analog fosforne kiseline. Arsenatne i fosfatne soli se slično ponašaju. Samostalna arsenatna kiselina nije izolovana. Ona se može naći u rastvoru, gde je u znatnoj meri jonizovana. Njena hemihidratna forma (H3AsO4·½H2O) formira stabilne kristale. Kristali se mogu dehidrisati kondenzacijom na 100 °C.[2]
Osobine[уреди | уреди извор]
Kristali arsenatne kiseline imaju tetraedralnu simetriju C3v sa dužinom As-O veza u rasponu od 1.66 do 1.71 Å.[3]
Ona je triprotonska kiselina, te se njena kiselost opisuje sa tri ravnoteže:
- H3AsO4 ⇌ H2AsO−4 + H+ (K1 = 10−2.19)
- H2AsO−4 ⇌ HAsO2−4 + H+ (K2 = 10−6.94)
- HAsO2−4 ⇌ AsO3−4 + H+ (K3 = 10−11.5)
Ove Ka vrednosti su blizo vrednosti fosforne kiseline. Visoko bazni arsenatni jon (AsO3−4) je proizvod treće jonizacije. Za razliku od fosforne kiseline, arsenatna kiselina je oksidujuća. To se može ilustrovati njenom sposobnošću da konvertuje jodid u jod.
Upotreba[уреди | уреди извор]
Arsenatna kiselina se koristi za zaštitu drveta, kao premaz stakla i metala, i u proizvodnji organskih arsenovih jedinjenja.
Reference[уреди | уреди извор]
- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Holleman A. F.; Wiberg E. (2001). Inorganic Chemistry (1st изд.). San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Lee, C.; Harrison, W. T. A. (2007). „Tetraethylammonium dihydrogenarsenate bis(arsenic acid) and 1,4-diazoniabicyclo[2.2.2]octane bis(dihydrogenarsenate) arsenic acid: hydrogen-bonded networks containing dihydrogenarsenate anions and neutral arsenic acid molecules”. Acta Crystallographica. C63 (Pt 7): m308—m311. PMID 17609552. doi:10.1107/S0108270107023967.
Literatura[уреди | уреди извор]
Vidi još[уреди | уреди извор]
- Arsenitna kiselina - H3AsO3

