Органосумпорно једињење
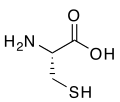
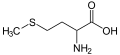
Органосумпорна једињења су органска једињења која садрже сумпор.[1] Она се често асоцирају са материјама лошег мириса, мада су поједини органосумпорни деривати међу најслађим познатим једињењима, е.г., сахарин. Органосумпорна једињења су свеприсутна у природи — сумпор је есенцијалан за живот. Од 20 протеинских аминокиселина, две (цистеин и метионин) су органосумпорна једињења. Сумпор је исто тако присутан у антибиотицима пеницилинима (приказаним доле) и сулфа лековима. Док сумпорни антибиотици спасавају животе, сумпорни Иперит је најсмртоноснији агенс за вођење хемијског рата. Фосилна горива, угаљ, нафта, и природни гас, који су изведени из древних организама, нужно садрже органосумпорна једињења, и њихово уклањање је у главном фокусу рафинерија нафте.
Сумпор и кисеоник припадају халкогеној групи периодног сисстема, заједно са селенијумом и телуром, и стога се очекује да органосумпорна једињења имају слична својства са једињењима угљеника и тих елемената, што је и тачно у извесној мери.
Класични хемијски тест за детекцију сумпорних једињења је Кариусов халогени метод.
Класе органосумпорних једињења[уреди | уреди извор]
Органосумпорна једињења се могу класиковати на основу сумпорне функционалне групе. Категорије су овде (приближно) наведене по реду њихове заступљености.
- Илустративна органосумпорна једињења
-
Алицин, активно једињење укуса дробљеног белог лука
-
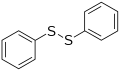
Дифенил дисулфид, репрезентативни дисулфид
-
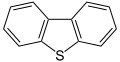
Дибензотиофен, компонента сирове нафте
-
Перфлуорооктансулфонска киселина, контроверзни сурфакант
-
Липоинска киселина, есенцијални кофактор четири митохондријална ензимска комплекса.
-
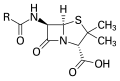
Основна структура пеницилина, где је "Р" варијабилна група.
Тиоетри, тиоестри, тиоацетали[уреди | уреди извор]
Ова једињења карактеришу C−S−C везе[2] У односу на C−C везе, C−S везе су дуже, пошто је атом сумпора већи од атома угљеника, и за око 10% су слабије. Репрезентативне дужине веза у сумпорним једињењима су 183 pm за S−C једноструку везу метантиолу и 173 pm у тиофену. C−S енергија дисоцијације везе за тиометан је 89 kcal/mol (370 kJ/mol) релативно на метанових 100 kcal/mol (420 kJ/mol) и кад се водоник замени метил групом енергија се смањује до 73 kcal/mol (305 kJ/mol).[3] Једнострука веза између угљеника и кисеоника је краћа од Ц−Ц везе. Енергије дисоцијације везе за диметил сулфид и диметил етар су респективно 73 и 77 kcal/mol (305 и 322 kJ/mol).
Тиоетри се типично припремају алкилацијом тиола. Они се могу припремити путем Пумереровог преуређења. У једној именованој реакцији званој Ферарио реакција фенил етар се конвертује у феноксатин дејством елементарног сумпора и алуминијум хлорида.[4]
Тиоацетали и тиокетали садрже C−S−C−S−C низ веза. Они представљају поткласу тиоетара. Тиоацетали су корисни при „инверзији поларности” карбонилних група. Тиоацетали и тиокетали се исто тако могу користити за заштиту карбонилне групе у органској синтези.
Тиоестри имају општу структуру R−CO−S−R. Они су сродни са регуларним естрима, али су реактивнији.
Горње класе сумпорних једињења такође постоје у засићеним и незасићеним хетероцикличним структурама, често у комбинацији са другим хетероатомима, као што је илустровано тиираном, тииреном, тиетаном, тиетом, дитиетаном, тиоланом, тианом, дитианом, тиепаном, тиепином, тиазолом, изотиазолом, и тиофеном, између осталих. Задња три једињења представљају специјалну класу хетероцикличних једињења која садрже сумпор и која су ароматична. Резонантна стабилизација тиофена је 29 kcal/mol (121 kJ/mol) релативно на 20 kcal/mol (84 kJ/mol) за кисеонични аналог фуран. Разлог за постојање ове разлике је већа електронегативност услед кисеоничног одвлачења електрона ка себи на рачун ароматичног прстена. Тио групе у својству ароматичних супституената су мање ефективне као активирајуће групе у односу на алкокси групе. Дибензотиофен (погледајте структурну формулу), трициклично хетероциклично једињење које са састоји од два бензенова прстена спојена са централним тиофенским прстеном, присутно је у знатним количинама у тежим фракцијама нафте, заједно са својим алкил супституисаним дериватима.
Тиоли, дисулфиди, полисулфиди[уреди | уреди извор]
Тиолна група има структуру Р−СХ. Тиоли су структурно слични алкохолној групи, али те две функционалне групе имају веома различита хемијска својства. Тиоли су у већој мери нуклеофилни, киселији, и подложнији оксидацији. Киселост се може разликовати за 5 pKa јединица.[5]
Разлика у електронегативности између сумпора (2,58) и водоника (2,20) је мала и стога водонично везивање није проминентно код тиола. Алифатични тиоли формирају монослојеве на злату, који су значајни у нанотехнологији.
Поједини ароматични тиоли се могу формирати путем Херцове реакције.
Дисулфиди R−S−S−R са ковалентним везом између два атома сумпора су важни за унакрсно повезивање: у биохемији за савиње и стабилност појединих протеина, и у хемији полимера за унакрсно везивање гуме.
Дужи сумпорни ланци су исто тако познати, као што је природни производ варацин, који садржи необични пентатиепински прстен (ланац са 5 атома сумпора циклизован у бензенски прстен).
Сулфоксиди, сулфони и тиосулфинати[уреди | уреди извор]
Сулфоксид, R−S(O)−R је S-оксид тиоетра, сулфон, R−(O)2−R је S,S-диоксид тиоетра, тиосулфинат, R−S(O)−S−R је S-оксид дисулфида, а тиосулфонат, R−S(O)2−S−R је S,S-диоксид дисулфида. Сва ова једињења су добропозната у екстензивним хемијским реакцијама, на пример диметил сулфоксид, диметил сулфон и алицин (види цртеж).
Сулфимиди, сулфоксимиди, сулфондиимини[уреди | уреди извор]
Сулфимиди (звани и сулфилимини) су сумпорно–азотна једињења са структуром R2S=NR′, азотни аналог сулфоксида. Они су интересантни у делу који се односи на фармаколошка својства. Када су две различите R групе везане за сумпор, сулфимиди су хирални. Сулфимиди формирају стабилне α-карбанионе.[6]
Сулфоксимиди (звани и сулфоксимини) су тетракоординатне сумпорно–азотна једињења, изоелектронски са сулфонима, у којима је један атом сулфона замењен супституентом азотом, нпр. R2S(O)=NR′. Када су две различите Р групе везане за сумпор, сулфоксимиди постају хирални. Већи део интереса за ову класу једињења потиче од открића да је метионин-сулфоксимин (метионин-сулфоксимин) инхибитор синтазе глутамина.[7]
Сулфонедиимини, познати и као сулфодиимини, сулфодиимиди или сулфонедиимиди, су тетракоординатна сумпорно–азотна једињења, изоелецтрична са сулфонима. Код њих су атоми кисеоника у сулфону замењена атомом азота, као супституентом, нпр. R2S(=NR′)2. Занимљиви су због њихове биолошке активности и као градивни блокови за хетероцикличну синтезу.[8]
S-Нитрозотиоли[уреди | уреди извор]
S-Нитрозотиоли, познати и као тионитрити, једињења су који садрже нитрозо групу која је везана за тиолски атом сумпора, нпр. R−S−N=O. Значајну пажњу привукли су у биохемији, јер служе као донори нитрозонијум јона, NO+ и азот-оксида, NO, који могу послужити као сигнални молекули у живим системима, посебно у вези са ширењем крвних судова (вазодилатацијом).[9]
Сумпорни халиди[уреди | уреди извор]
Широк је спектар органосумпорних спојева који су познати по садржају једног или више халогенских атома ("X" у хемијским формулама које следе) везан за један атом сумпора, на пример: сулфенил-халиди, RSX; сулфинил-халиди, RS(O)X; сулфонил-халиди, RSO2X; алкил и арилсумпорни трихлориди, RSCl3 и трифлуориди, RSF3;[10] те алкил- и арилсумпорнни пентафлуориди, RSF5.[11] Мање познати су диалкилсумпорни тетрахалиди, претежно као тетрафлуориди, нпр. R2SF4.[12]
Тиокетони, тиоалдехиди и сродна једињења[уреди | уреди извор]
Једињења са двоструким везама између угљеника и сумпора релативно су неуобичајена, али укључују важна једињења угљеник дисулфида, карбонил сулфида и дифосгена. Тиокетони (RC(=S)R') су неуобичајени с алкил супституенатом, али један пример је тиобензофенон. Тиоалдехиди су и даље ређи, што је одраз недостатка просторне заштите („тиоформалдехид” постоји као циклични тример). Тиоамиди, са формулом R1C(=S)N(R2)R3, много су чешћи. Они су обично добијају реакцијом амида с Лавесоновим реагенсом. Изотиоцијанати, с формулом R-N=C=S, налазе се природно. Биљна храна са карактеристичним укусима по изотиоцијанатима укључује васаби, хрен, сенф, ротквицу, прокељ, поточарке (род Tropaeolum) и капаре.
Класе органосумпорних једињења[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ Блоцк, Е. (1978). Реацтионс оф Органосулфур Цомпоундс. Ацадемиц Пресс. ИСБН 978-0-12-107050-2.
- ^ Органиц цхемистрy ИУПАЦ Блуе Боок. Рулес C-5: Цомпоундс Цонтаининг Бивалент Сулфур http://www.acdlabs.com/iupac/nomenclature/79/r79_25.htm
- ^ Хандбоок оф Цхемистрy анд Пхyсицс (81ст изд.). ЦРЦ Пресс. ИСБН 978-0-8493-0481-1.
- ^ Сутер, C. M.; Маxwелл, Цхарлес Е. „Пхеноxтхин [Пхеноxатхиин]”. Орг. Сyнтх. 18: 64. дои:10.15227/оргсyн.018.0064.; Цолл. Вол., 2, стр. 485
- ^ Цремлyн, Р. Ј. (1996). Ан Интродуцтион то Органосулфур Цхемистрy. Цхицхестер: Јохн Wилеy анд Сонс. ИСБН 978-0-471-95512-2.
- ^ Гарцíа Руано, Ј. L.; Цид, M. Б.; Мартíн Цастро, А. M.; Алемáн, Ј. (2008). „Ацyцлиц С,С-Диалкyлсулфимидес”. Ур.: Камбе, Н. Сциенце оф Сyнтхесис. 39. Тхиеме. стр. 352—375. ИСБН 978-1-58890-530-7.
- ^ Драбоwицз, Ј.; Леwкоwски, Ј.; Куделска, W.; Гирек, Т. (2008). „С,С-Диалкyлсулфоxимидес”. Ур.: Камбе, Н. Сциенце оф Сyнтхесис. 39. Тхиеме. стр. 154—173. ИСБН 978-1-58890-530-7.
- ^ Драбоwицз, Ј.; Леwкоwски, Ј.; Куделска, W.; Гирек, Т. (2008). „С,С-Диалкyлсулфонедииминес”. Ур.: Камбе, Н. Сциенце оф Сyнтхесис. 39. Тхиеме. стр. 173—180. ИСБН 978-1-58890-530-7.
- ^ Зханг, Y.; Хогг, Н. (2005). „С-Нитросотхиолс: целлулар форматион анд транспорт”. Фрее Радицал Биол. Мед. 38 (7): 831—838. ПМИД 15749378. дои:10.1016/ј.фреерадбиомед.2004.12.016.
- ^ Браверман, С.; Цхеркинскy, M.; Левингер, С. (2008). „Алкyлсулфур Трихалидес”. Ур.: Камбе, Н. Сциенце оф Сyнтхесис. 39. Тхиеме. стр. 187—188. ИСБН 978-1-58890-530-7.
- ^ Схеппард, W. А. (1962). „Арyлсулфур Пентафлуоридес”. Ј. Ам. Цхем. Соц. 84: 3064–3072. дои:10.1021/ја00875а006.
- ^ Драбоwицз, Ј.; Леwкоwски, Ј.; Куделска, W.; Гирек, Т. (2008). „Диалкyлсулфур Тетрахалидес”. Ур.: Камбе, Н. Сциенце оф Сyнтхесис. 39. Тхиеме. стр. 123—124. ИСБН 978-1-58890-530-7.
Литература[уреди | уреди извор]
- Цремлyн, Р. Ј. (1996). Ан Интродуцтион то Органосулфур Цхемистрy. Цхицхестер: Јохн Wилеy анд Сонс. ИСБН 978-0-471-95512-2.
- Хандбоок оф Цхемистрy анд Пхyсицс (81ст изд.). ЦРЦ Пресс. ИСБН 978-0-8493-0481-1.
- Блоцк, Е. (1978). Реацтионс оф Органосулфур Цомпоундс. Ацадемиц Пресс. ИСБН 978-0-12-107050-2.