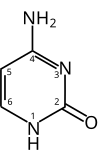
Пиримидин

| |
| Називи | |
|---|---|
| IUPAC назив
Pyrimidine
| |
| Други називи
1,3-Диазин, м-Диазин
| |
| Идентификација | |
3Д модел (Jmol)
|
|
| ECHA InfoCard | 100.005.479 |
| МеСХ | пyримидине |
| |
| Својства | |
| C4H4N2 | |
| Моларна маса | 80,088 |
| Тачка топљења | 20-22 °C |
| Тачка кључања | 123-124 °C |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
Пиримидин је хетероциклично ароматично органско једињење слично бензену и пиридину, које садржи два азотна атома у позицијама 1 и 3 шесточланог прстена.[3][4] Оно је изомерно са двије друге форме диазина.
Нуклеотиди[уреди | уреди извор]
Три нуклеобазе нађене у нуклеинским киселинама, цитозин (C), тимин (T), и урацил (U), су деривати пиримидина:
У молекулима ДНК и РНК ове базе стварају водоничне везе са њиховим комплементарним базама дериватима пурина. Пурински аденин (A) и гуанин (G) стварају водоничну везу са дериватима пиримидина тимином (T) и цитозином (C). У молекулу РНК комплементарна база аденину је урацил (U) умјесто тимина (T) и парови који се формирају су аденин:урацил и гуанин:цитозин.
У ријетким случајевима се тимин појављује у РНК или урацил у ДНК. Осим ове три главне пиримидинске базе, у нуклеинским киселинама се могу наћи неке рјеђе примидинске базе. То су углавном метиловани деривати главних база и доказано је да имају регулаторну функцију.
Ово упаривање база спада у Вотсон-Криково основно упаривање база. Могући су и други начини упаривања у молекулима ДНК и РНК.
Хемијске особине[уреди | уреди извор]
Пиримидин има многе особине које су заједничке са пиридином. Како се број атома азота у прстену повећава π електрони у прстену постају слабији и због тога се теже одигравају реакције електрофилне ароматичне супституције док се нуклеофилна ароматична супституција одиграва лакше. Примјер за ове супституције је замјена амино групе у 2-аминопиримидину са хлором и реакције у обратном смјеру. Смањење резонантне стабилизације електрона у прстену пиримидина доводи да су могуће реакције адиције и цијепања прстена и да се радије одигравају него супституције.
У односу на пиридин N-алкилација и N-оксидација се одигравају теже, исто тако примидини имају мање базне особине: константа дисоцијације за протонизовани пиримидин је 1.23 док је за пиридин 5.30.
Пиримидин је такође нађен у метеорима иако научници још не знају његово поријекло. Пиримидин се такође фотолитички разлаже на урацил под дејством УВ свјетлости.
Органске синтезе[уреди | уреди извор]
Деривати пиримидина могу бити припремљени у лабораторији путем органске синтезе.
Основни метод је реакција одређених амида са нитрилима при чему долази до електрофилне активације амида са 2-хлоро-пиримидином и анхидридом трифлорметаносулфона.
Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Еван Е. Болтон; Yанли Wанг; Паул А. Тхиессен; Степхен Х. Брyант (2008). „Цхаптер 12 ПубЦхем: Интегратед Платформ оф Смалл Молецулес анд Биологицал Ацтивитиес”. Аннуал Репортс ин Цомпутатионал Цхемистрy. 4: 217—241. дои:10.1016/С1574-1400(08)00012-1.
- ^ Катритзкy А.Р.; Позхарскии А.Ф. (2000). Хандбоок оф Хетероцyцлиц Цхемистрy (Сецонд изд.). Ацадемиц Пресс. ИСБН 0080429882.
- ^ Гилцхрист, Тхомас Лонсдале; Гилцхрист, Т. L. (1997). Хетероцyцлиц цхемистрy. Неw Yорк: Лонгман. ИСБН 978-0-582-27843-1.
Литература[уреди | уреди извор]
- Гилцхрист, Тхомас Лонсдале; Гилцхрист, Т. L. (1997). Хетероцyцлиц цхемистрy. Неw Yорк: Лонгман. ИСБН 978-0-582-27843-1.