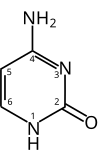
Pirimidin

| |
| Nazivi | |
|---|---|
| IUPAC naziv
Pyrimidine
| |
| Drugi nazivi
1,3-Diazin, m-Diazin
| |
| Identifikacija | |
3D model (Jmol)
|
|
| ECHA InfoCard | 100.005.479 |
| MeSH | pyrimidine |
| |
| Svojstva | |
| C4H4N2 | |
| Molarna masa | 80,088 |
| Tačka topljenja | 20-22 °C |
| Tačka ključanja | 123-124 °C |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Pirimidin je heterociklično aromatično organsko jedinjenje slično benzenu i piridinu, koje sadrži dva azotna atoma u pozicijama 1 i 3 šestočlanog prstena.[3][4] Ono je izomerno sa dvije druge forme diazina.
Nukleotidi
[уреди | уреди извор]Tri nukleobaze nađene u nukleinskim kiselinama, citozin (C), timin (T), i uracil (U), su derivati pirimidina:
U molekulima DNK i RNK ove baze stvaraju vodonične veze sa njihovim komplementarnim bazama derivatima purina. Purinski adenin (A) i guanin (G) stvaraju vodoničnu vezu sa derivatima pirimidina timinom (T) i citozinom (C). U molekulu RNK komplementarna baza adeninu je uracil (U) umjesto timina (T) i parovi koji se formiraju su adenin:uracil i guanin:citozin.
U rijetkim slučajevima se timin pojavljuje u RNK ili uracil u DNK. Osim ove tri glavne pirimidinske baze, u nukleinskim kiselinama se mogu naći neke rjeđe primidinske baze. To su uglavnom metilovani derivati glavnih baza i dokazano je da imaju regulatornu funkciju.
Ovo uparivanje baza spada u Votson-Krikovo osnovno uparivanje baza. Mogući su i drugi načini uparivanja u molekulima DNK i RNK.
Hemijske osobine
[уреди | уреди извор]Pirimidin ima mnoge osobine koje su zajedničke sa piridinom. Kako se broj atoma azota u prstenu povećava π elektroni u prstenu postaju slabiji i zbog toga se teže odigravaju reakcije elektrofilne aromatične supstitucije dok se nukleofilna aromatična supstitucija odigrava lakše. Primjer za ove supstitucije je zamjena amino grupe u 2-aminopirimidinu sa hlorom i reakcije u obratnom smjeru. Smanjenje rezonantne stabilizacije elektrona u prstenu pirimidina dovodi da su moguće reakcije adicije i cijepanja prstena i da se radije odigravaju nego supstitucije.
U odnosu na piridin N-alkilacija i N-oksidacija se odigravaju teže, isto tako primidini imaju manje bazne osobine: konstanta disocijacije za protonizovani pirimidin je 1.23 dok je za piridin 5.30.
Pirimidin je takođe nađen u meteorima iako naučnici još ne znaju njegovo porijeklo. Pirimidin se takođe fotolitički razlaže na uracil pod dejstvom UV svjetlosti.
Organske sinteze
[уреди | уреди извор]Derivati pirimidina mogu biti pripremljeni u laboratoriji putem organske sinteze.
Osnovni metod je reakcija određenih amida sa nitrilima pri čemu dolazi do elektrofilne aktivacije amida sa 2-hloro-pirimidinom i anhidridom triflormetanosulfona.
Vidi još
[уреди | уреди извор]Reference
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Katritzky A.R.; Pozharskii A.F. (2000). Handbook of Heterocyclic Chemistry (Second изд.). Academic Press. ISBN 0080429882.
- ^ Gilchrist, Thomas Lonsdale; Gilchrist, T. L. (1997). Heterocyclic chemistry. New York: Longman. ISBN 978-0-582-27843-1.
Literatura
[уреди | уреди извор]- Gilchrist, Thomas Lonsdale; Gilchrist, T. L. (1997). Heterocyclic chemistry. New York: Longman. ISBN 978-0-582-27843-1.