Дезоксирибонуклеинска киселина

| Биохемија |
|---|
 |
| Кључне компоненте |
| Историја и теме |
| Портали: Биологија, Хемија, MCB |
Дезоксирибонуклеинска киселина (ДНК), нуклеинска је киселина која садржи упутства за развој и правилно функционисање свих живих организама. Заједно са РНК и протеинима, ДНК је један од три главна типа макромолекула који су есенцијални за све познате форме живота. Сва жива бића свој генетички материјал носе у облику ДНК, са изузетком неких вируса који имају рибонуклеинску киселину (РНК). ДНК има веома важну улогу не само у преносу генетичких информација са једне на другу генерацију, већ садржи и упутства за грађење неопходних ћелијских органела, протеина и РНК молекула. ДНК сегмент који преноси ова важна упутства се назива ген.[1]
У еукариотима, организмима као што су животиње, биљке, гљиве и протисте, највећи број ДНК молекула се налази у једру ћелије, а мањи број је у органелама, као што су митохондрије или хлоропласти.[2] У прокариотима (нпр. бактеријама) ДНК се налази у цитоплазми ћелије. За разлику од ензима, ДНК молекул не утиче директно на друге молекуле, већ различити ензими сарађују са ДНК и реализују информације било у облику РНК молекула или у облику протеина. Овакав однос је део централне догме молекуларне биологије.[3]
Ћелије садрже ДНК организован у дуге структуре које се зову хромозоми. Током припреме за ћелијску деобу хромозоми се дуплирају процесом репликације ДНК, тако да свака од новонасталих ћелија има комплетан сет хромозома. У хромозомима, хроматински протеини, као што су хистони, организују ДНК на такав начин да молекул постаје веома компактан и може да стане у ћелије које су на хиљаде пута мање од расплетених ДНК молекула. Ове компактне структуре условљавају интеракције између ДНК и других протеина, и помажу у контролисању делова ДНК који се транскрибују.[4]
ДНК је дугачак полимер, састављен од мањих јединица које се називају нуклеотиди. ДНК се састоји од два полимерна ланца који имају антипаралелну оријентацију. Међусобно повезани нуклеотиди чине скелет ДНК молекула формиран од шећера дезоксирибозе и фосфатних група. Овај скелет такође садржи четири различите нуклеобазе, везане за дезоксирибозу. Редослед ове четири базе је основа кодирања генетичког материјала. Информација се чита користећи генетички код, којим се специфицира секвенца аминокиселина у протеинима. Код се чита копирањем делова ДНК у молекуле РНК у процесу који се назива транскрипција.
Особине[уреди | уреди извор]
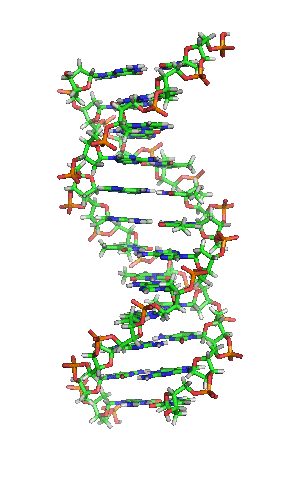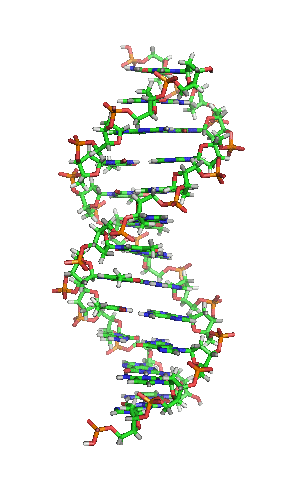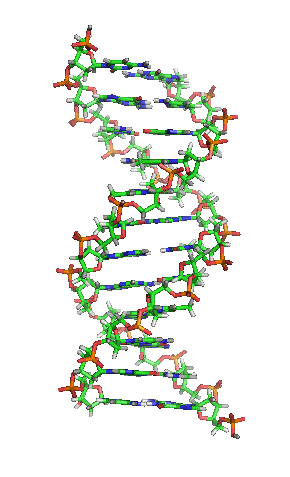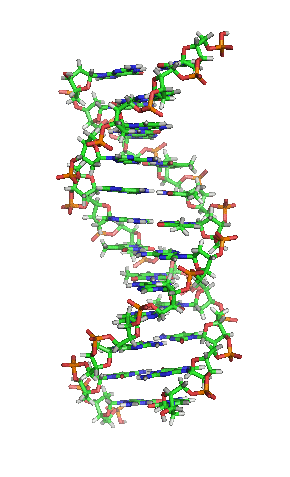

ДНК молекул је дугачак полимер који се састоји од нуклеотида, јединица које се понављају.[6][7][8] Нуклеотиди су веома мале јединице, међутим, ДНК молекул се састоји од милиона нуклеотида, што га чини веома дугим. Највећи људски хромозом се састоји од 440 милиона нуклеотида, односно 220 милиона парова.[9] База која је повезана са шећером назива се нуклеозид, док база која је повезана са шећером и једном или више фосфатних група се назива нуклеотид.[10] Када је више нуклеотида међусобно повезано, као нпр. у ДНК молекулу, тај полимер се онда назива полинуклеотидни ланац.[11]
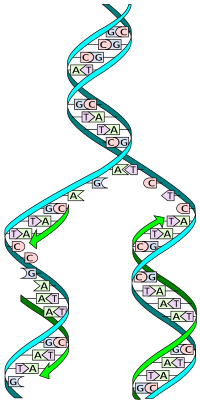
Вотсон и Крик су 1953. показали да је у живим организмима ДНК молекул састављен од два полинуклеотидна ланца који су спирално увијени један око другог. За то откриће су награђени Нобеловом наградом. Вертикална дужина сваког обртаја спирале је 34 ангстрема (3,4 nm) и пречник је 10 ангстрема (1,0 nm).[12][13] Према једној другој студији, када се мерење изврши у одређеном раствору ДНК ланац је 22 до 26 широк ангстрома (2,2 до 2,6 nm), и једна нуклеотидна јединица доприноси дужини са 3,3 Å (0,33 nm).[14]
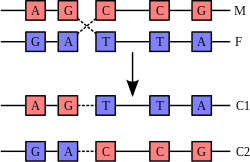
Шећер у ДНК молекулу је пентоза (назван тако јер садржи пет угљеникових атома) 2-дезоксирибоза (РНК молекул се састоји од шећера рибозе, отуда и пун назив рибонуклеинска киселина). Шећери су међусобно повезани фосфатним групама које стварају фосфодиестарску везу између трећег и петог угљениковог атома шећерног прстена. Фосфодиестарске везе су асиметричне, те ДНК полинуклеотидни ланци имају смер. Како ови ланци иду у супротним смеровима, каже се да је ДНК антипаралелна. Асиметрични крајеви ДНК база се означавају са 5' (пет прим) и 3' (три прим). Антипаралелност значи да један ланац иде у смеру 5'→ 3', док супротни ланац иде у смеру 3'→ 5'. Спирални ланац који чини ДНК се одржава у том облику помоћу водоничних веза између парова база.[15] У ДНК молекулу постоје четири базе Аденин (A), Цитозин (C), Гуанин (G) и Тимин (T):[13]
Четири базе су међусобно комплементарне: аденин (A) једног ланца је увек у пару са тимином (T) наспрамног ланца, и повезани су двема водоничним везама. Гуанин (G) једног ланца је увек у пару са цитозином (C) наспрамног ланца, и повезани су трима водоничним везама. Сваки пар база ротира у односу на суседни за 36°, тако да сваки обртај спирале два полинуклеотидна ланца чине десет парова база (A-T и G-C). Полинуклеотидни ланци ротирају у правцу супротном од казаљки на сату.
Базе су подељене у две групе — пуринске (аденин и гуанин) и пиримидинске (цитозин и тимин). Урацил (U) база која се налази у РНК молекулу и која замењује тимин, припада пиримидинској групи. Једина разлика између тимина и урацила је недостатак једне метил-групе код урацила. Урацил је стандардна база РНК молекула, и не постоји као таква у ДНК молекулу. Једини, тренутно познати, изузетак је бактеријски вирус PBS1 који у свом ДНК молекулу има урацил као саставну базу[16]. Осим РНК и ДНК велики број вештачких аналога нуклеинских киселине је креиран ради студирања особина нуклеинских киселина, као и за примену у биотехнологији.[17]
Жлебови[уреди | уреди извор]

Два комплементарна хеликсна ланца формирају основу ДНК молекула. Препознатљив је и двоструки хеликс који прати отворе, или жлебове, између ланаца. Та удубљења су непосредно поред парова база, те могу да служе као места везивања протеина и малих молекула. Пошто ланци нису директно насупрот један другом, жлебови немају једнаку величину. Велики жлеб је 22 Å широк, док мали жлеб има 12 Å.[21] Постоји низ изузетака, првенствено у случајевима необичних ДНК конформација. Називи велики и мали жлеб се увек односе на разлике у величини удубљења кад је ДНК у обичној B форми.
Базе малог жлеба су на подеснијем растојању за везивање лиганда, него базе великог жлеба. Из тог разлога, протеини попут транскрипционих фактора који се везују за специфичне секвенце двоструког ДНК хеликса обично формирају водоничне везе са изложеним странама база малог жлеба.[22]
Денатурација и хибридизација ДНК[уреди | уреди извор]
Секундарна структура ДНК је подложна денатурацији. Под денатурацијом се подразумева нарушавање секундарне структуре тако да се дволанчани ДНК молекул раздваја на два полинуклеотидна ланца. Под одговарајућим условима може доћи до ренатурације, тј. до поновног спајања комплементарних ланаца ДНК.[23] Процеси денатурације и ренатурације одигравају се и у ћелији под контролисаним условима и у ограниченом обиму. Ти процеси представљају неопходан предуслов за нормално функционисање ДНК, односно за њену репликацију и транскрипцију.
Када се у раствору нађу два полинуклеотидна ланца који имају комплементарне редоследе нуклеотида, наградиће се хибридни дволанчани молекул.[24][25] Денатурисана ДНК може да хибридизује са денатурисаном ДНК исте или различите врсте, или са РНК. Хибридизација је нашла веома широку примену у истраживањима у молекуларној биологији и представља једну од основних техника генетичког инжењеринга.
Спаривање база[уреди | уреди извор]


|

|
Свака база једног ланца се спарује само са једном базом на наспрамном ланцу. Овакво спаривање се назива комплементарно спаривање. Пурин се спарује са пиримидином водоничним везама, те се А спарује само са Т (двема водоничним везама) и C само са G (са три водоничне везе). Како водоничне везе нису ковалентне, оне се лако раскидају и лако поново формирају. Ове везе се раскидају или механичким силама (нпр. током репликације) или високом температуром.[26] Две водоничне везе се лакше раскидају од три. Овај податак је битан ако секвенца ДНК молекула није унапред позната. Кад је секвенца ДНК молекула непозната, у молекуларној биологији се између осталог примењује техника која користи температуру. Што је температура виша, то се ДНК молекул теже раскида, те се може претпостави да тај молекул ДНК има велики број Ц и Г база (и.е. висок GC-садржај). ДНК са високим GC-садржајем је стабилнија од ДНК са ниским GC-садржајем.[27]
Директна последица нуклеотидне комплементарности је да су информације у дволанчаној секвенци ДНК хеликса дуплиране, што је витално за репликацију молекула. Ова реверзибилна и специфична интеракција између комплементарних парова база је критична за све функције ДНК у живим организмима.[7]
Као што је горе напоменуто, већина ДНК молекула се састоји од два полимерна ланца, спојена у хеликсну структуру нековалентним везама. Ова дволанчана структура (dsDNA) се у знатној мери одржава посредством интеракција међуланчаног слагања база, које се најјаче за G,C стекове. Два ланца се могу раздвојити у процесу познатом као топљење, чиме се формирају два молекула (ssDNA). До топљења долази кад су услови подесни, као што су високе температуре, ниске концентрације соли и високе pH вредности (низак pH такође отапа ДНК, али пошто је ДНК нестабилна услед денатурације киселине, низак pH се ретко користи).
Стабилност dsDNA форме зависи не само од GC-садржаја (% G,C базних парова) него и од секвенце (пошто је формирање стекова зависно од ње), као и од дужине (дужи молекули су стабилнији). Стабилност се може мерити на различите начине. Уобичајен приступ је мерење температуре топљења (она се још назива Тм вредност), што је температура на којој се 50% дволанчаних молекула конвертује у једноланчане молекуле. Настали једноланчани ДНК молекули немају јединствен заједнички облик, мада су неке конформације стабилније од других.[28] Температура топљења је зависна од јонске снаге и ДНК концентрације. Консеквентно, GC садржај и дужина двоструког ДНК ланца одређују јачину асоцијације између ланаца. Дуги ДНК хеликси са високим GC садржајем имају ланце са јачим интеракцијама, док кратки хеликси са високим AT садржајем имају ланце са слабијим интеракцијама.[29] У биологији, делови ДНК двоструких хеликса који се лако раздвајају, као што је TATAAT Прибнов-кутија у неким промотерима, теже да имају висок AT садржај.[30][31][32]
Смисао и антисмисао[уреди | уреди извор]

ДНК секвенца се назива смисаоном (енгл. sense) (негативна (-)), ако је њена секвенца иста као и секвенца иРНК копије која се транслира у протеин.[33] Комплементарна секвенца супротног ланца се назива антисмисаона (позитивна (+)') секвенца. Обе секвенце могу да постоје на различитим деловима истог ДНК ланца (и.е. оба ланца могу да садрже обе смисаоне и антисмисаоне секвенце). Понекад се фраза кодирајући ланац среће. Међутим, кодирајућа и некодирајућа РНК могу да буду транскрибоване на сличан начин са оба ланца. У неким случајевима до транскрипције долази у оба правца почевши од заједничког промотерског региона, или до транскрипције може доћи унутар интрона, на оба ланца.[34][35][36]
Код прокариота и еукариота, антисмисаоне РНК секвенце се формирају, мада функција тих молекула није потпуно јасна.[37] Једна од претпоставки је да антисмисаони РНК молекули учествују у регулацији експресије гена путем РНК-РНК спаривања база.[38]
Код малог броја ДНК секвенци прокариота у еукариота, и нешто већег броја плазмида и вируса, разлика између смисаоних и антисмисаоних ланаца је замагљена преклапањем гена.[39] У тим случајевима, неке ДНК секвенце имају двоструку улогу. Оне кодирају један протеин кад се читају дуж једног ланца, и други протеин кад се читају у супротном правцу дуж другог ланца. Код бактерија, ово преклапање може да учествује у регулацији транскрипције гена,[40] док код вируса, преклапајући гени повећавају количину информације која може да буде кодирана унутар малог виралног генома.[41]
Паковање ДНК молекула у ћелијама[уреди | уреди извор]

| Нуклеозом | |||||
|---|---|---|---|---|---|

| |||||
| Кристална структура нуклеозома. Протеинске компоненте су H2A , H2B , H3 и H4 . Поглед је одозго кроз суперхеликсну осу. (1KX5 1KX5)[42] | |||||
| Идентификатори | |||||
| Симбол | Histone | ||||
| Пфам | PF00125 | ||||
| Пфам клан | CL0012 | ||||
| ИнтерПро | IPR007125 | ||||
| СКОП | 1hio | ||||
| |||||
Готово код свих прокариота, ДНК је кружни молекул саграђен од два спирално увијена полинуклеотидна ланца. Код еукариота организација ДНК молекула је нешто компликованија. ДНК молекул је веома дугачак, у просеку до 1,8 m. Молекул те дужине мора да стане у ћелије које су веома мале и не могу да се виде голим оком. Ћелије морају да веома компактно спакују ДНК молекул. То омогућавају протеинима који се зову хистони.[43]
Хистони су мали, веома базни протеини, богати амино киселинама као што су лизин и аргинин. Они су главне протеинске компоненте хроматина, које делују као калеми око којих се намотава ДНК. Они учествују у регулацији генске активности. Без хистона, несавијена ДНК у хромозомима би била веома дугачка (однос дужине и ширине је већи од 10 милиона код људске ДНК). ДНК намотана на хистоне производи око 90 микрометара (0.09 mm) хроматина, који се дуплира и кондензује током митозе, дајући око 120 микрометара хромозома.[44]
У еукариотским ћелијама је постоји пет типова хистона: H1, H2A, H2B, H3 и H4.[45][46] Хистони су у директном контакту са ДНК молекулом. Осам хистона (по два H2A, H2B, H3, H4), стварају структуре које изгледају као диск. Структура ДНК молекула обавијеног око диска се назива нуклеозом. Око сваког диска ДНК молекул се обавије 1,65 пута, у дужини од 147 базних парова (А-Т и Ц-Г), формирајући леворуки суперхеликсни намотај.[47] Тако увијени ДНК молекул се обавије око преосталог хистона H1, који не формира структуру у облику диска, већ служи само као веза до следећег диска (изграђеног од горепоменутих хистона) и поново се обавија око следећег диска.[48] Хистон H1 омогућава формирање структуре вишег реда. Најосновнија таква формација је влакно пречника 10 nm. Гледано кроз микроскоп свеукупна оваква структура изгледа као перлана огрлица. Ово укључује паковање ДНК око нуклеозома са око 50 базних парова између њих (ти сегмент се називају линкер ДНК).
Основа нуклеозома је формирана од два H2A-H2B димера и H3-H4 тетрамера. Они формирају две скоро симетричне половине терцијарне структуре, са C2 симетријом, где је један макромолекул слика у огледалу другог молекула.[47] Четири основна хистона (H2A, H2B, H3 и H4) имају релативно сличне структуре и високо су очувани током еволуције. Сви имају хеликс обрт хеликс обрт хеликс мотив (који омогућава лаку димеризацију). Они исто тако имају дуге репове на једном од крајева аминокиселинског ланца, на којима долази до низа посттранслационих модификација.
Сматра се да су хистонски протеини еволуционо сродни са хеликсним делом продуженог ААА+ АТПазног домена,[49][50] C-домена, и са N-терминусним доменом препознавања супстрата Clp/Hsp100 протеина.[51][52] Упркос разликама у њиховој топологији, они имају хомологан хеликс-раван-хеликс (HSH) мотив.[53]
Користећи технику спин-обележене електронске парамагнетне резонанце, Британски истраживачи су измерили растојање између намотаја око којих еукариотске ћелије намотавају своју ДНК. Утврђено је да су растојања у опсегу од 59 до 70 Å.[54]
Хистони формирају пет типова интеракција са молекулом ДНК:
- Хеликсни диполи са алфа хеликса у H2B, H3, и H4 узрокују акумулацију позитивног наелектрисања на тачкама интеракције са негативно наелектрисаним фосфатним групама ДНК
- Водоничне везе између ДНК основе и амидних група на главном ланцу хистонских протеина
- Неполарне интеракције између хистона и шећера дезоксирибозе на ДНК молекулу
- Сони мостови и водоничне везе између бочних ланаца базних аминокиселина (посебно лизина и аргинина) и фосфатних кисеоника ДНК
- Неспецифична уметања H3 и H2B N-терминусних репова у мале жлебове ДНК
Високо базна природа хистона, осим што омогућава ДНК—хистон интеракције, доприноси њиховој растворљивости у води.
Суперспирализација[уреди | уреди извор]


ДНК може да буде увијена попут канапа процесом који се назива суперспирализација ДНК. Кад је ДНК у свом „опуштеном” стању, ланци обично обиђу осу двоструког хеликса једном свака 10,4 базна пара, док ако је ДНК упредена ланци постају више или мање збијени.[55] Када је ДНК упредена у правцу хеликса, у питању је позитивна суперспирализација и базе су ближе једна другој. Ако је ДНК упредена у супротном правцу (негативна суперспирализација), базе се лакше растављају. У природи, ДНК је најчешће благо негативно суперспирализована. То се остварује ензимима који се зову топоизомеразе.[56] Ти ензими су исто тако потребни за отпуштање напрезања услед ДНК увијања насталог током процеса транскрипције и репликације ДНК.[57][58]
Хромозоми могу да буду веома велики, те средишњи сегменти могу да се понашају као да су крајеви учвршћени. Резултат тога је да они не могу да расподеле сувишне намотаје на остатак хромозома, или да апсорбују завијање да би се опоравили од одвијања, те сегменти могу да постану суперспирализовани. У одговору на суперспирализацију они ће бити изложени напрезању, као да су крајеви спојени.
Суперспирализација ДНК је важна за њено паковање унутар ћелија. Дужина неспирализоване ДНК је хиљадама пута већа од дужине ћелије, те је паковање генетичког материјала унутар ћелије или једра (код еукариота) комплексан задатак. Суперспирализација ДНК редукује потребни простор и омогућава паковање знатно веће количине ДНК. Код прокариота, плектонемски супернамотаји су предоминантни, зато што је хромозом најчешће кружног облика и садржи релативно малу количину генетичког материјала.[59][60][61][62][63] Суперспирализација ДНК код еукариота се јавља на више нивоа плектонемских и соленоидних супернамотаја, при чему се соленоидна суперспирализација показује најефективнијом у збијању ДНК молекула. Соленоидна суперспирализација се остварује путем хистона и формира се влакно пречника 10 nm. Ово влакно се даље намотава у 30 nm широко влакно, које се даље намотава на само себе више пута.[64][65][66]
ДНК паковање се одвија у знатно повећаној мери током деобе једра у процесима митозе или мејозе, при којим се ДНК мора поделити и сажети у новонасталим ћелијама. Кондензини[67][68] и кохезини[69][70][71] су протеини за структурно одржавање хромозома који помажу у кондензацији хроматида и везивању њихових центромера. Ти протеини индукују позитивну суперспирализацију.[72][73][74]
Алтернативне ДНК структуре[уреди | уреди извор]



ДНК може да постоји у мноштву могућих конформација међу којима су А-ДНК,[75] Б-ДНК,[76][77][78] и З-ДНК форме[79][80], мада су једино Б-ДНК и З-ДНК директно примећене у функционалним организмима.[10] Конформација коју ДНК поприма зависи од нивоа хидратације, ДНК секвенце, количине и правца супернамотавања, хемијских модификација база, типа и концентрације металних јона, као и присуства полиамина у раствору.[81]
Први објављени извештаји о Рендгенској структури А-ДНК и Б-ДНК форми су користили анализу базирану на Патерсоновој трансформацији која даје само ограничену количину структурне информације о оријентацији ДНК влакана.[82][83][84] Један алтернативни аналитички приступ су предложили Вилкинс ет ал. 1953, за ин виво Б-ДНК дифракцију X-зрака/распореда максимума расејавања високо хидратисаних ДНК влакана базиран на квадратима Баселових функција.[85] У истом журналу, Џејмс Д. Вотсон и Франсис Крик су објавили њихову анализу молекулског моделовања ДНК дифракционих образаца X-зрака и предложили структуру двоструког хеликса.[12]
Мада је Б-ДНК форма најчешћа под условима који владају у ћелијама,[86] она није добро дефинисана конформација него је фамилија сродних ДНК конформација[87] која се јавља при високим нивоима хидратације присутним у живим ћелијама. Њихови одговарајући рендгенски дифракциони обрасци расипања су карактеристични за молекулске паракристале са знатним степеном нереда.[88][89]
У поређењу са Б-ДНК, А-ДНК форма је шира деснорука спирала, са плитким, широким главним жлебом и ужим, дубљим малим жлебом. А форма се јавља под нефизиолошким условима у парцијално дехидратисаним ДНК узорцима, док се у ћелији може формирати при хибридном спаривању ДНК и РНК ланаца,[90][91][92] као и у ензим-ДНК комплексима.[93][94] Сегменти ДНК где су базе хемијски модификоване метилацијом могу да подлегну већим конформационим променама и да поприме З форму. Овде, ланци формирају леворуку спиралу око хеликсне осе, што је супротно уобичајеној Б форми.[95] Те необичне структуре се могу препознати по специфичним З-ДНК везујућим протеинима. Оне могу да учествују у регулацији транскрипције.[96][97][98][99][100][101]
Алтернативна ДНК хемија[уреди | уреди извор]

Током дужег низа година егзобиолози су предлагали постојање једне алтернативне биосфере која користи радикално различите биохемијске и молекулске процесе него тренутно познате животне форме. Једна од претпоставки је била постојање животног облика који користи арсеник уместо фосфора у ДНК.
На једној конференцији за штампу НАСА је децембра 2010. изјавила да бактерија GFAJ-1, која је еволуирала у окружењу богатом у арсенику, прва земаљска животна форма која можда има ту способност.[102] Бактерија је нађена у језеру Моно, источно од Јосемитског националног парка. GFAJ-1 је штапићаста екстремофилна бактерија из фамилије Halomonadaceae, која у одсуству фосфора можда има способност инкорпорисања обично отровног елемента арсена у свој ДНК.[103] Ово откриће иде у прилог дугогодишњој идеји да би ванземаљски живот можда могао да има различиту биохемијску основу од живота на Земљи.[103][104] Истраживања је извео тип предвођен Фелисом Волф-Симон, која је геомикробиолог и геобиохемичар на НАСА астробиолошком институту при Државном универзитету Аризоне.
Овај налаз је наишао на јак критицизам у научној заједници. Научници тврде да нема доказа да је арсеник заправо инкорпориран у биомолекуле.[104][105] Микробиолог Јохан Хајдер је критиковао презентоване резултате студије. Он је упутио на могуће грешке у мерењу као и на погрешну интерпретацију резултата студије. По њему је, у оригиналној публикацији аутора поменуто загађење узорака остацима фосфата, који су вероватно присутни у довољној количини за основно снабдевање бактерија.[106] Независно потврђивање овог до сад није било могуће.
Квадруплексне структуре[уреди | уреди извор]




На крајевима линеарних хромозома су специјализовани региони ДНК који се називају теломере.[108][109][110] Главна функција тих региона је да се омогући ћелији да репликује крајеве хромозома користећи ензим теломеразу, пошто ензими који нормално репликују ДНК не могу да копирају екстремне 3’ крајеве хромозома.[111][112] Ти специјализовани хромозомски завршеци такође помажу у заштити ДНК крајева, и спречавају системе за поправку ДНК у ћелији да их третирају као оштећења која треба поправљати.[113][114][115] У људским ћелијама, теломере су обично сегменти једноланчане ДНК који се састоје од неколико хиљада понављања једноставне TTAGGG секвенце.[116][117][118]
Ове гуанином богате секвенце могу да стабилизују хромозомске крајеве формирањем структура свежњева јединица са четири базе, уместо уобичајених базних парова ДНК молекула. Овде, четири гуанинске базе формирају равну површину, и те равне четворобазне јединице се затим слажу једна на другу да формирају стабилне Г-квадруплексне структуре (Г-тетраде Г4-ДНК).[119][120] Ове структуре су стабилизоване водоничним везивањем између база и хелацијом металног јона у центру сваке четворобазне јединице.[121] Низ других структуре се може формирати, са централним сетом од четири базе које долазе било из једног ланца савијеног око база, или неколико различитих паралелних ланаца, при чему сваки доприноси једну базу централној структури.
Осим ових стекованих структура, теломере исто тако формирају структуре са великим петљама које се називају теломерне петље, или Т-петље. Овде се једноланчана ДНК склупча у већи круг стабилизованом протеинима који се везују за теломере.[122] На самом крају Т-петље, једноланчана теломерна ДНК је спојена са регионом дволанчане ДНК тако што теломерни ланац делом ремети структуру ДНК двоструког хеликса и базно се спарује са једним од два ланца. Ова троланчана структура се назива депласманска петља или Д-петља.[119]
Квадруплекси се јављају не само у теломерама, него и на другим локацијама. На пример, за протоонкоген c-myc је показано[123][124] да формира квадруплекс у нуклеазном хиперсензитивном региону[125][126], који је критичан за активност гена.[127] Након тог иницијалног открића, за многе друге гене је нађено да имају Г-квадруплексе у њиховим промотерским регионима.[128] Неки од њих су живински β-глобински ген,[129][130][131] људска убиквитинска лигаза RFP2[132][133][134] и протоонкогени c-kit,[135][136][137] bcl-2[138][139][140], VEGF,[141][142][143] H-ras}-[144][145][146] и N-ras.[147][148][149]
Идентификација и предвиђање секвенци које имају способност формирања квадруплекса је важан корак у разумевању њихове улоге. Генерално једноставни обрасци се користе за претрагу могућих квадруплекс формирајућих секвенци: d(G3+N1-7G3+N1-7G3+N1-7G3+), при чему је N база (укључујући гуанин).[150][151] Ово правило је нашло широку примену у онлајн алгоритмима.
Прегледи целокупног генома базирани на правилу налажења квадруплекса су идентификовали 376.000 могућих квадруплексних секвенци (PQS) у људском геному. Знатан број њих се вероватно не формира ин виво.[151] Једна слична студија је идентификовала могуће Г-квадруплекс код прокариота.[152] Постоји више модела који објашњавају како квадруплекси могу да контролишу активност гена. Један модел показује да формирање Г-квадруплекса на или близо промотера блокира транскрипцију гена, и тиме га деактивира.[153][154][155] У једном другом моделу квадруплекс формиран на некодирајућем ДНК ланцу помаже у одржавању отворене конформације кодирајућег ДНК ланца, те поспешује експресију респективног гена.[156][157][158]
Један начин индуковања или стабилизовања Г-квадруплексних формација, је увођење молекула који се могу везати за Г-квадруплексне структуре.[159][160] Познати су бројни лиганди, мали молекули и протеини који имају ту способност. Знатан број протеина који се јавља у природи се селективно везује за Г-квадруплексе. Међу њима су хеликазе,[161][162][163] које су имплициране у Блумов[164][165] и Вернеров синдром[164][166], и протеин RAP1 из Saccharomyces cerevisiae.[167][168][169] Развијен је протеин са доменом цинковог прста[170] који се назва Gq1,[171][172][173] као и специфична антитела.[174][175][176]
Познато је да се катјонски порфирини везују за Г-квадруплексе,[177][178][179] као и молекул теломестатин.[180][181][182]
Разграната ДНК[уреди | уреди извор]

|

|
| Једна грана | Вишеструко гранање |
До ДНК крзања долази кад некомплементарни региони постоје на једном или оба краја иначе комплементарне дволанчане ДНК. Разграната ДНК се може јавити ако се уведе трећи ДНК ланац који има способност хибридизације са отвореним ДНК сегментима дволанчане ДНК. Најједноставнији пример разгранавања је троланчана ДНК. Комплекси са додатним ланцима и вишеструким гранањем су такође познати.[184] Разграната ДНК налази примену у нанотехнологији.
Тест разгранате ДНК је тест амплификације сигнала (за разлику од теста амплификације биолошке мете) који се користи за детектовање молекула нуклеинских киселина.[185] Овај тест се може користити за детектовање и квантификацију многих типова РНК или ДНК. У тесту се разграната ДНК помеша са тестираним узорком. Детекција се врши користећи нерадиоактивни метод. Претходна амплификација нуклеинске киселине није неопходна. Тест је у потпуности завистан од хибридизације. Ензими се користе за одређивање степена хибридизације, али се не користе за манипулацију нуклеинских киселина. Мале количине нуклеинске киселине се могу детектовати и квантификовати без корака реверзне транскрипције (у случају РНК) и/или PCR.[186][187] Тест је подесан за употребу у високо проточном моду, за разлику од квантитативног Northern-blota[7][188] или теста РНК протекције.[189]
Вибрације[уреди | уреди извор]
ДНК може да изводи ниско фреквентно колективно кретање. Оно се може мерити Рамановом спектроскопијом[190][191] и анализирати применом модела квази континуума.[192][193]
Модификације[уреди | уреди извор]
Модификације база[уреди | уреди извор]
|

|

|
| Цитозин | 5-метилцитозин | Тимин |
  |

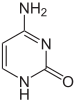
Експресија гена је зависна од начина на који је ДНК пакована у хромозомима, у структурама званим хроматини. Модификације база могу да утичу на паковање. Региони који имају низак ниво или одсуство експресије обично садрже високе нивое метилације цитозинских база.[203] На пример, цитозинска метилација, производи 5-метилцитозин, који је важан за инактивацију X-хромозома.[204]
Просечни нивои метилације варирају између организама. Црв Caenorhabditis elegans не испољава цитозинску метилацију,[205][206] док кичмењаци имају високе нивое. До 1% њихове ДНК садржи 5-метилцитозин.[207]
ДНК метилација је кључни део нормалног развоја организма и ћелијске диференцијације виших организама. ДНК метилација стабилно мења обрасце генског изражавања у ћелијама тако да оне могу да „запамте где су биле” или да умање експресију гена. На пример, ћелије програмиране да буду Лангерхансова острвца током ембрионског развоја остају Лангерхансова острвца током животног века организма. ДНК метилација се типично уклања током формирања зигота и поново успоставља током накнадног ћелијског развоја. Недавна истраживања су показала да се метил групе заправо не уклањају у зиготима, него да долази до хидроксилације метил група.[208] Неке метилационе модификације које регулишу експресију гена су наследне и то се назива епигенетичком регулацијом. ДНК метилација супресује изражавање виралних гена и других штетних елемената који су били инкорпорирани у геном домаћина током времена. ДНК метилација је исто тако основа хроматинске структуре, која омогућава ћелијама да поприме велики број карактеристика неопходних за мултицелуларни живот полазећи од једне непроменљиве ДНК секвенце.
ДНК метилација у позицији 5 цитозина има специфичан ефекат редуковања генске експресије и нађена је код свих кичмењака. У соматском ткиву одраслих особа, ДНК метилација се типично јавља у CpG динуклеотидном контексту, док је у ембрионским матичним ћелијама тренд супротан.[209][210][211]
ДНК метилација је од пресудне важности у развоју скоро свих типова канцера.[212] Упркос важности 5-метилцитозина, може доћи до деаминације чиме се формира база тимин, тако да су метилисани цитозини посебно склони мутацијама.[213] Аберантни обрасци ДНК метилације су везани за велики број људских малигности и групишу се у две дистинктне форме: хиперметилација и хипометилација у односу на нормално ткиво. Хиперметилација је једна од главних епигенетичких модификација које репресују транскрипцију путем промотерског региона тумор супресивних гена.[214][215][216] Хиперметилација се типично јавља на CpG острвима у промотерском региону те производи инактивацију гена. Глобална хипометилација је била имплицирана у развој и прогрес канцера путем различитих механизама.[217][218][219]
Модификације других база су метилација аденина код бактерија,[220][221] присуство 5-хидроксиметилцитозина у мозгу,[222] и гликозилација урацила којом се формира „Ј-база” у кинетопластидима.[223][224]
Оштећења[уреди | уреди извор]
ДНК може да буде оштећена многим врстама мутагена, који мењању ДНК секвенцу. Мутагени обухватају оксидационе агенсе,[228][229][230] алкилирајуће агенсе,[231][232] као и електромагнетну радијацију високе енергије, попут ултраљубичастог светла[233][234] и X-зрака.[235][236] Тип произведеног ДНК оштећења зависи од типа мутагена. На пример, UV светло може да оштети ДНК формирањем тиминских димера, који су међусобно повезани између пиримидинских база.[237] С друге стране, оксиданси попут слободних радикала[238][239] или водоник пероксида[240][241] производе вишеструке форме оштећења, као што су модификације база, посебно гуанозина, и прекиди двоструких ланаца.[242] Типична људска ћелија садржи око 150.000 база које су подлегле оксидативним оштећењима.[243] Међу тим оксидативним озледама, најопаснији су прекиди двоструких ланаца, јер се они тешко поправљају и могу да произведу генске мутације, генетичка уметања и делеције из ДНК секвенце, као и хромозомске транслокације.[244]
 |
Многи мутагени се уклапају у простор између два суседна базна пара. То се назива интеркалација.[245][246] Већина интеркалатора су ароматични и планарни молекули. Примери су етидијум бромид,[247][248] акридини,[249][250] дауномицин,[251][252][253] и доксорубицин.[251][252][254] Да би интеркалатор могао да се уклопи између пара база, оне се морају раздвојити. Стога долази до дисторзије ДНК ланаца путем одвијања двоструког хеликса. Тиме се инхибирају транскрипција и репликација ДНК, што узрокује токсичност и мутације.[255] Резултат је да ДНК интеркалатори могу да буду карциногени, и у случају талидомида, тератогени.[256][257] Други, попут бензо[а]пирен диол епоксида[258][259] и афлатоксина,[260][261][262] формирају ДНК адукте који индукују грешке у репликацији.[263] Упркос томе, услед њихове способности да инхибирају ДНК транскрипцију и репликацију, група сличних токсина се такође користе у хемотерапији за инхибирање брзог раста ћелија канцера.[264]
Мутације[уреди | уреди извор]

Мутације могу да узрокују дуплирање великих делова ДНК, обично путем генетичке рекомбинације.[265] Та дуплирања су главни извор полазног материјала за еволуцију нових гена. Од неколико десетина до неколико хиљада гена се дуплира у животињском геному сваких милион година.[266] Већина гена припада већим фамилијама гена са заједничким наслеђем.[267] Нови гени настају на неколико начина. До тага најчешће долази путем дупликације и мутације наслеђених гена, или рекомбинацијом делова различитих гена чиме се формирају комбинације са новим функцијама.[268][269]
Овде, домени делују као модули, сваки од којих има специфичну и независну функцију. Њихове комбинације могу да произведу гене који кодирају нове протеине са јединственим особинама.[270] На пример, очи човека користе четири гена за формирање структура које реагују на светло: три за распознавање боја и један за ноћни вид. Сва четири су настала од заједничког предачког гена.[271] Још једна предност дуплирања гена (или чак целокупног генома) је да то повећава редундантност. Тиме се омогућава једном гену да у пару поприми нову функцију, док друга копија има оригиналну функцију.[272][273] Други типови мутација понекад креирају нове гене из претходно некодирајуће ДНК.[274][275]
Промене у броју хромозома могу да обухвате мутације још већих размера, при којима се ДНК сегменти хромозома одвајају и затим преуређују. На пример, код раних хоминина, два хромозома су спајањем дала људски хромозом 2. Та фузија се није јавила у родовима других човеколиких мајмуна, те су код њих та два хромозома засебна.[276] У еволуцији, најважнија последица таквих хромозомска реаранжмана јесте убрзање дивергенције популација у нове врсте путем умањивања вероватноће укрштања између популација.[277]
Секвенце ДНК које могу да се померају у геному, попут транспозона, сачињавају главну фракцију генетичког материјала биљки и животиња, и сматра се да су биле важне у еволуцији генома.[278] На пример, више од милион копија Alu секвенце је присутно у хуманом геному, и те секвенце поседују функције као што је регулација генске експресије.[279] Још један ефекат тих мобилних ДНК секвенци је да њихово померање унутар генома може да проузрокује мутације или делеције постојећих гена, те оне стога доприносе генетичкој разноврсности.[280][281][282]
Нелеталне мутације се акумулирају унутар генског фонда и увећавају количину генетичке варијабилности.[283] Обиље неких генетичких промена унутар генског фонда може да буде редуковано природном селекцијом, док се друге „повољније” мутације могу акумулирати и произвести адаптивне промене.
На пример, лептир може да произведе потомство са новим мутацијама. Већина тих мутација неће имати ефекта, док једна може да промени боју једног од лептирових потомака, чинећи га теже (или лакше) уочљивим за предаторе. Ако је та промена боје корисна, вероватноћа преживљавања тог лептира и произвођења потомства је у извесној мери повећана, и током времена број лептира са том мутацијом може да формира већи удео популације.
Неутралне мутације се дефинишу као мутације чији ефекти не утичу на адаптивну способност једне индивидуе.[284][285] Оне могу да се акумулирају током времена услед генетичког дрифта. Верује се да огромна већина мутација нема значајан утицај на адаптивност организма. Исто тако, механизми ДНК поправке су у стању да поправе већину промене пре него што постану сталне мутације, и многи организми имају механизме за елиминисање иначе перманентно мутираних соматских ћелија.
Корисне мутације могу да побољшају репродуктивни успех.[286][287]
Генетичке рекомбинације[уреди | уреди извор]

ДНК хеликс обично не формира интеракције са другим ДНК сегментима, и у људским ћелијама различити хромозоми чак заузимају засебне области једра које се називају „хромозомске територије”.[290] Ова физичка сепарација различитих хромозома је важна за способност ДНК да функционише као стабилна ризница информација. Један од ретких случајева кад хромозоми формирају интеракције је током хромозомског кросинг-овера у процесу рекомбинације. При укрштању хромозома два ДНК хеликса се раскидају, замењују секције и поново спајају.
Рекомбинација омогућава хромозомима да размене генетичке информације и произведу нове комбинације гена. Тиме се повећава ефикасност природне селекције и она може да буде важна за брзу еволуцију нових протеина.[291] Генетичка рекомбинација може да буде део поправке ДНК, посебно у ћелијском одговору на раскидање двоструких ланаца.[292]
Најчешћа форма хромозомског кросинг-овера је хомологна рекомбинација, где два хромозома размењују веома сличне секвенце.[7][74] Нехомологна рекомбинација може да буде штетна за ћелије, јер она може да произведе хромозомске транслокације и генетичке абнормалности. Реакцију рекомбинације катализују ензими познати као рекомбиназе, попут RAD51.[293] Први степен рекомбинације је раскидање ланца двоструког хеликса било посредством ендонуклеазе или услед оштећења ДНК.[294] Серија корака који су делом катализовани рекомбиназом доводи до спајања два хеликса у најмање један Холидејов спој, у коме су сегменти једног ланца сваког хеликса спојени са комплементарним ланцем другог хеликса.[295][296] Холидејов спој је тетраедрална структура која се може померати дуж хромозома, замењујући један ланац за други. Реакција рекомбинације се затим зауставља раскидањем споја и религацијом ослобођене ДНК.[297]
У нормалној мејози свака хроматида одлази у посебан гамет. Гамети који садрже хроматиде које су размењивале делове називају се кросинг-овер гамети. Јединке које настају од таквих гамета називају се рекомбинанти.[298][299]
Гени на једном хромозому називају се везани гени. Они се заједно преносе у потомство и да не постоји кросинг-овер увек би се јављали у истим комбинацијама. Број група везаних гена једног организма једнак је његовом броју хромозомних хаплоида. Заједничко испољавање два или више гена који се налазе на истом хромозому назива везано наслеђивање (корелативно наслеђивање). У стварности међутим, није довољно да се два гена налазе на истом хромозому да би се везано наслеђивали. Они морају бити врло близу један до другог на истом хромозому. Уколико то није случај може доћи до њиховог рекомбиновања током кросинг-овера. Вероватноћа одигравања кросинг-овера између два гена на истом хромозому зависи од њиховог међусобног растојања. Што је то растојање веће и вероватноћа да ће доћи до кросинг-овера је већа и обратно. У геному човека постоје гени између којих је растојање толико мало да се практично кросинг-овер не одиграва. Такви скупови гена који се као целина преносе на потомство називају се хаплотипови.[7][74]
Чињеница да учесталост кросинг-овера зависи од растојања између гена користи се приликом мапирања гена на хромозому (одређивање места генима на хромозому).[300][301] Генетичке мапе које се добијају на основу учесталости кросинг-овера дају нам увид о релативном положају гена на хромозомима.[302][303][304] Растојање између два гена процењује се на основу броја кросинг-овер гамета на 100 гамета (у %). При томе 1% кросинг-овера представља јединицу растојања или центиморган (сМ), тако да је 1 сМ = 1% кросинг-овера.[305][306][307]
Биолошке функције[уреди | уреди извор]
ДНК се обично јавља у облику линеарних хромозома код еукариота, и кружних хромозома код прокариота. Сет хромозома у ћелији чини њен геном. Људски геном има око 3 милијарде базних парова ДНК груписаних у 46 хромозома.[308] Информације су садржане у деловима секвенце ДНК који се називају гени. Трансмисија генетичке информације садржане у генима се остварује путем комплементарног спаривања база. На пример, током транскрипције, кад ћелија користи информацију у генима, ДНК секвенца се копира у комплементарну РНК секвенцу путем привлачења између ДНК и коректних РНК нуклеотида. Обично се ова РНК копија затим користи за прављење одговарајуће протеинске секвенце у процесу транслације, која зависи од истих интеракција између РНК нуклеотида. У алтернативном маниру, ћелија може да једноставно копира свој генетички садржај у процесу репликације ДНК.
Гени и геноми[уреди | уреди извор]
Геномска ДНК је чврсто и уредно упакована процесом који се зове ДНК кондензација тако да се може сместити у мали доступни простор унутар ћелије. Код еукариота, ДНК је лоцирана у ћелијском нуклеусу. Мање количине ДНК су присутне и у митохондријама и хлоропластима. Код прокариота, ДНК се налази унутар тела неправилног облика у цитоплазми које се назива нуклеоид.[309] Комплетна генетичка информација једног организма је његов генотип. Ген је јединица наслеђивањаи и регион ДНК који производи специфичну карактеристику организма. Гени садрже отворене оквире читања[310][311] који се могу транскрибовати, регулаторне секвенце као што су промотери, и појачиваче,[312] који контролишу транскрипцију отворене оквире читања.
Код многих врста, само мала фракција тоталне секвенце генома кодира протеине. На пример, само око 1,5% хуманог генома се састоји од протеин кодирајућих ексона, и преко 50% хумане ДНК су некодирајуће понављајуће секвенце.[313] Разлози за присуство толике количине некодирајуће ДНК у еукариотским геномима и изузетно велике разлике у величинама генома, или Ц-вредностима, између врста представља дугогодишњу загонетку познату као „енигма Ц-вредности”.[314] Међутим, ДНК секвенце које не кодирају протеине још увек могу да кодирају функционалне некодирајуће РНК молекуле, који учествују у регулацији генске експресије.[315][316]
Неке некодирајуће ДНК секвенце имају структурне улоге у хромозомима. Теломере и центромере[317][318] типично садрже мали број гена, али су важни за функцију и стабилност хромозома.[113][319] Богата фамилија некодирајуће ДНК код људи су псеудогени,[267][320] који су копије гена које су онеспособљене мутацијама.[321] Те секвенце су обично само молекулски фосили, мада оне могу повремено да служе као сирови генетички материјал за креирање нових гена путем процеса дуплирања гена[322][323] и дивергенције.[324][325][326][327]
Транскрипција и транслација[уреди | уреди извор]



Ген је ДНК секвенца која садржи генетичке информације и која може да утиче на фенотип организма.[329][330] Структура и/или ензимска активност сваког протеина првенствено произлази из његове примарне секвенце аминокиселина. Путем одређивања секвенце аминокиселина протеина гени имају способност ношења информације неопходне за дефинисање активног полипептидног ланца. На тај начин један једноставан тип молекулске структуре има способност изражавања безбројних протеинских форми. Колективно дејство разних протеинских производа ћелије спроводи каталитичке и структурне активности које су неопходне за успостављање фенотипа.
Унутар гена, секвенца база дуж ДНК ланца дефинише секвенцу информационе РНК, која затим дефинише једну или више протеинских секвенци. Однос између нуклеотидних секвенци гена и аминокиселинских секвенци протеина је одређен правилима транслације, која су позната као генетички код. Он се састоји од речи са три слова које се називају кодони. Они су формирани од секвенци са три нуклеотида (нпр. ACT, CAG, TTT).[331] Генетички код декодира комплексни апарат који стоји између нуклеинске киселине и протеина. Тај апарат је есенцијалан за пренос информације коју садржи ДНК. Само један од два ДНK ланца кодира протеин, тако да се генетички код записује као секвенца нуклеотида, а не базних парова.
Током транскрипције, кодони гена се копирају у информационе РНК молекуле посредством РНК полимеразе. Те РНК копије се затим декодирају у рибозомима који читају РНК секвенце путем базног спаривања информационе РНК са транспортним РНК молекулима, који носе аминокиселине. Пошто постоје четири базе у комбинацијама од три слова, могућа су 64 кодона (4³ комбинације).[332] Кодони кодирају двадесет стандардних аминокиселина. Већина аминокиселина је кодирана са више од једног кодона. Постоје три стоп или несмисаона кодона који означавају крај кодирајућег региона. То су: TAA, TGA и TAG кодони.[333]
Ген садржи серију кодона која се чита секвенцијално од почетне тачке на једном крају до крајње тачке на другом. Написана у конвенционалном 5'-3' смеру, секвенца нуклеотида ДНК ланца која кодира протеин одговара секвенци аминокиселина написаној у правцу од N-терминуса до C-терминуса.
Општа база кода је откривене путем генетичке анализе мутација rII региона бактеријског вируса, фаг Т4. Крик је 1961. показао да се код мора читати у непреклапајућим триплетима почевши од фиксне почетне тачке. Непреклапање значи да се сваки кодон састоји од три нуклеотида и да су узастопни кодони представљени узастопним тринуклеотидима. Употреба фиксне почетна тачке значи да конструкција протеина мора да почне на једном крају и тече ка другом, тако да се различити делови кодирајуће секвенце не могу независно читати.
Ако се генетички код чита у непреклапајућим триплетима, онда постоје три могућа начина транслирања нуклеотидне секвенце у протеин у зависности од почетне тачке. Они се називају оквирима читања. На пример за секвенцу ACGACGACGACGACGACG три оквира читања су:
- ACG ACG ACG ACG ACG ACG
- CGA CGA CGA CGA CGA CGA
- GAC GAC GAC GAC GAC GAC
Мутација која уметне или уклони једну базу мења оквир читања целокупне секвенце. Промена те врсте се назива померање оквира (енгл. frameshift). Пошто се секвенца новог оквира читања комплетно разликује од старе, целокупна аминокиселинска секвенца протеина је промењена иза места мутације, те се стога функција протеина вероватно комплетно губи.
Мутације промене оквира читања могу да индукују акридини, једињења која се везују за ДНК и изобличавају структуру двоструког хеликса, узрокујући инкорпорацију или изостављање додатне базе током репликације. Свака мутација узрокована акридином доводи до адиције или уклањања једног базног пара. Ако једна акридинска мутација произведе на пример адицију нуклеотида, ДНК се може вратити у почетно стање уклањањем то нуклеотида. До реверзије се доћи и одстрањивањем различите базе на месту у близини првог. Комбинација таквих мутација даје веома корисне информације о природи генетичког кода.
Оригинална анализа је изведена генетичним путем, тако што су све акридинске мутације класификоване у две групе, обележене са (+) и (-). Оба типа мутација узрокују фрејмшифт. Тип (+) путем адиције базе, а тип (-) путем делеције базе. Двоструке комбинације типова (+ +) и (- -) су и даље мутиране. Међутим, комбинације типова (+ -) и (- +) се међусобно поништавају, те је један од мутанта супресор другог. Ови резултати показују да се генетички код мора читати у секвенци са оквиром читања који има фиксну почетну тачку, тако да адиција и делеција могу да компензују једна другу, док двоструке адиције или двоструке делеције задржавају карактер мутанта. Ови налази не дају индикацију о величини кодона.
Кад се формирају троструке мутације, само (+ + +) и (- — -) комбинације показују почетни фенотип, док остале комбинације остају мутиране. Ако се претпостави да три адиције или три делеције одговарају респективно адицији или изостављању једне аминокиселине, може се закључити да се код чита у триплетима. Некоректна аминокиселинска секвенца се налази између два спољашња места мутација, док секвенце на оба краја остају непромењене.
Репликон[уреди | уреди извор]
Било да ћелија има само један хромозом (као код прокариота) или мноштво хромозома (као код еукариота), целокупни геном се мора репликовати једном током сваке ћелијске деобе.[3] Два општа принципа се користе за поређење стања репликације са условима ћелијског циклуса:
- Иницијација ДНК репликације обавезује ћелију да изврши поделу. Са те тачке гледишта број потомака ћелије је одређен серијом одлука о иницијацији репликације ДНК.
- Ако је репликација у току, подела није дозвољена док се репликациони чин не заврши. Завршетак репликације може да произведе сигнал за следећу ћелијску поделу. Дуплирани геноми се раздвајају у две ћелије ћерке (путем митозе код еукариота). Јединица сегрегације је хромозом.
Регулаторни гени ћелијског циклуса активирају прекидаче који иницирају ДНК репликацију и покрећу саму деобу. Код прокариота, иницијација репликације је догађај у коме учествује јединствено место бактеријског хромозома, и процес деобе је праћен развојем преграде. Код еукариотских ћелија, иницијација репликације је идентификована почетком С фазе, дужег периода током којег долази до синтезе ДНК, и који обухвата многе индивидуалне иницијационе догађаје. Чин поделе се остварује реорганизацијом ћелије током митозе.
Јединица ДНК у којој се јавља индивидуални чин репликације се назива репликон. Сваки репликон се активира једном и само једном у сваком ћелијском циклусу. Репликон је дефинисан поседовањем контролних елемената потребних за репликацију. Он садржи место почетка на коме се иницира репликација. Он исто тако може да садржи „терминус” на коме се репликација зауставља. Свака секвенца везана за место почетка, или прецизније секвенца која није раздвојена од места почетка терминусом, се репликује као део репликона. Место почетка може да утиче само на ДНК молекул на коме се налази. Геном прокариотске ћелије је један репликон, тако да су јединице репликације и сегрегације на истом месту. Највећи такав репликон је сам бактеријски хромозом. Репликон је флексибилна јединица. У случају бактеријских хромозома, он се користи за формирање копија дуплирањем дволанчане ДНК. Он се такође може користити за генерисање једноланчаних копија генома фага или плазмида у монометријским или мултиметријским формама. Мод репродукције репликона зависи од природе интеракција које се јављају током иницијације на месту почетка. Општи принцип је да је репликација контролисана степеном иницијације. Након почетка репликације, она се наставља док се целокупни геном не дуплира.[1]
Главна разлика у организацији бактеријских и еукариотских генома је у њиховој репликацији. Сваки еукариотски хромозом садржи велики број репликона, тако да јединица сегрегације обухвата мноштво јединица репликације. Тиме се додаје нова димензија проблему контроле. Сви репликони на хромозому се морају активирати током ћелијског циклуса, мада они нису истовремено активни, него се активирају током дужег периода. Сваки репликон се мора активирати само једном у датом ћелијском циклусу. Сигнал мора да разликује реплициране од нереплицираних репликона, тако да до активације репликона дође само једном. Пошто су многи репликони независно активирани, мора да постоји сигнал који означава да је целокупан процес репликације завршен.
Репликација може да буде једносмерна и двосмерна. Тип је одређен тиме да ли се једна или две репликационе рачве формирају. Код једносмерне репликације, једна репликациона виљушка напушта место почетка и креће се дуж ДНК. Код двосмерне репликације, две репликационе виљушке се формирају и крећу се у супротним смеровима. Кад се репликација ДНК посматра под електронским микроскопом, репликациони регион изгледа као око унутар нерепликоване ДНК. Међутим на основу изгледа сегмента се не може рећи да ли је репликација једносмерна или двосмерна. Око може да представља било коју од те две структуре. Ако је око формирано једносмерном репликацијом, оно представља непомерно место почетка и покретну репликациону рачву. Ако је формирано двосмерном репликацијом, оно представља пар репликационих рачви. Независно од типа, прогрес репликације проширује око док се ултиматно не прошири на цео репликон. Кад је репликон кружан, присуство ока формира θ структуру.
Број репликационих рачви репликационог ока се може одредити на два начина. Избор метода зависи од тога да ли се анализира дефинисани молекул ДНК или недефинисани регион ћелијског генома. У случају дефинисаног молекула, може се користити електронска микроскопија за мерење растојања крајева репликационог ока од крајева ДНК. Затим се позиција сваког краја ока може поредити у молекулима са који имају различите величине ока. Ако је репликација једносмерна само се један крај помера. Ако је репликација двосмерна оба краја се померају, док је место почетка у средини. У случају недефинисаних региона великог генома, два узастопна радиоактивна пулса се могу користити за обележавање кретања репликационе виљушке. Ако један од пулсева има интензивнију ознаку, они се могу разликовати по релативним интензитетима ознака применом ауторадиологије. Код једносмерне репликације једној ознаци следи друга на једном крају ока, док се код двосмерне јавља симетричан образац на обе стране ока. Симетрични образац се обично уочава у репликонима еукариотских хромозома.
Савременији метод мапирања места почетка са повећаном резолуцијом користи променљиве ефекте промене облика путања након електрофоретске миграције ДНК. Техника дводимензионог мапирања раздваја рестрикционе фрагменте репликујуће ДНК електрофорезом по маси у првој димензији, док је у другој димензији кретање првенствено одређено обликом. Различити типови репликационих молекула следе карактеристичне путеве, који се мере њиховом девијацијом од линије коју би следили линеарни молекули удвостручене величине. Једноставна Y-структура у којој се једна виљушка креће дуж линеарног фрагмента следи континуирани пут. Тачка инфлекције се јавља кад су све три гране једнаке дужине. Та структура максимално одступа од линеарне ДНК. Аналогним разлози одређују путеве двоструких Y-структура или мехура. Асиметрични мехур следи испрекидани пут, који се прекида у тачки у којој се мехур конвертује у Y-структуру.
Бактеријски репликон[уреди | уреди извор]
Бактеријски репликон треба да подржава следеће функције да би се коректно наслеђивао
- Иницијација репликационог циклуса
- Контрола фреквенције иницијалних догађаја
- Сегрегација репликованих хромозома у ћелије ћерке
Прве две функције су особине места почетка. Сегрегација може да буде независна функција, али у прокариотским системима обично почива на секвенци у близини места почетка. То није случај код еукариота. ДНК секвенца места почетка репликона има способност подржавања репликације било које ДНК секвенце у коју се унесе. Кад се она клонира у молекул који не садржи место почетка, реконструкција формира плазмид који има способност аутономне репликације. Места почетка су идентификована код бактерија, квасаца, хлоропласта и митохондрија. Опште својство је да је секвенца богата AT паровима. Сматра се да је то услед потребе да се дволанчана ДНК отопи како би се иницирала репликација.
Геном Ешерихије коли се двосмерно репликује из једног места почетка, које се идентификује као генетички локус oriC.[334][335] Додатак oriC сегмента у било коју ДНК секвенцу формира вештачки плазмид који се може репликовати у E. Coli. Путем редуковања величине клонираног фрагмента oriC утврђено је да се регион неопходан за иницирање репликације састоји од 245 базна пара. Плазмиди који се коректно иницирају могу да имају ирегуларну сегментацију, али се то може стабилизовати увођењем додатних секвенци. Из тога следи да место почетка које је неопходно за иницијацију не садржи довољно информација да омогући поделу дуплираних ДНК молекула у ћелије ћерке при подели бактерије. Функције које учествују у подели се могу идентификовати карактеризацијом секвенци које условљавају сегрегациону стабилност плазмида.
Прокариотски репликони су обично кружни. Кружне структуре обухватају бактеријски хромозом, плазмиде и многе бактериофаге. Оне су исто тако честе у хлоропластима и митохондријским ДНК молекулима. Репликација кружних молекула избегава проблем репликације крајева, али има проблем завршавања репликације. Бактеријски хромозом се двосмерно репликује као једна јединица почевши од oriC локације. Две репликационе рачве се крећу око генома приближно истом брзином до тачке састајања, и до терминације долази у дискретном региону. Након терминације саме репликације ДНК, ензими вишег нивоа који манипулишу структуре су неопходни да би се два новонастала хромозома раздвојила. Секвенце које узрокују терминацију се називају тер места. Она се састоје од кратке (~23 базна пара дугачке) секвенце која узрокује терминацију ин витро. Терминационе секвенце функционишу само у једном смеру. Терминација захтева протеин кодиран TUS геном[336][337] који препознаје консензус секвенцу и спречава даљи напредак репликационе виљушке.
Код Ешерихије коли репликациона рачва се обично зауставља у тачки на пола пута око хромозома. Постоје два терминациона региона (terD,A и terC,B) лоцирана око 100 кб на свакој страни места сретања. Сваки терминални регион је специфичан за један смер кретања рачве, и они су распоређени на такав начин да би свака рачва морала да пређе други завршни регион да би досегла до завршног краја који препознаје. Овај аранжман формира клопку за репликационе рачве. Ако је из било ког разлога једна рачва касни, тако да рачве не успеју да се сретну у уобичајеној централној позицији, бржа рачва ће бити заустављена у тер региону и чекаће долазак спорије рачве.
У случају да репликациона рачва (која се креће десет пута брже) наиђе на РНК полимеразу која се креће у истом смеру, она је обилази без поремећаја транскрипције. Механизам ове интеракције није познат. У случају да се РНК полимераза креће у супротном смеру, конфликт се вероватно не би могао решити, те може доћи до леталног исхода. То је могући разлог што су код Ешерихије коли скоро све активне транскрипционе јединице оријентисане тако да се изражавају у истом смеру као и репликациона рачва. Изузеци су једино мале транскрипционе јединице које се ретко изражавају.
Еукариотски репликон[уреди | уреди извор]
Код еукариотских ћелија, репликација ДНК је ограничена на део ћелијског циклуса. С фаза се јавља као део интерфазе која обично траје неколико часова код ћелија виших еукариота. Репликација велике количине ДНК садржане у еукариотском хромозому се остварује поделом у мноштво репликона. Само део тих репликона учествује у репликацији у било којем тренутку С фазе. Сваки репликон се активира у специфично време, мада евиденција о томе није потпуна. Сигнал за почетак С фазе је активација првог репликона. Током следећих неколико сати долази до активације других репликона. Контрола С фазе стога обухвата два процеса: излазак ћелије из претходне Г1 фазе, и иницијацију репликације индивидуалних репликона на уређен начин.
Највећи део познатих својстава појединачних репликона је добијен путем ауторадиографских студија. Хромозомски репликони обично имају двосмерну репликацију. Потешкоћа у карактерисању појединачних јединица је у томе да се суседни репликони спајају и производе велике репликационе мехуре. Приступ који се користи за разликовање индивидуалних репликона од спојених се обично ослања на сегменте ДНК у којима се може видети неколико активних репликона, који су вероватно активирани у приближно исто време и чије рачве се још нису среле. Постоје докази да „регионална” контрола може да произведе известан облик регулационог обрасца у коме су групе репликона инициране више или мање координирано, што је у супротности са механизмом у коме су индивидуални репликони активирани један по један у расутим областима генома. Две структурне особине сугеришу могућност организације на великој скали. Веома велики региони хромозома се могу карактерисати као „рано репликујући” или „касно репликујући”, из чега следи да постоји извесна расподела између репликона који се активирају рано и касно. Визуелизација репликационих рачви обележених са ДНК прекурсорима показује 100—300 центара, уместо униформне расподеле. Сваки центар вероватно садржи >300 репликационих рачви. Рачве могу да представљају фиксне структуре кроз које репликујућа ДНК мора да прође.
| Еукариотски репликони су мали и репликују се спорије од бактеријске ДНК | |||
|---|---|---|---|
| Организам | Број репликон (бп) | Просечна дужина | Брзина кретања (бп/мин) |
| Бактерија | 1 | 4.200 | 50.000 |
| Квасац | 500 | 40 | 3.600 |
| Воћна мушица | 3.500 | 40 | 2.600 |
| Жаба | 15.000 | 200 | 500 |
| Миш | 25.000 | 150 | 2.200 |
| Биљка | 35.000 | 300 | |
У групама активних репликона, просечна величина јединице се мери растојањем између места почетака. Брзина кретања репликационе рачве се може проценити из максималног растојања које ауторадиографски траг пређе током датог временског интервала. Појединачни еукариотски репликони су релативно мали, иако њихова дужина варира више од десет пута унутар генома. Брзина којом се они репликују је знатно мања од брзине бактеријске репликације. Геном сисара би се могао репликовати у току једног сата, ако би сви репликони симултано функционисали. Међутим, С фаза заправо траје дуже од шест сати у типичним соматским ћелијама, из чега следи да је до 15% репликона активно у било ком моменту. Постоје неки изузетни случајеви, као што је рани ембрионски развој Дрозофила ембриона, где је дужина С фазе компресована симултаним функционисањем великог броја репликона.
Доступна евиденција сугерише да хромозомски репликони немају терминусе на којима се репликационе рачве заустављају и ензимски комплекс дисоцира од ДНК. Вероватнији сценарио је да репликационе рачве настављају кретање од свог места почетка док се не сретну са рачвом која се креће у супротном смеру.
Сваки ДНК сегмент који садржи место почетка би требало да има способност репликације. Мада су плазмиди ретки код еукариота, могуће их је формирати путем подесних манипулација ин витро. То је остварено код квасца, мада не и код виших еукариота. Saccharomyces cerevisiae мутанти се могу трансформисати до дивљег типа додатком ДНК која садржи копију гена дивљег типа. Неки ДНК фрагменти квасца (често кружни) имају способност веома ефективног трансформисања дефективних ћелија. Ти фрагменти могу да опстану у ћелијама у неинтегрисаном (аутономном) стању, попут саморепликујућих плазмида. Фрагменти који се трансформишу са високом фреквенцијом поседује секвенце које имају способност ефективне репликације у квасцу. Тај сегмент се назива АРС (аутономно репликујућа секвенца). АРС елементи су изведени из аутентичних места почетка репликације хромозома. Секвенце са АРС функцијом се јављају са скоро једнаком фреквенцијом као и места почетка репликације. АРС елементи су систематски мапирани на дужим регионима хромозома. Само део њих се заправо користи за иницијацију репликације. Други су неми, или се можда користе повремено. Ако је тачно да нека места почетка имају варирајућу вероватноћу активације, следи да границе репликона нису фиксне. У том случају дати регион хромозома може да буде репликован из различитих места почетака у различитим ћелијским циклусима. АРС елемент се састоји од AT богатог региона који садржи одређена дискретна места на којима мутације имају знатан утицај. Садржај база уместо саме секвенце може да буде значајан за остатак региона.
Репликација ДНК молекула[уреди | уреди извор]

Репликација ДНК молекула је веома сложен и важан процес. Стога је пуно времена и труда је уложено у његово разумевање.
Ћелијска деоба је есенцијална за раст организма. Током деобе ћелија долази до репликације ДНК тако да свака од новонасталих ћелија има исти генетички садржај као и њихов родитељ. Дволанчана структура ДНК омогућава једноставан механизам за репликацију. Овде се два ланца раздвајају и формира се комплементарна секвенца за сваки од њих посредством ензима ДНК полимераза.[13] Тај ензим формира комплементарни ланац тако што налази коректну базу путем спаривања комплементарних база, и њиховог везивања на оригинални ланац. Пошто ДНК полимеразе могу да продуже једино ДНК ланац у 5’ ка 3’ смеру, други механизми се користе за копирање антипаралелних ланаца двоструког хеликса.[338] На тај начин, базе старог ланца одређују у којој секвенци се базе појављују у новом ланцу, и ћелија добија перфектну копију своје ДНК.
Репликација ДНК се такође може изводити ин витро (вештачки, изван ћелије). ДНК Полимеразе, изоловане из ћелија, и вештачки ДНК прајмери се користе за иницирање синтезе ДНК на познатим секвенцама молекулских темплета. Полимеразна ланчана реакција (ПЦР) је уобичајена лабораторијска техника у којој се примењује таква вештачка синтеза у цикличном режиму ради умножавања специфичног циљног ДНК фрагмента из ДНК смеше.
Еукариотска репликација[уреди | уреди извор]
Репликација ДНК молекула почиње на месту који се зове oriC локус.[334][335] Протеин ДНК-А се везује за oriC локус и притом се врши хидролиза аденозин трифосфата. Ово прво надовезивање доводи до почетног одвијања ДНК молекула из спирале у два линеарна ланца повезана водоничним везама. Да би репликација била успешна ДНК мора да постане линеарна, а не спирално увијена, дакле мора да изгледа као мердевине. Ензими који одвијају ДНК молекул у облик мердевине се зову хеликазе.[340][341] Ензими одвијају ДНК молекул веома брзо, чак 75 до 100 револуција у секунди.[342] Овакво брзо одвијање молекула ДНК може да доведе до стварања тензија полинуклеотидних ланаца. Ова појава тензија се на пример може видети када се увију пертле и када покушамо брзо да их раздвојимо, пертле се увију у чворове услед тензије. Да би се ово избегло стварање чворова које би могло да оштетити ДНК молекул, присутни су ензими који се зову ДНК топоизомеразе. Они попуштају водоничне везе како би се тензија и стварање чворића избегло.[56][57][58] У исто време док се ДНК молекул раздваја у облик мердевина, структура која се назива репликациона виљушка (или рачва)[341] иде одмах иза топоизомераза и раздваја водоничне везе између парова (А-Т и Г-Ц). Да би ови полинуклеотидни ланци остали раздвојени раздвајајући протеини се везују на обе стране сваког ланца и на тај начин одржавају ланце одвојене. Репликација ДНК молекула се може упоредити са рајсфершлусом. Када желимо да отворимо рајсфершлус, вучемо механизам надоле, и на тај начин добијамо две стране рајсфершлуса за раздвојеним зупчаницима. На исти начин се ДНК раздваја, при чему механизам рајсфершлуса представља репликациону виљушку.
Након раздвајања постоје два полинуклеотидна ланца, један иде у правцу 3'→ 5' док други иде у правцу 5'→ 3' (антипаралелност). Веома важан ензим који синтетише нове полинуклеотидне ланце ДНК полимераза δ,[343][344] може да синтетише нови ланац само у правцу 5'→ 3'. То није проблем за водећи ланац који се синтетише у правцу кретања репликационе виљушке.[345][346]
Синтезу оба ланца обавља ДНК полимераза тек пошто се веже за родитељски ланац који служи као матрица. Овај ензим не може да се веже за огољени ланац-матрицу већ захтева постојање зачетника (прајмера). Зачетник је кратки ланац РНК и његову синтезу катализује ензим примаза. Када се кратки ланац РНК комплементарно спари (хибридизује) са почетком ланца матрице то омогућује везивање ДНК полимеразе и почиње синтеза новог ланца. За синтезу ланца који заостаје потребно је да се синтетише већи број зачетника. Оказакијеве фрагменте, по завршетку синтезе, међусобно повезује ензим лигаза.[347][348]
Ланац који се синтетише правцу супротном од правца кретања репликационе виљушке 3' → 5' не може да буде синтетисан без прекида. Он се синтетише у фрагментима који се називају Оказакијеви Фрагменти[349][350] (названим по научнику Реији Оказаки који је први указао на њихово постојање 1966.[351]) и појављују се само на ланцу који иде у овом правцу. Они су комплементарни са темплетом заостајућег ланца, са којим формирају дволанчане ДНК секције. Оказакијеви фрагменти су између 100 до 200 нуклеотида дугачки код еукариота, док код Ешерихије коли имају 1 000 то 2 000 нуклеотида. Они су раздвојени РНК примерима од ~10-нуклеотида и до спајања долази након уклањања прајмера.
Да би нови ДНК молекул био комплетан и без прекида, ензим лигаза има улогу лепка и везује фрагменте један за други, и тако настају од једног ДНК молекула, два новоформирана ДНК молекула. ДНК полимераза β има важну улогу у провери нових ДНК молекула,[352][353] тако што иде дуж целих новонасталих ланаца, чита их и проверава да ли су све базе коректно повезане (А-Т и Г-Ц). ДНК репликација се зауставља када репликациона виљушка наиђе на секвенцу на ДНК молекулу који кодира за стопирање ДНК репликације.
Процес ДНК репликације је веома компликован. Један од разлога за ову комплексност је да новонастали ДНК молекули морају да буду тачни. Грешке у синтези ДНК молекула могу да доводе до разних болести и често су фаталне. Овај процес звучи веома невероватно када се узме у обзир да се нових 850 базних парова код прокариота синтетише у року од једне секунде, док је код еукариота ова брзина је нешто нижа, око 150 базних парова у једној секунди.
Прокариотска репликација[уреди | уреди извор]
| Bac_DnaA_C | |
|---|---|

| |
| Кристална структура DnaA домена у комплексу са ДНК кутијом (1J1V 1J1V)[354] | |
| Идентификатори | |
| Симбол | Bac_DnaA_C |
| Пфам | PF08299 |
| Пфам клан | CL0123 |
| ИнтерПро | IPR013159 |
| СКОП | 1j1v |
Прокариотска репликација ДНК је бидирекциона и започиње у центру репликације (OriC).[355]
Иницијацију ДНК репликације посредује DnaA[356], протеин који се везује за регион центра репликације познат као DnaA кутија. Код E. coli постоји пет DnaA кутија, свака од којих садржи девет високо конзервираних базних парова, консензус секвенцу 5' — TTATCCACA — 3'.[357] Последица везивања DnaA за тај регион је да ДНК постаје негативно супернамотана. Након тога, региони OriC испред DnaA кутија (познати као DnaB кутије) се отапају. Постоје три таква региона, и сваки је дугачак 13 базних парова, и богат АТ паровима (што олакшава топљење јер је мање енергије потребно за разлагање две водоничне везе. Тај регион има консензус секвенцу 5' — GATCTNTTNTTTT — 3.[358] За растапање DnaB кутија је неопходан аденозин трифосфат (који хидролизује DnaA). Након растапања, DnaA регрутује хексамерну хеликазу (шест DnaB протеина) на супротне крајеве растопљене ДНК. На том месту се формира репликациона виљушка. За регрутовање хеликазе је неопходно шест DnaC протеина, сваки од којих се везује за једну подјединицу хеликазе. Након формирања тог комплекса, додатних пет DnaA протеина се везује. DnaC се затим одваја, и комплекс је комплетан. Да би се ДНК репликација наставила потребан је једноланчани протеин који спречава једноланчане ДНК ланце да формирају секундарну структуру, као и за спречавање њиховог поновног међусобног спаривања. ДНК гираза[359][360] је потребна да би се умањио стрес узрокован формирањем негативних супернамотаја формираних посредством DnaB хеликазе.[361][362] Одмотавање ДНК DnaB хеликазом омогућава примази (DnaG[363][364]) полимерази да формира прајмер на сваком ДНК темплету тако да ДНК синтеза може да почне.
Након формирања прајмера, ДНK полимераза III холоензим започиње репликацију ДНК.[365][366] Њен каталитички механизам обухвата употребу два метална јона у активном месту. Овај ензим има способност разликовања дезоксирибонуклеотида и рибонуклеотида. Метални јони су генерално дивалентни катјони који помажу 3' OH да иницира нуклеофилни напад на алфа фосфат дезоксирибонуклеотида и да оријентише и стабилизује негативно наелектрисани трифосфат на дезоксирибонуклеотиду. Нуклеофилни напад 3' OH-а на алфа фосфат ослобађа пирофосфат, који се накнадно хидролизује (неорганском фосфатазом) у два фосфата. Ова хидролиза завршава синтезу ДНК.
Терминација репликације ДНК код Ешерихије коли се обавља путем употребе терминационих секвенци и Tus протеина.[336][337] Те секвенце омогућавају да две репликационе виљушке иду само у једном правцу. Репликација ДНК иницијално производи два повезана кружна ДНК дуплекса, сваки од којих се састоји од једног родитељског ланца и новоформираног ланца. Код Ешерихије коли топоизомераза IV раздваја кружне ДНК дуплексе.[367][368]
Фагне стратегије[уреди | уреди извор]
Неки бактериофагови имају само једну стратегију опстанка. Након инфекције подложног домаћина, они мењају његове ћелијске функције и подређују их производњи великог броја вирусних потомака. Резултат литичке инфекције је смрт бактеријског домаћина. У типичном литичком циклусу ДНК (или РНК) фага улази у ћелију домаћин, његови гени се транскрибују у одређеном реду, генетички материјал фага се репликује, и протеинске компоненте вируса се производе. Коначно, бактерија домаћин се отвара (лизира) да би се ослободило формирано потомство фага.
Други фагови имају двоструки начин постојања. Они могу да производе литичке циклусе, што је отворена стратегија којом се производи што више копија за што краће време. Они исто тако имају алтернативну форму постојања, у којој је геном фага присутан у бактерији у латентној форми познатој као профаг. Та форма пропагације се назива лизогенија. У лизогеној бактерији профаг је интегрисан у бактеријски геном, и наслеђује се на исти начин као и бактеријски гени. Услед поседовања профага, лизогена бактерија је имуна на даљу инфекцију другим фаговима истог типа. Имуност се успоставља интеграцијом једне копије профага, тако да бактеријски геном садржи само једну копију профага било ког типа. Транзиција се јавља између лизогеног и литичког мода постојања. Кад је фаг произведен литичким циклусом уђе у нову бактеријску ћелију, он било понавља литички циклус или улази у лизогено стање. Исход зависи од услова инфекције и генотипа фага и бактерије. Профаг се ослобађа лизогених ограничења процесом индукције, у коме се издваја из бактеријског генома, да формира слободну ДНК фага, која затим пролази кроз литички пут. Алтернативне форме у којима се фагови пропагирају су одређене регулацијом траскрипције. Лисогенија се одржава путем интеракције фагног репресора са оператором. За литички циклус је неопходна каскада транскрипционе контроле. Транзиција између два начина живота се остварује успостављањем репресије (литички циклус у лизогенију), или ослобађањем од репресије (индукција лизогена у литички циклус).
Плазмиди су још један тип постојања ДНК унутар бактерије. Они су аутономне јединице које постоје у ћелији као екстрахромозомни геноми. Плазмиди су саморепликујући кружни ДНК молекули, који се одржавају у ћелији са стабилним и карактеристичним бројем копија.[39] Другим речима, њихов број остаје константан из генерације у генерацију. Неки плазмиди такође имају алтернативне животне стилове. Они могу да постоје било у аутономном екстрахромозомском стању, или могу да буду уметнути у бактеријски хромозом, и онда су ношени као његов део попут било којег дела секвенце. Такве јединице се називају епизоми, мада се термини плазмид и епизом често користе као синоними. Попут лизогених фагова, плазмиди и епизоми одржавају себичну поседовање њихове бактерије и често онемогућавају другим елементима истог типа да се успоставе. Тај ефекат се назива имуност, мада се база плазмидне имуности разликује од лизогене имуности. Неки плазмиди и епизоми се преносе између ћелија путем конјугативног процеса који обухвата директни контакт између ћелија донора и примаоца.
Литички развој[уреди | уреди извор]
Геноми фага су неопходно мали.[40] Као и код свих вируса, они су ограничени потребом да се упакује нуклеинска киселина унутар протеинског омотача. То ограничење диктира многе виралне репродукционе стратегије. Типично вирус преузима контролу над ћелијом домаћина и користи њену структуру за репликацију и изражавање својих гена. Обично фаг садржи гене чија функција је осигуравање преферентне репликације фагне ДНК. Протеини кодирани тим генима обављају иницијацију репликације. Фаг може да садржи ген ДНК полимеразе. Фаг мења капацитет ћелије домаћина да обавља транскрипцију. То се постиже заменом РНК полимераза или модификовањем способности иницијације или терминације. Резултат је увек исти: фагни иРНК молекули су преферентно транскрибовани. У погледу синтезе протеина фаг се обично ослања на апарат домаћина, преусмеравајући његове активности заменом бактеријске иРНК фагном.
Литички развој се остварује биохемијским путем у коме се фагни гени изражавају у специфичном редоследу. Тиме се осигурава да је одговарајућа количина сваке компоненте присутна у одговарајуће време. Циклус се може поделити у два општа пута:
- Рана инфекција, која је период од улаза ДНК у ћелију до почетка репликације
- Касна инфекције је период од почетка репликације до крајњег корака лизирања ћелијског зида да би се ослободило фагно потомство.
Рана фаза је посвећена производњи ензима који учествују у репродукцији ДНК. То обухвата ензиме ДНК синтезе, рекомбинације, и понекад модификације. Њихове активности узрокују акумулацију резервоара генома фага. У том резервоару геноми се константно репликују и рекомбинују. Током касније фазе протеинске компоненте се синтетишу. Често је неопходно мноштво различитих протеина да би се формирале структуре главе и репа, тако да се највећи део генома фага састоји од структурних гена. Осим структурних протеина потребни су „монтажни протеини” који помажу у конструисању честица фагова, мада они сами не постају део финалних структура. До стадијума склапања структурних компоненти у главу и реп, репликација ДНК је достигла своју максималну брзину. Геноми се затим умећу у празне протеинске главе, репови се додају, и ћелија домаћина се лизира да би се омогућило ослобађање нових вирусних честица.
Организација фагне генетичке мапе често одражава секвенцу литичког развоја. Концепт оперона је донекле доведен до екстрема, у коме су гени који кодирају протеине са сродним функцијама груписани да би се омогућила њихова контрола са максималном ефикасношћу. То омогућава контролу пута литичког развоја са малим бројем регулаторних прекидача. Литички циклус је под позитивном контролом, тако да се свака група гена фага може изразити само након давања одговарајућег сигнала. Регулаторни гени функционишу у каскади у којој је ген изражен у једном стадијуму неопходан за синтезу гена који су изражени у следећем стадијуму. Тако је у сваком стадијуму експресије један или више активних гена регулатор који је потребан у следећем стадијуму. Регулатор може да има облик нове РНК полимеразе, сигма фактора који преусмерава специфичност домаћинове РНК полимеразе, или антитерминациони фактор који омогућава читање нове групе гена.
Први стадијум генске експресије се ослања на транскрипциони апарат ћелије домаћина. Обично је само неколико гена изражено у том стадијуму. Њихови промотери су као и промотери гена домаћина. Име ове класе гена зависи од фага. У већини случајева, они су познати као рани гени. Један од тих гена увек кодира протеин који је неопходан за транскрипцију следеће класе гена. Друга класа гена је позната као одложени рана или средња група. Њено изражавање типично почиње непосредно након кодирања регулаторног протеина. У зависности од природе контролног циклуса, иницијални сет раних гена може, или не мора да настави са даљом експресијом. Често долази до редукције изражавања гена домаћина. Два сета раних гена обухватају све функције фага изузев формирања протеинског омотача и лизирања ћелије. Кад репликација фагне ДНК започне, време да се изразе касни гени. Њихова транскрипција у овом касном стадијуму обично је узрокована регулаторним протеином које формиран у претходној фази. У случају ламбда фага то је антерминациони фактор, мада може да буде сигма фактор (као код SPO1).
Интерпретација генетичког кода[уреди | уреди извор]
Секвенца кодирајућег ланца ДНК, која се чита у смеру од 5' да 3', се састоји од нуклеотидних триплета (кодона) и одговара аминокиселинској секвенци протеина од N до C-терминуса. Секвенцирање ДНК и протеина омогућава директно поређење секвенци нуклеотида и аминокиселина. Транспортна РНК је адаптер који повезује кодон са одговарајућом аминокиселином. Транспортна ТРК има пивоталну улогу у синтези протеина. Она је посредник који омогућава транслацију кодона у аминокиселине. Значење кодона који представља аминокиселину је одређено његовом транспортном РНК, док значење терминирајућих кодона произилази директно из протеинских фактора.
Решавање генетичког кода је оригинално показало да се генетичка информација одржава у облику нуклеотидних триплета, али није било познато како кодони специфицирају одговарајуће аминокиселине. Пре развоја секвенцирања, релације између аминокиселине и кодона су одређене користећи два типа ин витро студија. Систем за транслацију синтетичких полинуклеотида је уведен 1961. и показано је да полиуридинска киселина (поли(U)) садржи инструкције за формирање полифенилаланина из фенилаланина.[369] Други систем је касније уведен у коме су тринуклеотиди кориштени за опонашање кодона узрокујући везивање одговарајуће тРНК за рибозом. Применом комбинације ове две технике су одређена значења кодона.
Пошто постоји више кодона (61) него амино киселина (20), скоро све аминокиселине су представљене са више кодона. Једини изузеци су метионин и триптофан. Кодони са истим значењем се називају синоними. Пошто се генетички код заправо чита на иРНК, он се обично описује користећи РНК базе: U, C, A и G. Кодони који представљају исту или сродне аминокиселине теже да имају сличне секвенце. Често база у трећој позицији кодона није значајна, јер четири кодона која се разликују у само у трећој бази представљају исту аминокиселину. У неким случајевима разлика се прави само између пурина и пиримидина у тој позицији. Умањена специфичност на задњој позицији кодона је позната као дегенерација треће базе.
Интерпретација кодона захтева спаривање база са антикодоном одговарајуће аминоацил-тРНК. Ова реакција се одвије унутар рибозома. Комплементарни тринуклеотиди у изолацији су сувише кратки да формирају стабилне интеракције. Унутар рибозома реакција је стабилизована његовим активном местом. Формирање базних парова између кодона и антикодона није само питање спаривања база, A-U и G-C. Рибозом контролише средину на такав начин да до конвенционалног спаривања долази на прве две позиције кодона, док су додатне реакције могуће на трећој бази. Резултат тога је да један аминоацил-тРНК молекул може да препозна више од једног кодона у складу са обрасцем дегенерације. На интеракције спаривања може да утиче увођење специјалних база на иРНК. Модификације у или близо антикодона директно утичу на способност иРНК да формира интеракције са жељеним кодонима, док модификације на другим местима могу да утичу на остале функције иРНК молекула.
Тренд да су сличне аминокиселине заступљене сродним кодонима умањује утицај мутација, и увећава вероватноћу да насумична промена једне базе неће произвести промену аминокиселине, или бар не промену у киселу различитог карактера. На пример, мутација CUC у CUG нема ефекта пошто оба кодона представљају леуцин, док мутација CUU у AUU производи замену леуцина са изолеуцином, који је блиско сродан.
- Табела РНК кодона
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Три кодона (UAA, UAG и UGA) која не представљају аминокиселине користе се за означавање тачке завршетка синтезе протеина. Крај сваког гена је означен једним од ових кодона.
Поређење ДНК секвенци са одговарајућим протеинским секвенцама је показало да се идентичан сет кодона користи код бактерија и еукариота. Консеквентно иРНК из једне врсте се обично може коректно транслирати ин витро и ин виво протеин синтетичким апаратом друге врсте. Другим речима кодони кориштени у иРНК једне врсте имају исто значење за рибозоме и тРНК других врста.
Универзалност кода иде у прилог претпоставци да је он морао бити формиран веома рано у току еволуције. Оригинално је можда постојао стереохемијски однос између аминокиселина и кодона, који је временом еволуирао до данашњег система селекцијом особина као што су већа ефикасност и прецизност. Могуће је да је код започет у примитивним формама код којих је мали број кодона кориштен за представљање малог броја аминокиселина, или да је чак један кодон одговарао било ком члану групе аминокиселина. Прецизнија значења кодона и додатне аминокиселине су можда еволуирали касније. Једна могућност је да су у почетку само две од три базе коришћене, и да је дискриминација треће позиције развијена касније. До замрзавања даље еволуције кода је могло да дође кад је систем постао довољно комплексан да би даље промене значења кодона унеле знатне поремећаје у постојеће протеине путем неприхватљивих замена аминокиселина. Његова универзалност сугерише да је до тога морало доћи у веома раним стадијумима живота тако да су га сви живи организми наследили из исте групе ћелија.
Варијације стандардног генетичког кода[уреди | уреди извор]
Док је постојање малих варијација стандардног кода било раније предвиђено[372], такви кодови су откривени тек 1979. кад је показано да људски митохондријални гени користе алтернативни код. Многе мале варијације су откривене од тада[373], укључујући разне алтернативне митохондријске кодове[374] и мале варијанте као што је транслација кодона UGA као триптофан у врстама микоплазме и транслација CUG као серин уместо леуцина код неких врста рода кандида.[375][376] Код бактерија и археја, GUG и UUG су често старт кодони, мада у ретким случајевима, поједини протеини могу да користе алтернативне старт кодоне који се нормално не користе код тих врста.[373]
У неким протеинима, нестандардне аминокиселине су замењене за стандардне стоп кодоне у зависности од сигналне секвенце информационе РНК. На пример, UGA може да кодира селеноцистеин, и UAG може да кодира пиролизин. Селеноцистеин се сматра двадесет првом аминокиселином, и пиролизин се сматра двадест другом.[373] Упркос тих разлика, сви познати природни кодови су веома слични један другом, и механизам кодирања је сличан за све организме: тробази кодони, тРНК, рибозоми, читање кода у истом смеру и транслација кода кодон по кодон у секвенцу аминокиселина. Проблем поремећаја узрокованих променама значења кодона је мање озбиљан код митохондрија, јер њихов ДНК кодира мали број протеина (~10). Промењени кодони вероватно нису били екстензивно коришћени у локацијама где би супституције аминокиселина биле штетне. Разноврсне промене нађене у митохондријама различитих врста сугеришу засебну еволуцију, са одсуством наслеђивања од заједничког древног митохондријског кода.
Минимум од 31 тРНК молекула (не рачунајући иницијатор) је неопходан за препознавање 61 кодона (најмање два тРНК молекула су неоходна за сваку кодонску фамилију и један је неопходан по кодонском пару). Код сисарских митохондрија постоје само 22 различита тРНК молекула. Критична особина је поједностављење кодон-антикодон упаривања тако да један тРНК препознаје сва четири члана кодонске фамилије. Тиме се минимални број тРНК молекула неопходних за препознавање свих уобичајених кодона редукује до 23. Употреба AGA(G) за терминацију редукује овај број даље до 22. Код свих осам кодонских фамилија, секвенца тРНК кодона садржи непромењен U на првој позицији антикодона. Преостали кодони су груписани у парове у којима се сви кодони који се завршавају пиримидинима читају модификованим G у антикодону, и сви кодони који се завршавају пуринима се читају модификованим U антикодона, као што је предвиђено хипотезом о неодређености трећег нуклеотида кодона. Компликација са UGG кодоном је избегнута променом кода да чита UGA са UGG као триптофан, и код сисара AUA престаје да представља изолеуцин и уместо њега се чита као и AUG за метионин. Тиме се омогућава читање свих кодона изван кодонских фамилија са 14 парова. Скуп од 22 идентификована гена стога кодирају 14 тРНК молекула који представљају парове, и 8 тРНК молекула који представљају фамилије. То оставља два некориштена терминациона кодона UAG i UAA које тРНК молекули не препознају, заједно са кодонским паром AGA(G). Слична правила следе митохондрије гљивица.
Поред општих промена кода, постоје специфичне промене у читању индивидуалних гена. Специфичност таквих промена подразумева да је читање појединог кодона зависно од окружујућих база. Упадљив промер је инкорпорација модификоване амино киселине селеноцистеина на појединим UGA кодонима унутар гена који кодирају селенопротеине код прокариота и еукариота. Обично ти протеини катализују реакције оксидо-редуцију, и садрже један селеноцистеински остатак, који формира део активног места. Најбоље је позната употреба UGA кодона у три -E. coli гена који кодирају формат дехидрогеназне изозиме. Интерни UGA кодон се чита помоћу селено-Cys-тРНК. Ова необична реакција је одређена локалном секундарном структуром иРНК, посебно присуством матичне петље у секвенци непосредно испод UGA. Мутације у четири Sel гена креирају дефицит селенопротеинске синтезе.
Кодон-антикодон препознавање[уреди | уреди извор]
Функција тРНК у протеинској синтези је извршена након препознавања кодона унутар рибозома. Интеракција између антикодона и кодона се састоји од спаривања база на начин који иде изван уобичајеног формирања G-C и A-U веза. Правила којима се покоравају ове интеракције се могу извести из секвенци антикодона. Способност било које тРНК да одговори на одређени кодон се може директно мерити путем теста тринуклеидног везивања или његовом употребом у ин витро протеинском синтетичком систему. Сам генетички код даје важне индикације о процесу препознавања кодона. Образац дегенерације треће базе указује да је у скоро свим случајевима та база или није релевантна, или се разлика прави само између пурина и пиримидина. Постоји осам фамилија кодона у којима сва четири кодона имају заједничке прве две базе, тако да треће нема улогу у специфицирању аминокиселине. Код седам кодонских парова значење не зависи од типа пиримидина у трећој позицији, и код пет кодонских парова то је случај са пурином.
Ако се на генетички код гледа у супротном смеру, постоје само три случаја код којих се јединствено значење добија присуством одређене базе у трећој позицији: AUG (за метионин), UGG (за триптофан), и UGA (терминација). Из тога следи да C и U немају јединствено значење у трећој позицији, док А никад не означава јединствену аминокиселину. Пошто је антикодон комплементаран са кодоном, прва база антикодона се спарује са трећом базом кодона. На пример кодон ACG / антикодон CGU означава:
Кодон 5' A C G 3' Антикодон 3' U G C 5'
| Прва база антикодона |
Трећа база кодона |
|---|---|
| U | A или G |
| C | само G |
| A | само U |
| G | C или U |
Често једна иРНК може да препозна више кодона. То значи да базе у првој позицији антикодона морају да имају способност формирања интеракција са алтернативним базама у одговарајућој трећој позицији кодона. Спаривање база у тој позицији не може да буде ограничено на уобичајене G-C и A-U парове. Правила која одређују обрасце препознавања се могу сумирати хипотезом флексибилности, која наводи да спаривање између кодона и антикодона у прве две позиције кодона увек следи уобичајена правила, док се флексибилност јавља у трећој позицији. До тога долази зато што конформација петље тРНК антикодона омогућава флексибилност на првој бази антикодона. Правила препознавања треће базе кодона дозвољавају додатно спаривање између G и U. Та једна промена формира образац базног спаривања у коме А више нема јединствено значење у кодону, јер U које га препознаје мора исто тако да препозна G. Слично томе C такође више нема јединствено значење, јер G које га препознаје мора такође да препозна U. Препознавање јединствених кодона је могуће само кад је трећа база G или U. Та опција се не користи често. UGG и AUG су једини примери првог типа, а нема примера другог типа.
G-U парови су чести у РНК дуплекс структурама. С друге стране формирање стабилних контакта између кодона и антикодона, где се само три пара база могу формирати је знатно ограниченије, и стога G-U парови могу да допринесу само у задњој позицији кодона.
Утицај модификованих база на тРНК[уреди | уреди извор]
Транспортна РНК је јединствена међу нуклеинским киселинама по свом садржају „неуобичајених” база. Неуобичајена база је сваки пурински или пиримидински прстен изузев уобичајених A, G, C и U које улазе у састав свих РНК. Све друге базе се формирају путем модификације једне од четири базе након њене инкорпорације у полирибонуклеински ланац. Све класе РНК показују известан степен модификација, али свим случајевима изузев тРНК то је ограничено на веома једноставне случајеве, као што је адиција метил група. Код тРНК се јавља широк низ модификација, које се крећу од од једноставне метилације до потпуне реконструкције пуринског прстена. Модификације се јављају у свим деловима тРНК молекула. Листа модификованих нуклеотида садржи око педесет база.
Модификације пиримидина (C и U) су мање комплексне од модификација пурина (A и G). Осим модификација самих база, долази и до метилације на 2'-O позицији рибозног прстена. Најчешће модификације уридина су једноставне. Метилација у позицији 5 креира риботимидин (T). База је иста са базом тимидина, али је везана за рибозу уместо дезоксирибозе. Дихидроуридин (D) се формира засићењем двоструке везе, чиме се мења прстен. У псеудоуридину (Ψ) су замењене позиције N и C атома прстена, док 4-тиоуридин има сумпор уместо кисеоника. Нуклеозид инозин се нормално јавља у ћелијама као интермедијар пута биосинтезе пурина. Он се не уноси директно у РНК, него се формира модификацијом аденозина. Друге модификације анаденозина су додаци комплексних група. Две комплексне серије нуклеозида се формирају променом гуанозина. Q базе попут кјуозина, имају додатни пентенилни прстен додат преко NH везе на метил групу 7-метилгуанозина. Пентенилни прстен може да носи различите групе. Y базе попут виозина, имају додатни прстен кондензован са пуринским прстеном. Тај додатни прсте има дугачак ланац на коме могу да буду присутне разне групе.[1]
Реакција модификација се обично састоје од промене или адиције постојећих база у тРНК. Изузетак је синтеза Q база, где специјални ензими замењују гуанозински остатак кјуозинским остатком у РНК. Реакција се састоји од раскидања и формирања веза са обе стране нуклеозида. Остали модификовани нуклеозиди се синтетишу специфичним тРНК модификујућим ензимима. Оригинални нуклеозид присутан у датој позицији се може одредити било поређењем секвенце тРНК са геном или путем изоловања прекурсорског молекула коме недостају неке или све модификације. Секвенце прекурсора показују да се различите модификације уводе у различитим фазама током матурације ДНК. Неке модификације су константне особине свих тРНК молекула, на пример D остаци по којима је формирано име Д рука, и Ψ нађен у TΨC секвенци. На 3' крају антикодона се увек јавља модификовани пурин, мада модификација може знатно да варира. Друге промене су специфичне за поједине тРНК молекуле или групе тРНК молекула. На пример, виозинске базе су карактеристика тРНКPhe код бактерија, квасаца и сисара.
Особине које препознају тРНК модификујући ензими су непознате. Кад је специфична модификација присутна на више места у тРНК молекулу то не мора да значи да је исти ензим направио све промене, на пример, различити ензими могу да буду потребни за синтезу псеудоуридина на свакој локацији. Постоји знатан број модификујућих ензима. Неки ензими врше појединачне реакције са индивидуалним РНК молекулима, док други имају шири опсег супстрата. Поједине промене се врше путем сукцесивног дејства више ензима. Најдиректнији учинак модификације је у антикодону, где промена секвенце утиче на способност везивања кодона, те одређује значење тРНК молекула. Промене на другим местима у близини антикодона исто тако утичу на везивање кодона. Промена база антикодона може да формира додатне обрасце упаривања база, као што су тиоурацил-гуанин, урацил-инозин, и аденин-инозин.
Интеракције са протеинима[уреди | уреди извор]
Функционисање ДНК је зависно од интеракција са протеинима. Протеинске интеракције могу да буду неспецифичне, или се протеин може везати за специфичну ДНК секвенцу. Ензими се такође везују за ДНК, и међу њима су посебно важне полимеразе које копирају ДНК секвенцу током транскрипције и репликације ДНК.
ДНК везујући протеини[уреди | уреди извор]

|

Структурни протеини који се везују за ДНК су добро изучени примери неспецифичних ДНК-протеин интеракција. У хромозомима, ДНК је смештена у комплексима са структурним протеинима. Ти протеини организују ДНК у компактне хроматинске структуре. Код еукариота у њима је ДНК везана у комплексе са хистонима, док је код прокариота више типова протеина присутно.[378][379] Хистони формирају комплексе у облику диска, нуклеозоме. Те неспецифичне интеракције се формирају путем јонских веза између базних остатака хистона са киселом шећерно фосфатном основом ДНК, те су стога у знатној мери независне од секвенце база.[47]
Хемијске модификације базних аминокиселинских остатака су метилација, фосфорилација и ацетилација.[380] Те хемијске промене мењају јачину интеракције између ДНК и хистона, што чини ДНК мање доступном за транскрипционе факторе те се мења брзина транскрипције.[381] Други неспецифични ДНК везујући протеини у хроматину су групе протеина високе мобилности, које се везују да би се савила или искривила ДНК.[382] Ти протеини су важни у савијању група нуклеозоме и њиховог организовања у веће структуре које сачињавају хромозоме.[383]
Посебна група ДНК-везујућих протеина су протеини који се специфично везују једноланчану ДНК. Код људи, репликациони протеин А је најбоље изучени члан ове фамилије. Он учествује у процесима где је двоструки хеликс раздвојен, укључујући репликацију ДНК, рекомбинацију и поправку ДНК.[384] Везивање тих протеина стабилизује једноланчану ДНК и штити је од формирања матичних петљи (узрокованих упаривањем база исто ланца), као и од деградације нуклеазама.
Други протеини су еволуирали да се вежу за специфичне ДНК секвенце. Међу њима су најинтензивније студирани различити транскрипциони фактори, који регулишу транскрипцију. Сваки транскрипциони фактор се везује за један специфичан сегмент ДНК секвенце, и активира или инхибира транскрипцију гена који имају те секвенце у близини њихових промотера. Транскрипциони фактори делују на два начина. Они могу да се вежу за РНК полимеразу одговорну за транскрипцију, било директно или путем других посредничких протеина. Тиме се доводи полимераза на промотер и омогућава почетак транскрипције.[385] Алтернативно, транскрипциони фактори се могу везати за ензиме који модификују хистоне на промотерима. Тиме се мења приступачност ДНК темплета за полимеразе.[386]
Ови ДНК циљеви се могу јавити широм генома једног организма, те стога промене у активности једног типа фактора транскрипције фактора могу да утичу на хиљаде гена.[387] Консеквентно, ти протеини су често мета за процесе преноса сигнала који контролишу одговоре на промене у околини, или на ћелијску диференцијацију и развој. Специфичност интеракција транскрипционих фактора са ДНК молекулом се производи контактом протеина са ивицама ДНК база, што им омогућава да „читају” ДНК секвенце. Већина тих интеракција са базама се одвија у главном жлебу, где су базе најприступачније.[22]
Ензими који модификују ДНК[уреди | уреди извор]
Нуклеазе[уреди | уреди извор]


Нуклеазе су ензими који пресецају ДНК ланце путем катализовања хидролизе фосфодиестарских веза. Нуклеазе које хидролизују нуклеотиде са крајева ДНК ланаца се називају ексонуклеазе, док ендонуклеазе могу да пресецају унутар ланаца.
Егзонуклеазе одвајају један по један нуклеотид са краја полинуклеотидног ланца. Реакцијом хидролизе се раскидају фосфодиестерске везе са било 3’ или 5’ краја. Еукариоти и прокариоти имају три типа егзонуклеаза које учествују у нормалном промету иРНК: 5’ до 3’ егзонуклеаза, која је зависна од декапирајућег протеина, 3’ до 5’ егзонуклеаза, која је независтан протеин, и поли(А)-специфична 3’ до 5’ егзонуклеаза.[392][393]
Најчешће коришћене нуклеазе у молекуларној биологији су рестрикционе ендонуклеазе, које пресецају ДНК на специфичним секвенцама. На пример, EcoRV ензим препознаје шестобазну секвенцу ATC-3’ и пресеца је на месту означеном вертикалном линијом. У природи, ти ензими штите бактерије против фагне инфекције. Након уноса фагне ДНК у бактеријску ћелију на њу делује рестрикциони модификациони систем.[394] У технологији се нуклеазе специфичне за поједине секвенце користе у молекулском клонирању и ДНА рекомбинацији.
Флап ендонуклеазе (такође познате као 5' нуклеазе у старијој литератури) су класа нуклеолитичких ензима који делују као 5'-3' егзонуклеазе и структурно специфичне ендонуклеазе на специјализованим ДНК структурама које се јављају током репликације, поправке и рекомбинације ДНК. Флап ендонуклеазе су идентификоване код еукариота, прокариота, археја и неких вируса. Организми могу да имају више од једног хомолога. Ова редундантност може да служи као индикација важности ових ензима. Код прокариота, флап ендокриназе су присутне на N-терминусном домену ДНК полимеразе I. Неки прокариоти кодирају и други хомолог.[395][396][397]
| Ензим | Извор | Секвенца препознавања | Пресецање |
|---|---|---|---|
| EcoRI | Ешерихија коли | 3'CTTAAG |
3'---CTTAA G---5' |
Многе ендонуклеазе пресецају ДНК у позицијама које нису директно једна наспрам друге, те се старају препусти. Пример такве нуклеазе је EcoRI.[398][399] Кад овај ензим наиђе на своју секвенцу препознавања, он пресеца сваки ланац између G и најближег А базног остатка. Након пресецања, новонастали фрагменти се држе заједно само посредством релативно слабих водоничних веза које спрежу комплементарне базе. Мала јачина ових веза омогућава ДНК фрагментима да се одвоје један од другог. Сваки резултујући фрагмент има истурени 5' крај који се састоји од неспарених база. Други ензими пресецају ДНК ланце на супротан начин тако да се формирају истурени 3' крајеви. Ови једноланчани крајеви, 3' и 5', се понекад називају лепљиви крајеви зато што они имају тенденцију да се везују са комплементарним секвенцама база. Другим речима, ако неспарени сегмент база (5' A A T T 3') наиђе на други неспарени сегмент са секвенцом (3' T T A A 5') они ће се везати један за други. Лигазе затим спајају фосфатне основе та два молекула. Ћелијско порекло лепљивих крајева нема утицаја на њихову способност спајања. Сваки пар комплементарних секвенци има тенденцију везивања, чак и у случају комбинација дугачких хуманих ДНК секвенци и бактеријске ДНК. Ово својство омогућава производњу рекомбинантних ДНК молекула, који се састоје од ДНК фрагмената из различитих извора, и који су формирани применом техника генетичког инжењеринга.
Лигазе[уреди | уреди извор]
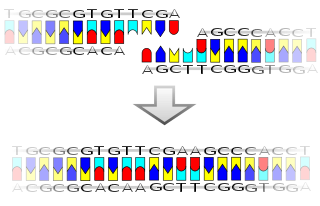
Ензими ДНК лигазе могу да споје одсечене или покидане ДНК ланце.[400][401][402] Лигазе су посебне важности у репликацији ДНК заостајућег ланца, где оне спајају кратке сегменте ДНК произведене на репликационој виљушци у комплетну копију ДНК темплета. Оне се такође користе у ДНК поправци и генетичкој рекомбинацији.[400]
Механизам рада ДНК лигазе се састоји од формирања две ковалентне фосфодиестарске везе између 3' хидроксилног краја једног нуклеотида, (акцептора) и 5' фосфатног краја другог (донора). АТП је неопходан за одвијање реакције посредоване лигазом. Реакција се одвија у три степена: (1) аденилација (адиција АМП-а) аминокиселинског остатка у активном центру ензима, пирофосфат се ослобађа; (2) трансфер АМП-а на 5' фосфат донора, чиме се формира пирофосфатна веза; (3) формирање фосфодиестарске везе између 5' фосфата донора и 3' хидроксила акцептора.[403][404][405]
Лигаза такође може да спаја тупе крајеве, мада су више концентрације ензима и различити експериментални услови неопходни.[406][407]
Код сисара постоје четири специфична типа лигазе.[408]
- ДНК лигаза I: лигира новоформирани ДНК заостајући ланац након што рибонуклеаза Х уклони РНК прајмер са Оказакијевих фрагмената.
- ДНК лигаза II: алтернативно сплајсована форма ДНК лигазе III која је присутна у ћелијама које се не деле.
- ДНК лигаза III: формира комплексе са протеином ДНК поправке XRCC1 да би помогла у спајању ДНК током процеса корекције ДНК.
- ДНК лигаза IV: формира комплексе са XRCC4. Она катализује финални корак у спајању нехомогених крајева ДНК током поправке раскинутог двоструког ланца. Он је такође неопходна за В(Д)Ј рекомбинацију, процес којим се генерише разноврсност имуноглобулина и локуса Т-ћелијских рецептора током развоја имунског система.
ДНА лигаза код E. coli користи енергију стечену раскидањем никотинамид аденин динуклеотида (НАД) да формира фосфодиестерску везу.[356] ДНК лигаза еукариота као и неких микроба користи аденозин трифосфат (АТП) уместо НАД-а.[356]
Топоизомеразе[уреди | уреди извор]

Постоје три главна типа топологије: супернамотавање, учворавање и катенација. Изван есенцијалних процеса репликације или транскрипције, ДНК се одржавана у компактном облику, и ова три тополошка стања помажу у томе.[57] Међутим, у току транскрипције или репликације ДНК мора бити слободна, те ова три стања знатно ометају процес. Додатно, током репликације, новоформирани и оригинални ДНК дуплекси се испреплећу и морају бити комплетно раздвојени да би се одржао геномски интегритет ћелија током деобе. Како транскрипциони мехур напредује, ДНК испред транскрипционе виљушке постаје прекомерно увијена, или позитивно супернамотана, док ДНК иза транскрипционог мехура постаје одвијена, или негативно супернамотана.
Топоизомеразе могу да реше ове тополошке проблеме. Оне су ензими са нуклеазном и лигазном активношћу. Ови протеини мењају количину супернамотавања у ДНК молекулу. Део ензима ове групе делује тако што пресецају ДНК хеликс и омогућавају једној секцији да ротира, чиме се умањује њен ниво супернамотавања. Ензим затим затвара ДНК прекид.[56] Други типови ових ензима имају способност прекидања једног ДНК хеликса и затим пропуштања другог ланца кроз овај прекид, пре него што поново споје хеликс.[410]
Топоизомеразе се деле на два типа на основу броја пресечених ланаца у једном кругу деловања:[411] Обе класе ензима користе конзервирани тирозин, међутим ови ензими су структурно и механистички различити.
- Тип I топоизомераза пресеца један ланац ДНК двоструког хеликса, долази до релаксације, и након тога пресечени ланац се повеже. Тип I топоизомеразе се даље деле у две подкласе: тип IA топоизомеразе, које имају заједничке многе структурне и механистичке особине са топоизомеразама типа II, и тип IB топоизомеразе, које користе контролисани ротациони механизам. Примери тип IA топоизомераза су topo I и topo III. Историјски, тип IB топоизомеразе су називане еукариотске topo I, мада су IB топоизомеразе присутне у свим животним доменима. Тип IA топоизомеразе формирају ковалентни интермедијар са 5' ДНК крајем, док IB топоизомеразе формирају ковалентни интермедијар са 3' ДНА крајем. Недавно је тип IC топоизомераза била идентификована. Она се назива topo V. Док је она структурно јединствена у односу на тип IA и IB топоизомеразе, она има сличан механизам са топоизомеразом типа IB .
- Тип II топоизомераза пресеца оба ланца ДНК двоструког хеликса.[409] Такође постоје две подкласе: тип IIA и тип IIB топоизомеразе, које имају сличне структуре и механизам. Примери тип IIA топоизомеразе су еукариотски topo II, E. coli гираза, и E. coli topo IV. Пример типа IIB топоизомеразе је topo VI.
Оба типа (I и II) топоизомеразе мењају ДНК коефицијент везивања.[412] Топоизомеразе типа IA мењају коефицијент везивања за један, тип IB и тип IC топоизомеразе мењају тај параметар за било који цео број, док тип IIA и тип IIB топоизомеразе мењају коефицијент везивања за два.
Хеликазе[уреди | уреди извор]
Хеликазе су протеини који су тип молекулских мотора. Оне користе хемијску енергију нуклеозид трифосфата, предоминантно АТП-а, да раскину водоничне везе између база и да одвију ДНК двоструки хеликс у једноструке ланце.[413] Ови ензими су есенцијални за већину процеса у којима је неопходно да се раздвоје ланци ДНК ланци (репликација ДНК, транскрипција, транслација, рекомбинација, ДНК поправка, биогенеза рибозома). Оне се постепено крећу дуж двоструког ланца нуклеинске киселине. Правац и механизам дејства су зависни од типа ензима.[414]

Хеликазе попримају различите структуре и олигомеризациона стања. DnaB хеликазе имају облик хексамерног прстена. Други ензими су активни у облику мономера или димера. Испитивања су показала да хеликазе могу да делују пасивно, чекајући да дође до некаталисаног одвијања након чега оне раздвајају ланце,[416] или да активно учествују у сепарацији ланаца користећи енергију генерисану хидролизом АТП-а.[417] У овом другом случају, хеликазе делују попут молекулских мотора, одвијајући и транслоцирајући свој супстрат користећи хемијску енергију.[418] Хеликазе могу да функционишу много брже ин виво него ин витро услед присуства помоћних протеина који посредују дестабилизацију ДНК рачве.[418]
Хеликазе се класификују у неколико суперфамилија. Све хеликазе везују АТП, и стога садрже класичне мотиве: Валкер А (петља везивања фосфата или П-петља) и Валкер Б (аспартична киселина за везивање Mg2+).[414]
- Суперфамилија I: UvrD (ДНК поправка код E. coli), Rep (ДНК репликација код E. coli), PcrA (рекомбинација код Staphylococcus aureus), Dda (иницијација репликације бактериофага Т4), RecD (рекомбинациона поправка код E. coli), TraI (конјугативни ДНК трансфер Ф-плазмида). Ова фамилија обухвата РНК хеликазе који учествују у одмотавању дуплекса током виралне РНК репликације.[419]
- Суперфамилија II: RecQ (ДНК поправка E. coli), eIF4A (РНК транслација код пекарског квасца), WRN (ДНК поправка), NS3[420] (репликација Хепатитис Ц вируса)
- Суперфамилија III: LTag (репликација SV40 вируса), E1 (репликација Људског папиломског вируса), Rep (репликација, вирална интеграција, и паковање Адено асоцираног вируса). Суперфамилија 3 се састоји од хеликаза које углавном кодирају мали ДНК вируси и неки од великих нуклеоцитоплазматичних ДНК вируса.[49][421]
- Фамилија слична DnaB хеликази: DnaB (репликација E. coli), gp41 (ДНК репликација бактериофага Т4), T7gp4 (ДНК репликација бактериофага Т7).
- Фамилија слична Ро фактору: Ро (терминација транскрипције E. coli).
Ове суперфамилије не обухватају све познате хеликазе. На пример, XPB[422] i ERCC2[423] су хеликазе које нису сврстане у горе наведене фамилије.
Дефекти гена који кодирају хеликазе могу да узрокују Вернеров синдром. То је поремећај који је препознатљив по појави превременог старења.[424][425]
Полимеразе[уреди | уреди извор]

Полимеразе су ензими који синтетишу полинуклеотидне ланце из нуклеозидног трифосфата. Секвенце њихових продуката су копије постојећих полинуклеотидних ланаца — који се називају темплетима. Ови ензими функционишу тако што додају нуклеотиде на 3’ хидроксилну групу претходног нуклеотида у ДНК ланцу. Консеквентно, све полимеразе иду у 5’ ка 3’ смеру.[427] У активном месту тих ензима, нови нуклеозид трифосфат формира базни пар са темплетом, чиме омогућава полимерази да прецизно синтетише комплементарни ланац. Полимеразе се класификују по типу темплета који користе.
Током репликације ДНК, ДНК полимеразе формирају копију ДНК секвенце. Прецизност је од виталног значаја у овом процесу, тако да многе полимеразе имају способност вршења корекција. Полимераза лако препознаје повремене грешке у реакцији синтезе зато нема базног спаривања између неусклађених нуклеотида. Ако се неслагање детектује, 3’ ка 5’ егзонуклеаза се активира и погрешна база се уклања.[428] У већини организама, ДНК полимеразе функционишу унутар великих комплекса. Они се називају реплизомима и садрже низ помоћних подјединица, као што су ДНК стеге и хеликазе.[429]
ДНК полимеразе које су зависне од РНК су специјализована класа полимераза која копира секвенцу РНК ланца у ДНК. У ову класу се убрајају реверзна транскриптаза, која је вирални ензим који учествује у инфекцији ћелија ретровирусима, и теломераза, која је неопходна за репликацију теломера.[111][430] Теломераза је необична полимераза зато што садржи свој сопствени РНК темплет, као интегрални део своје структуре.[113]
Транскрипцију изводи ДНК-зависна РНК полимераза која копира секвенцу ДНК ланца у РНК. Да би започела транскрипцију гена, РНК полимераза се веже за ДНК секвенцу промотера и раздвоји ДНК ланце. Она затим копира секвенцу гена на иРНК транскрипт док не дође до ДНК региона који се назива терминатор, где се зауставља и одваја од ДНК. Као и ДНК полимеразе, РНК полимераза II, ензим који транскрибује већину гена у геному еукариота, оперише као део већег протеинског комплекса са вишеструким регулаторним подјединицама.[431][432][433] РНК полимераза II је комплекс са масом од 550 kDa, који се састоји од дванаест подјединица. RNAP II је најбоље испитани тип РНК полимеразе. Знатан број транскрипционих фактора је неопходан да би се овај ензим везао за промотере и почео транскрипцију.
Еволуција[уреди | уреди извор]
ДНК садржи генетичке информације које омогућавају свим животним формама да функционишу, расту и размножавају се. Међутим, није јасно колико дуго је током задњих четири милијарде година историје живота ДНК обављала ту функцију. По једној претпоставци најраније форме живота су користиле РНК као основу генетичког материјала.[434][435] Могуће је да је РНК деловала као централни део раног ћелијског метаболизма пошто она има способност преноса генетичке информације, као и извођења катализе у оквиру рибозима.[436] Такав древни РНК свет у коме би нуклеинска киселина била коришћена за катализу и генетику је можда утицао на еволуцију садашњег генетичког кода базираног на четири нуклеотидне базе. До тога би дошло, пошто би број различитих база у таквом организму био компромис између малог броја база којим се повећава репликациона прецизност и већег броја база којим се увећава каталитичка ефикасност рибозима.[437]
Не постоје директни докази за постојање таквих древних генетичких система. Разлог за то је ДНК екстракција из велике већине фосила није могућа пошто ДНК може да опстане мање од милион година. У влажној средини она се временом разлаже у кратке фрагменте.[438] Упркос томе, налази старије ДНК су били објављени. На пример, познат је извештај о изолацији одрживе бактерије из кристала соли старог 250 милиона година.[439] Ти налази су контроверзни.[440][441]
Један извештај објављен августа 2011. који је базиран на НАСА испитивањима метеорита нађеног на Земљи сугерише да градивни блокови ДНК (аденин, гуанин и сродни органски молекули) можда имају ванземаљско порекло.[442][443][444]
Технолошка примена[уреди | уреди извор]
Генетички инжењеринг[уреди | уреди извор]
Генетички инжењеринг је директна људска манипулација генома неког организма користећи модерну ДНК технологију. Она обухвата увођење стране ДНК или синтетичких гена у организам. Увођење нове ДНК не захтева употребу класичних генетичких метода, међутим традиционални методи узгоја се типично користе за пропагацију рекомбинантних организама. Организам који је формиран увођењем рекомбинантне ДНК се сматра генетички модификованим организмом. Први генетички модификовани организми су биле бактерије 1973. и затим мишеви 1974. Бактерије које производе инсулин су комерцијализоване 1982. и генетички модификована храна је у продаји од 1994.
Методе су развијене за ДНК пречишћавање из ћелија организма, као што је фенол-хлороформна екстракција, и за њену лабораторијску манипулацију, нпр. рестрикциона разлагања и полимеразна ланчана реакција. Модерна биологија и биохемија интензивно користе те технике у оквиру рекомбинантне ДНК технологије. Рекомбинантна ДНК је вештачка ДНК секвенца која је формирана од других ДНК секвенци. Такве секвенце се могу унети у организам у облику плазмида или у одговарајућем формату, користећи вирални вектор.[445]
Најчешћа форма генетичког инжењеринга је уметање новог генетичког материјала на непознатој локацији у геному домаћина. То се остварује изоловањем и копирањем жељеног генетичког материјала користећи методе молекулског клонирања да би се формирала ДНК секвенца која садржи неопходне генетичке елементе за експресију, и затим њено уметање у организам домаћина. Друге форме генетичког инжењеринга су циљање гена (замена базирана на хомологној рекомбинацији) и уклањање (нокаут) специфичних гена путем пројектованих нуклеаза као што су нуклеазе цинковог прста,[446] или пројектоване хоминг ендонуклеазе.[447]
Технике генетичког инжењеринга се користе у бројним пољима научних истраживања, биотехнологији, и медицини. Генетички модификовани организми налазе примену у изради производа као што су рекомбинантни протеини, они се користе у медицинским истраживањима,[448] и као пољопривредни усеви.[449][450][451] Лекове као што су инсулин и људски фактор раста производе бактерије, експериментални мишеви као што су онкомишеви и нокаут мишеви се користе у истраживањима, репеланти инсеката и/или усеви толерантни на хербициде су комерцијализовани. Генетички модификоване биљке и животиње које имају способност производње биотехнолошких лекова уз мање трошкове производње од садашњих метода се такође развијају. ФДА је 2009. одобрила продају фармацеутског протеина антитромбина произведеног у млеку генетички модификоване козе.[452]
Форензика[уреди | уреди извор]
Форензичка анализа може да користи ДНК из крви, сперме, коже, пљувачке или косе нађене на месту злочина за идентификацију подударајуће ДНК неке особе, као што је починилац. Овај процес се формално назива ДНK профилисање, а познат је и као „узимање генетичког отиска”. Мада је 99,9% ДНК секвенци исто код свих људи, довољна количина ДНК се разликује, тако да могуће разликовати једну особу од друге, уколико оне нису монозиготни близанци.[453] У ДНК профилисању, дужина променљивих секција понављајуће ДНК, као што су кратка тандемна понављања и минисателити,[454] се пореде између људи. Тај метод је обично изузетно поуздана техника за идентификацију подударне ДНК.[455] Међутим, идентификација може да буде компликована ако је место злочина контаминирано са ДНК-ом од неколико људи.[456][457] ДНК профилисање је развио 1984. британски генетичар Сир Алек Џефриз,[458] и први пут је коришћено у форензичкој науци да се осуди Колин Пичфорк 1988, у случају Ендерби убистава.[459]
Развој форензичке науке, и способности да се добију генетичка подударања коришћењем веома малих узорака крви, коже, пљувачке или косе је довела до поновног испитивања бројних случајева. Генетичким профилисањем се може произвести евиденција која није постојала током оригиналног испитивања. У комбинацији са уклањањем закона о поновљеним судским процесима, постало је могуће да се поново отворе случајеви са ранијим неуспешним пресудама услед недостатка евиденције. Од људи оптужених за тешке злочине се захтева да дају узорак ДНК ради профилисања. Резултати ДНК профилисања се често доводе у питање тврдњама о контаминацији током узимања узорака. То је довело до развоја детаљних и строгих процедура руковања узорцима нових случајева тешких кривичних дела.[460] ДНК профилисање се такође користи за идентификацију жртава масовних инцидената.[461] Осим позитивне идентификације тела или делова тела озбиљних инцидената, ДНК профилисање се успешно користи и за идентификацију жртава у масовним ратним гробницама, путем ДНК поређења са члановима породице.[462]
Биоинформатика[уреди | уреди извор]
Биоинформатика се бави манипулацијом, претраживањем и анализом биолошких података, што обухвата ДНК секвенце. Термин биоинформатика је скован пре почетка „геномске револуције”. Паулиен Хогевег и Бен Хеспер су увели овај термин 1978. са значењем „студирање информационих процеса у биолошким системима”.[463][464] Ова дефиниција ставља биоинформатику као поље паралелно са биофизиком или биохемијом.[464] Међутим, њена примарна употреба од касних 1980-их је било описивање примене информатике и информационих наука у анализи биолошких података, посебно у областима геномике које се баве ДНК секвенцирањем великих размера.
Током задњих неколико декада брз развој геномике и других молекуларних истраживачких технологија, у комбинацији са развојем информационих технологија су произвели огромне количине молекуларно биолошких информација. Развој техника за складиштење и претраживање ДНК секвенци су довели до широке примене софистициране информатике, посебно алгоритама за претрагу низова, машинског учења и теорије база података.[465] Претраживање низова или примена алгоритама подударања, који налазе појаву секвенце слова унутар веће секвенце слова, су развијени специфично за претраживање нуклеотидних секвенци.[466] ДНК секвенца се може поравнати са другим ДНК секвенцама да би се идентификовале хомологне секвенце и лоцирале специфичне мутације које их чине особеним. Те технике, а посебно поравнавање вишеструких секвенци, се користе у студирању филогенетичких односа и протеинске функције.[467]

Податке који обухватају целокупне геноме, као што су на пример подаци које је произвео Пројекат људског генома, је тешко користити без записа који идентификују локације гена и регулаторних елемената на сваком хромозому. Региони ДНК секвенце који имају карактеристичне обрасце асоциране са протеинским или РНК кодирајућим генима се могу идентификовати применом алгоритама за предвиђање гена, који омогућавају формирање хипотеза о постојању специфичних генских производа и о њиховим могућим функцијама у поједином организму пре него што дође до њихове експерименталне идентификације и изолације.[468] Поређења целокупних генома могу да дају индикације о еволуционој историји појединог организма и омогуће разматрање комплексних еволуционих догађаја.
Биоинформатика је примењивана од самог почетка „геномске револуције”. Она се користи у формирању и одржавању база података за складиштење биолошких информација, као што су нуклеотидне и аминокиселинске секвенце. Развој тог типа база података се састоји не само од пројектовања структуре података, него и од развоја комплексних интерфејса који омогућавају приступ постојећим подацима, као и уноса нових или ревидираних података.
Да би се изучавало како се нормалне ћелијске активности мењају у различитим стањима болести, биолошки подаци се морају комбиновати. На тај начин се формира свеобухватна слика тих активности. Поље биоинформатике је еволуирало тако што је фокус стављен на анализу и интерпретацију мноштва различитих типова података. То обухвата нуклеотидне и аминокиселинске секвенце, протеинске домене, и протеинске структуре.[469] Сам процес анализирања и интерпретације података се назива рачунска биологија. Важне поддисциплине у оквиру биоинформатике и рачунске биологије су:
- развој и имплементација оруђа која омогућавају ефикасан приступ, коришћење и управљање различитим типовима информација.
- развој нових алгоритама и статистичких техника за одређивање односа и релација међу члановима великих група података. На пример, методи за лоцирање гена у секвенцама, предвиђање протеинске структуре и/или функције, и груписање протеинских секвенци у фамилије сродних секвенци.
Примарни циљ биоинформатике је повећавање разумевања биолошких процеса. Оно што је издваја од других приступа је њен фокус на развоју и примени рачунарски интензивних техника за постизање овог циља. Неки од примера тога су: алгоритми за препознавање образаца, анализу података и машинско учење, као и технике за визуелизацију биолошких података. Главни истраживачки напори у области укључују поравнавање секвенци, налажење гена, изучавање структуре генома, дизајн лекова, откривање лекова, структурно поравнавање протеина, предвиђање протеинске структуре, предвиђање експресије гена и протеин-протеин интеракција, изучавања геномских асоцијација и моделовање еволуције.
Постоје два фундаментална начина моделовања биолошких система (нпр. живих ћелија).
- Статички
- Секвенце – Протеини, нуклеинске киселине и пептиди
- Структуре – Протеини, нуклеинске киселине, лиганди (укључујући метаболите и лекове) и пептиди
- Подаци о интеракцијама између горњих ентитета, који обухватају податке са микро низова, и мреже протеина и метаболита
- Динамички
- Системска биологија се убраја у ову категорију, укључујући реакционе флуксеве и променљиве концентрације метаболита
- Приступи базирани на моделовању вишеструких агенаса којима се описују ћелијски одговори као што је сигнализација, транскрипција и реакциона динамика
Структурна биоинформатика је широка поткатегорија биоинформатике. Она се бави анализом и предвиђањем тродимензионалне структуре биолошких макромолекула као што су протеини, РНК и ДНК. Она производи генерализације макромолекуларних 3Д структура као што су поређења свеукупних савијања и локалних мотива, принципи молекуларног савијања, еволуције и интеракције везивања, и односи структуре и функције. Она ради са експериментално уређеним структурама и формира рачунарске моделе. Термин структурна има еквивалентно значење као и у структурној биологији. Структурна биоинформатика се сматра делом рачунарске структурне биологије.
ДНК нанотехнологија[уреди | уреди извор]

ДНК нанотехнологија користи јединствена својства молекулског препознавања ДНК и других нуклеинских киселина да креира самостално формирајуће разгранате ДНК комплексе који имају низ корисних особина.[471] На овај начин се ДНК употребљава као структурни материјал уместо као носилац биолошких информација. То доводи до креирања дводимензионих периодичних решетки (у облику плочица и користећи „ДНК оригами” метод), као и тродимензионе структуре у облику полиедра.[472]
Наномеханички уређаји и алгоритамско самостално формирање су исто тако били демонстрирани.[473] Те ДНК структуре су биле коришћене као темплет за организовање других молекула као што су наночестице злата и стрептавидински протеини.[474]
Концептуалну основу ДНК нанотехнологије је положио Надријан Симан током раних 1980-их, а поље је почело да привлачи широко интересовање почетком и средином 2000-их. Ова област почиње да се користи као извор оруђа за решавање проблема базне науке у структурној биологији и биофизици, укључујући примену у кристалографији и спектроскопији за демонстрацију протеинске структуре. Потенцијалне практичне примене у електроници молекуларних сразмера и наномедицини се такође истражују.
ДНК нанотехнологија се понекад дели у два преклапајућа потпоља: структурну ДНК нанотехнологија и динамичку ДНК нанотехнологија. Структурна ДНК нанотехнологија има фокус на синтези и карактеризацији нуклеинско киселинских комплекса и материјала који се склапају у статичко, равнотежно крајње стање. С друге стране, динамичка ДНК нанотехнологија се усредсређује на комплексе са корисним неравнотежним понашањем, као што је способност да се промени конфигурације након хемијских и физичких стимулуса. Неки комплекси комбинују својства оба, структурног и динамичког потпоља, нпр. нуклеинско киселински наномеханички уређаји.[475][476]

Комплекси конструисани применом структурне ДНК нанотехнологије користе разгранате структуре нуклеинске киселине која садржи тачке спајања, за разлику од већине биолошке ДНК, која се јавља као неразгранати двоструки хеликс. Једна од најједноставнијих разгранатих структура, и прво направљена, је четворострука раскрсница која се састоји од четири индивидуална ДНК ланца, чије порције су комплементарне и имају специфичан образац. За разлику од природног Холидејовог споја, свака рука у вештачком непокретном споју има различиту базну секвенцу, те је раскрсница фиксна у одређеној позицији. Вишеструки спојеви се могу комбиновати у истом молекулу. У најширој употреби су мотиви „двоструких скретница” (DX). Тај мотив се састоји од два паралелна двострука хеликсна домена, где индивидуални ланци прелазе из једног домена у други у двема тачкама рачвања. Свака тачка рачвања је са тополошког гледишта раскрсница са четири руке, која је ограничена у једној оријентацији, што је у контрасту са флексибилним раскрсницама. Та крутост чини DX мотив подесним структурним градивним блоком за веће ДНК комплексе.[478][479]
Динамичка ДНК нанотехнологија често користи механизам полазном тачком посредованог замењивања ланца да би се омогућила реконфигурација комплекса нуклеинске киселине. У овој реакцији, ланац се везује за регион једноланчане почетне тачке дволанчаног комплекса, и затим замењује један од ланаца везаних за оригинални комплекс путем процеса миграције гране. Свеукупни ефекат је замена једног ланца комплекса, што омогућава да присуство првог ланца делује као прекидач за контролу реконфигурације комплекса.[475] Могуће је направити структуре и уређаје користећи функционалне нуклеинске киселине као што су дезоксирибозими и рибозими, који могу да изводе хемијске реакције, и аптамере, који могу да вежу специфичне протеине или мале молекуле.[480]
Алтернативни генетички полимери[уреди | уреди извор]
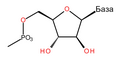 АНК (арабиноза) |
 ФАНК (2´-флуороарабиноза) |
 ТНК (треоза) |
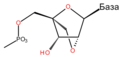 ЛНК („закључана” рибоза) |
 ЦеНК (циклохексен) |
 ХНК (анхидрохекситол) |
Складиштење и манипулација генетичке информације се у природи ослањају на само два полимера, ДНК и РНК. Није у потпуности разјашњено да ли је ова њихова улога одражава еволуциону историју или фундаментална функционална ограничења молекула. Применом пројектованих полимераза се може показати да се генетичка информација може чувати и користити применом низа алтернативних генетичких полимера базираних на једноставној архитектури нуклеинских киселина које се не јављају у природи, ксенонуклеинских киселина (КНК). Подесним избором КНК аптамера, који се везују за своје циљеве са високим афинитетом и специфичношћу, показано је да поред наследности, специфичне ксенонуклеинске киселине имају способност Дарвинске еволуције и формирања дефинисаних структура. Недавно је објављена студија у којој су описана својства шест алтернативних генетичких полимера који се могу користити за чување и пропагирање информације. Из тога произилази да наследност и еволуција, два обележја живота, нису ограничена на ДНК и РНК него да су вероватно појавни облици полимера који имају способност складиштења информација.[481]
Развој ксенонуклеинских киселина означава почетак ере синтетичке генетике, са импликацијама за астробиологију, биотехнологију и разумевање живота. Досадашњи кораци изван биолошке генетике су скромни. Они обухватају КНК молекуле, који су аналогни са биолошким нуклеинским киселинама. Њихов шећер или шећеру слична компонента није рибоза. Она је замењена различитим шећерима са пет угљеника (арабинозом у АНК, 2´-флуороарабинозом у ФАНК), шећером са четири угљеника (треозом у ТНК), и „закључаним” рибозним аналогом у ЛНК, или структурама са шесточланим прстеном (циклохексеном у ЦеНК, анхидрохекситолом у ХНК). Изучавање ксенонуклеинских киселина је инспирисано питањем о првом генетичком полимеру на Земљи. Можда је то била РНК, али је исто тако могуће да је то била нека од једноставнијих структура које би биле доступније путем пребиотичке синтезе.[482] ТНК и гликолна нуклеинска киселина (ГНК) су примарни кандидати.[483][484] Други разлог за изучавање ксенонуклеинских киселина је њихова примена у облику antisense агенаса који се везују и инхибирају функције биолошких рибонуклеинских киселина. Свих шест Пинхеирових ксенонуклеинских киселина се везују за комплементарне РНК и ДНК, и отпорне су на деградацију биолошким нуклеазама.[481] Конструкција генетичког система базираног на алтернативним хемијским платформама могла би коначно да доведе до синтезе нових форми живота.
Садашњи степен развоја омогућава репликацију КНК реверзним транскрибовањем до ДНК, њеним умножавањем путем ПЦР, и затим транскрибовањем ДНК назад у КНК. У сваком степену се користе полимеразе. Конверзија у ДНК је неопходна за амплификацију.[485] Кључни корак у XНК истраживањима је био развој варијанти полимераза који имају способност копирања информације између XНК и ДНК. XНК полимери са више од 70 подјединица и скоро свака секвенца се може копирати, са просечном тачношћу од 95% (за ЛНК) до 99,6% (за ЦеНК). Тај профил је довољан за спровођење усмерене еволуције функционалних КНК молекула. Применом тог процеса на ХНК полимере је показано је да они могу да еволуирају у лабораторији тако да се добијају функционални молекули (аптамери) који се чврсто и специфично везују за жељени РНК или протеински молекул. Развој полимераза које могу да копирају КНК на њен сопствени комплемент, или да копирају информације између две различите КНК, је у току. До сада, ФАНК и ЦеНК су биле копиране на њихове комплементе, и ЦеНК је била копирана на ХНК, али су ти процеси знатно мање ефикасни него копирање између КНК и ДНК.
Још један важан разлог за настављање развоја функционалних КНК је добијање једињења за потенцијалну примену у науци о материјалима, молекуларној дијагностици, и лековима. Аптамери нуклеинских киселина су већ нашли широку примену у тим областима. Међутим, РНК и ДНК су подложни дејству биолошких нуклеаза, те се они морају модификовати да би се одржали у природним условима. КНК молекули су вештачки те нису подложни дејству нуклеаза. Корист од њихових необичних хемијских особина се мора одмеравати са њиховом већом ценом, непосредно, и у контексту рада у неистраженом домену КНК биохемије.
Популациона генетика[уреди | уреди извор]
ДНК током времена сакупи мутације које се преносе са колена на колено, те стога ДНК садржи историјске информације. Поређењем ДНК секвенци се може пратити еволуциона историја организама, њихова филогенија.[486] Ово подручје филогенетике је богат извор информација о еволуционој биологији. Популационо генетички увид у историју појединих популација се може добити путем поређења ДНК секвенци унутар врста. Тај приступ налази примену у широком спектру студија од еколошке генетике до антропологије. Популациона генетика је студија дистрибуције фреквенције алела и промена под утицајем четири главна еволуциона процеса: природна селекција, генетички дрифт, мутација и проток гена. Она исто тако узима у обзир факторе рекомбинације, популационе потподеле и популационе структуре. Популациона генетика покушава да објасни феномене попут адаптације и специјације.
Генетичка генеалогија[уреди | уреди извор]
Генетичка генеалогија је примена генетике у традиционалној генеалогији. Генетичка генеалогија обухвата употребу генеалошког ДНК тестирања ради одређивања нивоа генетичких односа између појединаца. Два најчешће коришћена типа генетичких генеалошких тестова су Y-ДНК (очинска линија)[487] и мтДНК[488] (материнска линија).[487]
Ови тестови се састоје од поређења појединих ДНК секвенци пара особа да би се проценила вероватноћа да они имају заједничког претходника у генеалошком временском оквиру. Применом Бајесовог модела који је објавио Брус Волш, за процену броја генерација које раздвајају две особе од њиховог најскоријег заједничког претка.[489]
Y-ДНК тестирање обухвата кратка тандемна понављања (STR), а понекад и тестирање једнонуклеарних полиморфизама (SNP) Y-хромозома. Овај хромозом је присутан само код мушкараца, те даје информације само о очинској линији. Ови тестови могу да пруже увид у недавно (STR) и древно (SNP) генетичко порекло. Y-хромозомни STR тест садржи хаплотип који је сличан код свих мушких потомака заједничког мушког претка. SNP тестови се користе за сврставање људи у очинске хаплогрупе, које дефинишу знатно већу генетичку популацију.
мтДНК тестирање обухвата секвенцирање HVR-1 региона, HVR-2 региона или оба. мтДНК тест може такође да садржи додатне СНП-ове који су потребни за сврставање људи у материнске хаплогрупе, или чак комплетну мтДНК.
Резултати Y-ДНК или мтДНК тестова се могу поредити са резултатима других особа употребом приватних или јавних ДНК база података.
Историја ДНК истраживања[уреди | уреди извор]
ДНК је први изоловао швајцарски лекар Фридрих Мишер, који је 1869. открио микроскопску супстанцу у гноју одбачених завоја. Она се налазила у нуклеусима ћелија, те ју је он назвао „нуклеин”.[490] Албрехт Косел је 1878. изоловао непротеинску компоненту „нуклеина”, нуклеинску киселину. Он је касније изоловао и пет примарних нуклеобаза.[491] Фибус Лавин је 1919. идентификовао базу, шећер и фосфат нуклеотидне јединице.[492] Лавин је дошао до закључка да се ДНК састоји од низа нуклеотидних јединица повезаних фосфатним групама. Међутим, он је сматрао да је ланац кратак и да се базе понављају у фиксном поретку. Вилијам Астбури је 1937. произвео прве Рендгенске дифракционе обрасце који су показали да ДНК има уређену структуру.[493][494]
Николај Колтсов је 1927. предложио да се наследне особине могу преносити путем „гигантског молекула за наслеђивање” који би се састојао од „два комплементарна ланца који бе се копирали користећи један ланац као темплет”.[495] Фредерик Грифит је 1928. открио да се својство „глатког” облика Pneumococcus бактерије може пренети на бактерије „неравног” облика исте врсте путем мешања мртвих глатких бактерија са живим грубим бактеријама.[496] Тај систем је пружио прву јасну индикацију да ДНК носи генетичке информације. Освалд Ејвери заједно са сарадницима Колином Маклаудом и Маклином Макартијем су идентификовали ДНК као носиоца трансформирајућег принципа 1943.[497] Улога ДНК молекула у наслеђивању је потврђена 1952, кад су Алфред Херши и Марта Чејс показали да је ДНК генетички материјал Т2 фага.[498]
Током 1950-их три групе су радиле на одређивању структуре ДНК. Са радом је прво започела група са Кингс колеџа у Лондону коју је предводио Морис Вилкинс и којој се касније придружила Розалинд Франклин. Друга група се састојала оф Франсиса Крика и Џејмса Вотсона у Кембриџу. Трећа група је радила на Калтеху и била је предвођена Линусом Паулингом. Крик и Вотсон су израдили физичке моделе користећи металне полуге и кугле, у којима се инкорпорисали познате хемијске структуре нуклеотида, као и познате позиције веза које спајају нуклеотиде дуж полимера. На Кингс колеџу Морис Вилкинс и Росалинд Франклин су изучавали рендгенске дифракционе обрасце ДНК нити. Од три групе, једино је лондонска група била у могућности да произведе дифракционе обрасце задовољавајућег квалитета и да тако генерише довољну количину квантитативних података о структури.
Џејмс Д. Вотсон и Франсис Крик су 1953. предложили први коректан модел двоструког хеликса ДНК структуре.[12] Њихов модел је био базиран на само једном рендгенском дифракционом снимку (обележеном као „Фотографија 51”)[499] који су снимили Росалинд Франклин и Рејмонд Гослинг маја 1952, као и информацији да су ДНК базе спарене, што је проистекло из приватне комуникације са Ервином Чаргафом током претходних година. Чаргафова правила су имала веома важну улогу у одређивању конфигурације двоструког хеликса за Б-ДНК као и за А-ДНК.
Експериментални докази који подржавају модел Вотсона и Крика су објављени у серији од пет чланака у истом издању часописа Природа.[500] Међу њима Франклинов и Гослингов чланак су били прва публикација њихових Рендгенских дифракционих података и оригинални метод анализе који је делом подржавао модел Вотсон и Крика.[84][501] То издање је такође садржало чланак о ДНК структури Мориса Вилкинса и двоје његових сарадника, чија анализа ин виво Б-ДНК Рендгенских образаца је такође подржавала присуство ин виво двоструког хеликса у ДНК конфигурације, као што су предложили Крик и Вотсон.[85] Франклин је преминула 1958. Вотсон, Крик и Вилкинс су добили Нобелову награду за физиологију или медицину 1962.[502][503]
У једној утицајној презентацији из 1957, Крик је изложио централну догму молекуларне биологије, која је предсказала однос између ДНК, РНК и протеина, и артикулисала хипотезу адаптера.[504] Финална потврда репликационог механизма који је произашао из структуре двоструког хеликса је уследила 1958. у облику Меселсон-Стахловог експеримента.[505] Даљим радом Крика и његових сарадника је показано да је генетички код базиран на непреклапајућим триплетима база, који се називају кодони. Генетички код су дешифровали Хар Гобинд Корана, Роберт Холи и Маршал Варен Ниренберг.[506] Ови налази означавају рођење поља молекуларне биологије.

Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ а б в Lewin 1997
- ^ Russell 2001
- ^ а б Brown T.A. (2006). Genomes (3rd изд.). Garland Science. ISBN 978-0-8153-4138-3.
- ^ Donald Voet; Judith G. Voet (2005). „DNA Replication, Repair, and Recombination”. Biochemistry (3 изд.). Wiley. ISBN 9780471193500.
- ^ Edwards K.J.; Brown D.G.; Spink, N.; Skelly J.V.; Neidle, S. (1992). „Molecular structure of the B-DNA dodecamer d(CGCAAATTTGCG)2. An examination of propeller twist and minor-groove water structure at 2.2 A resolution”. J.Mol.Biol. 226: 1161—1173. PMID 1518049.
- ^ Wolfram 1984.
- ^ а б в г д Bruce Alberts; Alexander Johnson; Julian Lewis; Martin Raff; Keith Roberts; Peter Walter (2002). Molecular Biology of the Cell. New York: Garlard Science. ISBN 0815332181.
- ^ Butler John M. (2001). Forensic DNA Typing. Elsevier. стр. 14—15. ISBN 978-0-12-147951-0. OCLC 223032110 45406517.
- ^ Gregory S, Barlow KF, McLay KE, Kaul R, Swarbreck D, Dunham A, Scott CE, Howe KL, Woodfine K (2006). „The DNA sequence and biological annotation of human chromosome 1”. Nature. 441 (7091): 315—21. Bibcode:2006Natur.441..315G. PMID 16710414. doi:10.1038/nature04727.
- ^ а б Ghosh A, Bansal M (2003). „A glossary of DNA structures from A to Z”. Acta Crystallogr D. 59 (4): 620—6. PMID 12657780. doi:10.1107/S0907444903003251.
- ^ Abbreviations and Symbols for Nucleic Acids, Polynucleotides and their Constituents IUPAC-IUB Commission on Biochemical Nomenclature (CBN) Accessed 03 Jan 2006
- ^ а б в Watson J.D. & Crick F.H.C. (1953). „A Structure for Deoxyribose Nucleic Acid” (PDF). Nature. 171 (4356): 737—738. Bibcode:1953Natur.171..737W. PMID 13054692. doi:10.1038/171737a0.
- ^ а б в Berg, Tymoczko & Stryer 2002
- ^ Mandelkern M, Elias J, Eden D, Crothers D (1981). „The dimensions of DNA in solution”. J Mol Biol. 152 (1): 153—61. PMID 7338906. doi:10.1016/0022-2836(81)90099-1.
- ^ Yakovchuk P, Protozanova E, Frank-Kamenetskii MD (2006). „Base-stacking and base-pairing contributions into thermal stability of the DNA double helix”. Nucleic Acids Res. 34 (2): 564—74. PMC 1360284
 . PMID 16449200. doi:10.1093/nar/gkj454.
. PMID 16449200. doi:10.1093/nar/gkj454.
- ^ Takahashi I, Marmur J (1963). „Replacement of thymidylic acid by deoxyuridylic acid in the deoxyribonucleic acid of a transducing phage for Bacillus subtilis”. Nature. 197. PMID 13980287.|pages=794—5}}
- ^ Verma S, Eckstein F (1998). „Modified oligonucleotides: synthesis and strategy for users”. Annu. Rev. Biochem. 67: 99—134. PMID 9759484. doi:10.1146/annurev.biochem.67.1.99.
- ^ Mai-kun Teng; Usman, Nassim; Frederick, Christin A. & Andrew H.-J. Wang (1988). „The molecular structure of the complex of Hoechst 33258 and the DNA dodecamer d(CGCGAATTCGCG)”. Nucl. Acids Res. 16 (6): 2671—2690. doi:10.1093/nar/16.6.2671.
- ^ Pjura, Philip E.; Grzeskowiak, Kazimierz & Dickerson, Richard E. (1987). „Binding of Hoechst33258 to the minor groove of B-DNA”. Journal of Molecular Biology. 197 (2): 257—271. doi:10.1016/0022-2836(87)90123-9.
- ^ Loontiens, Frank G.; Regenfuss, Peter; Zechel, Annelies; Dumortier, Lieve & Clegg, Robert M. (1990). „Binding characteristics of Hoechst 33258 with calf thymus DNA, poly[d(A-T)] and d(CCGGAATTCCGG): multiple stoichiometries and determination of tight binding with a wide spectrum of site affinities”. Biochemistry. 29 (38): 9029—9039. doi:10.1021/bi00490a021.
- ^ Wing R, Drew H, Takano T, Broka C, Tanaka S, Itakura K, Dickerson R (1980). „Crystal structure analysis of a complete turn of B-DNA”. Nature. 287 (5784): 755—8. Bibcode:1980Natur.287..755W. PMID 7432492. doi:10.1038/287755a0.
- ^ а б Pabo C & Sauer R (1984). „Protein-DNA recognition”. Annu Rev Biochem. 53: 293—321. PMID 6236744. doi:10.1146/annurev.bi.53.070184.001453.
- ^ Sibley, C. G. & Ahlquist, J. E. (1984). „The Phylogeny of the Hominoid Primates, as Indicated by DNA-DNA Hybridization”. Journal of Molecular Evolution. 20 (1): 2—15. PMID 6429338. doi:10.1007/BF02101980.
- ^ Myers, R. M.; Maniatis, T. & Lerman, L. S. (1987). „Detection and Localization of Single Base Changes by Denaturing Gradient Gel Electrophoresis”. Methods in Enzymology. 155: 501—527. ISBN 978-0-12-182056-5. PMID 3431470. doi:10.1016/0076-6879(87)55033-9.
- ^ Po, T.; Steger, G.; Rosenbaum, V.; Kaper, J. & Riesner, D. (1987). „Double-stranded cucumovirus associated RNA 5: experimental analysis of necrogenic and non-necrogenic variants by temperature-gradient gel electrophoresis”. Nucleic Acids Research. 15 (13): 5069—5083. PMC 305948
 . PMID 3601667. doi:10.1093/nar/15.13.5069.
. PMID 3601667. doi:10.1093/nar/15.13.5069.
- ^ Clausen-Schaumann H; Rief, M; Tolksdorf, C & Gaub, H (2000). „Mechanical stability of single DNA molecules”. Biophys J. 78 (4): 1997—2007. PMID 10733978.
- ^ Mandel, M. & Marmur, J. (1968). „Use of Ultravialet Absorbance-Temperature Profile for Determining the Guanine plus Cytosine Content of DNA”. Methods in Enzymology. 12 (2): 198—206. ISBN 978-0-12-181856-2. doi:10.1016/0076-6879(67)12133-2.
- ^ Isaksson J, Acharya S, Barman J, Cheruku P & Chattopadhyaya J (2004). „Single-stranded adenine-rich DNA and RNA retain structural characteristics of their respective double-stranded conformations and show directional differences in stacking pattern”. Biochemistry. 43 (51): 15996—6010. PMID 15609994. doi:10.1021/bi048221v.
- ^ Chalikian T, Völker J, Plum G & Breslauer K (1999). „A more unified picture for the thermodynamics of nucleic acid duplex melting: A characterization by calorimetric and volumetric techniques”. Proc Natl Acad Sci USA. 96 (14): 7853—8. Bibcode:1999PNAS...96.7853C. PMC 22151
 . PMID 10393911. doi:10.1073/pnas.96.14.7853.
. PMID 10393911. doi:10.1073/pnas.96.14.7853.
- ^ deHaseth P & Helmann J (1995). „Open complex formation by Escherichia coli RNA polymerase: the mechanism of polymerase-induced strand separation of double helical DNA”. Mol Microbiol. 16 (5): 817—24. PMID 7476180. doi:10.1111/j.1365-2958.1995.tb02309.x.
- ^ David, Pribnow (1975). „Nucleotide sequence of an RNA polymerase binding site at an early T7 promoter”. Proceedings of the National Academy of Sciences. 72 (3): 784—788. ISSN 1091-6490. PMC 432404
 . PMID 1093168. doi:10.1073/pnas.72.3.784. Архивирано из оригинала 02. 11. 2014. г. Приступљено 22. 04. 2012.
. PMID 1093168. doi:10.1073/pnas.72.3.784. Архивирано из оригинала 02. 11. 2014. г. Приступљено 22. 04. 2012.
- ^ Heinz, Schaller; Christopher, Gray & Karin, Herrman (1975). „Nucleotide sequence of an RNA polymerase binding site from the DNA of Bacteriophage fd”. Proceedings of the National Academy of Sciences. 72 (2): 737—741. ISSN 1091-6490. PMC 432391
 . PMID 1054851. doi:10.1073/pnas.72.2.737. Архивирано из оригинала 07. 02. 2019. г. Приступљено 22. 04. 2012.
. PMID 1054851. doi:10.1073/pnas.72.2.737. Архивирано из оригинала 07. 02. 2019. г. Приступљено 22. 04. 2012.
- ^ Designation of the two strands of DNA Архивирано на сајту Wayback Machine (24. април 2008) JCBN/NC-IUB Newsletter 1989, Accessed 07 May 2008
- ^ Anne-Lise Haenni (2003). „Expression strategies of ambisense viruses”. Virus Research. 93 (2): 141—150.
- ^ Kakutani T, Hayano Y, Hayashi T & Minobe Y (1991). „Ambisense segment 3 of rice stripe virus: the first instance of a virus containing two ambisense segments”. J Gen Virol. 72: 465—8.
- ^ Zhu Y, Hayakawa T, Toriyama S & Takahashi M (1991). „Complete nucleotide sequence of RNA 3 of rice stripe virus: an ambisense coding strategy”. J Gen Virol. 72: 763—7.
- ^ Hüttenhofer A, Schattner P & Polacek N (2005). „Non-coding RNAs: hope or hype?”. Trends Genet. 21 (5): 289—97. PMID 15851066. doi:10.1016/j.tig.2005.03.007.
- ^ Munroe, S. (2004). „Diversity of antisense regulation in eukaryotes: multiple mechanisms, emerging patterns”. J Cell Biochem. 93 (4): 664—71. PMID 15389973. doi:10.1002/jcb.20252.
- ^ а б Makalowska I, Lin C & Makalowski W (2005). „Overlapping genes in vertebrate genomes”. Comput Biol Chem. 29 (1): 1—12. PMID 15680581. doi:10.1016/j.compbiolchem.2004.12.006.
- ^ а б Johnson Z & Chisholm S (2004). „Properties of overlapping genes are conserved across microbial genomes”. Genome Res. 14 (11): 2268—72. PMC 525685
 . PMID 15520290. doi:10.1101/gr.2433104.
. PMID 15520290. doi:10.1101/gr.2433104.
- ^ Lamb R & Horvath C (1991). „Diversity of coding strategies in influenza viruses”. Trends Genet. 7 (8): 261—6. PMID 1771674. doi:10.1016/0168-9525(91)90326-L.
- ^ Davey, Curt A.; Sargent, David F.; Luger, Karolin; Maeder, Armin W. & Richmond, Timothy J. (2002). „Solvent Mediated Interactions in the Structure of the NucleosomeCoreParticle at 1.9 Å Resolution”. Journal of Molecular Biology. 319 (5): 1097—1113. doi:10.1016/S0022-2836(02)00386-8.
- ^ Youngson 2006
- ^ Redon C, Pilch D, Rogakou E, Sedelnikova O, Newrock K & Bonner W (2002). „Histone H2A variants H2AX and H2AZ”. Curr. Opin. Genet. Dev. 12 (2): 162—9. PMID 11893489. doi:10.1016/S0959-437X(02)00282-4.
- ^ Bhasin M, Reinherz EL & Reche PA (2006). „Recognition and classification of histones using support vector machine”. J. Comput. Biol. 13 (1): 102—12. PMID 16472024. doi:10.1089/cmb.2006.13.102.
- ^ Hartl Daniel L.; David, Freifelder & Snyder Leon A. (1988). Basic Genetics. Boston: Jones and Bartlett Publishers. ISBN 978-0-86720-090-4.
- ^ а б в Luger K, Mäder AW, Richmond RK, Sargent DF & Richmond TJ (1997). „Crystal structure of the nucleosome core particle at 2.8 A resolution”. Nature. 389 (6648). PMID 9305837. doi:10.1038/38444. PDB: 1AOI
- ^ Farkas 1996
- ^ а б Iyer, Lakshminarayan M; Leipe, Detlef D.; Koonin, Eugene V & Aravind, L (2004). „Evolutionary history and higher order classification of AAA+ ATPases”. Journal of Structural Biology. 146 (1–2): 11—31. doi:10.1016/j.jsb.2003.10.010.
- ^ Seok-Yong Lee; Armando De La Torre; Yan, Dalai; Kustu, Sydney; Nixon, B. Tracy & Wemmer, David E. (2003). „Regulation of the transcriptional activator NtrC1: structural studies of the regulatory and AAA+ ATPase domains”. Genes & Dev. 17: 2552—2563. doi:10.1101/gad.1125603.
- ^ Lo, John H. & Baker, Tania A., Robert T. Sauer (2001). „Characterization of the N-terminal repeat domain of Escherichia coli ClpA—A class I Clp/HSP100 ATPase”. 10 (3): 551—559. doi:10.1110/ps.41401.
- ^ Yong-In Kim; Levchenko, Igor; Fraczkowska, Karolina; Woodruff, Rachel V.; Sauer, Robert T. & Baker, Tania A. (2001). „Molecular determinants of complex formation between Clp/Hsp100 ATPases and the ClpP peptidase”. Nature Structural Biology. 8: 230—233. doi:10.1038/84967.
- ^ Alva V, Ammelburg M & Lupas AN (2007). „On the origin of the histone fold”. BMC Struct Biol. 7: 17. PMC 1847821
 . PMID 17391511. doi:10.1186/1472-6807-7-17.
. PMID 17391511. doi:10.1186/1472-6807-7-17.
- ^ Ward R, Bowman A, El-Mkami H, Owen-Hughes T & Norman DG (2009). „Long distance PELDOR measurements on the histone core particle”. J. Am. Chem. Soc. 131 (4): 1348—9. PMID 19138067. doi:10.1021/ja807918f.
- ^ Benham C & Mielke S (2005). „DNA mechanics”. Annu Rev Biomed Eng. 7: 21—53. PMID 16004565. doi:10.1146/annurev.bioeng.6.062403.132016.
- ^ а б в Champoux, J. (2001). „DNA topoisomerases: structure, function, and mechanism”. Annu Rev Biochem. 70: 369—413. PMID 11395412. doi:10.1146/annurev.biochem.70.1.369.
- ^ а б в Wang, J. (2002). „Cellular roles of DNA topoisomerases: a molecular perspective”. Nat Rev Mol Cell Biol. 3 (6): 430—40. PMID 12042765. doi:10.1038/nrm831.
- ^ а б Albert AC, Spirito F, Figueroa-Bossi N, Bossi L & Rahmouni AR (1996). „Hyper-negative template DNA supercoiling during transcription of the tetracycline-resistance gene in topA mutants is largely constrained in vivo”. Nucl Acids Res. 24 (15): 3093—3099. PMC 146055
 . PMID 8760899. doi:10.1093/nar/24.15.3093.
. PMID 8760899. doi:10.1093/nar/24.15.3093.
- ^ Marko, J. F. & Siggia, E. D. (1995). „Statistical mechanics of supercoiled DNA”. Phys. Rev. E. 52 (3): 2912—2938. doi:10.1103/PhysRevE.52.2912.
- ^ Marko, John F. (1997). „Supercoiled and braided DNA under tension”. Phys. Rev. E. 55: 1758—1772. doi:10.1103/PhysRevE.55.1758.
- ^ Igel, A. Haller & Jr, Manuel Ares (1988). „Internal sequences that distinguish yeast from metazoan U 2 snRNA are unnecessary for pre-mRNA splicing” (PDF). Nature. 344 (4): 450—3.
- ^ Marko, John F. (2007). „Torque and dynamics of linking number relaxation in stretched supercoiled DNA”. Phys. Rev. E. 76 (2). doi:10.1103/PhysRevE.76.021926.
- ^ Boles, T. Christian (1990). „Structure of plectonemically supercoiled DNA”. Journal of Molecular Biology. 213 (4): 931—951.
- ^ Holmes, Victor F. & Cozzarelli, Nicholas R. (2000). „Closing the ring: Links between SMC proteins and chromosome partitioning, condensation, and supercoiling”. PNAS. 97 (4): 1322—1324. doi:10.1073/pnas.040576797. Архивирано из оригинала 24. 09. 2015. г. Приступљено 15. 04. 2012.
- ^ Cozzarelli, N. R.; Krasnow, M. A.; Gerrard, S. P. & White, J. H. (1984). „A Topological Treatment of Recombination and Topoisomerases”. Cold Spring Harb Symp Quant Biol. 49: 383—400. doi:10.1101/SQB.1984.049.01.045.
- ^ Benjamin, H W & Cozzarelli, N R. (1990). „Geometric arrangements of Tn3 resolvase sites”. The Journal of Biological Chemistry. 265: 6441—6447.
- ^ Hirano, T. (2005). „Condensins: organizing and segregating the genome”. Curr Biol. 15: R265—R275. PMID 15823530. doi:10.1016/j.cub.2005.03.037.
- ^ Wood AJ, Severson AF, Meyer BJ (2010). „Condensin and cohesin complexity: the expanding repertoire of functions”. Nat Rev Genet. 11 (6): 391—404. PMID 20442714. doi:10.1038/nrg2794.
- ^ Michaelis C, Ciosk R & Nasmyth K (1997). „Cohesins: chromosomal proteins that prevent premature separation of sister chromatids”. Cell. 91 (1): 35—45. PMID 9335333. doi:10.1016/S0092-8674(01)80007-6.
- ^ Guacci V, Koshland D & Strunnikov A (1997). „A Direct Link between Sister Chromatid Cohesion and Chromosome Condensation Revealed through the Analysis of MCD1 in S. cerevisiae”. Cell. 91 (1): 47—57. PMC 2670185
 . PMID 9335334. doi:10.1016/S0092-8674(01)80008-8.
. PMID 9335334. doi:10.1016/S0092-8674(01)80008-8.
- ^ Tóth A, Ciosk R, Uhlmann F, Galova M, Schleiffer A & Nasmyth K (1999). „Yeast Cohesin complex requires a conserved protein, Eco1p(Ctf7), to establish cohesion between sister chromatids during DNA replication”. Genes Dev. 13 (3): 320—33. PMC 316435
 . PMID 9990856. doi:10.1101/gad.13.3.320.
. PMID 9990856. doi:10.1101/gad.13.3.320.
- ^ Uhlmann F, Lottspeich F & Nasmyth K (1999). „Sister-chromatid separation at anaphase onset is promoted by cleavage of the cohesin subunit Scc1”. Nature. 400 (6739): 37—42. PMID 10403247. doi:10.1038/21831.
- ^ Silver 1995, стр. 83–92.
- ^ а б в Lodish et al. 2008
- ^ Basham B, Schroth GP & Ho PS (1995). „An A-DNA triplet code: thermodynamic rules for predicting A- and B-DNA”. Proc Natl Acad Sci USA. 92 (14): 6464—6468. PMC 41538
 . PMID 7604014. doi:10.1073/pnas.92.14.6464.
. PMID 7604014. doi:10.1073/pnas.92.14.6464.
- ^ Dickerson, R. E. (1989). „Definitions and nomenclature of nucleic acid structure components”. Nucleic Acids Res. 17 (5): 1797—1803. PMC 317523
 . PMID 2928107. doi:10.1093/nar/17.5.1797.
. PMID 2928107. doi:10.1093/nar/17.5.1797.
- ^ Lu XJ & Olson WK (1999). „Resolving the discrepancies among nucleic acid conformational analyses”. J Mol Biol. 285 (4): 1563—1575. PMID 9917397. doi:10.1006/jmbi.1998.2390.
- ^ Olson WK, Bansal M, Burley SK, Dickerson RE, Gerstein M, Harvey SC, Heinemann U, Lu XJ, Neidle S, Shakked Z, Sklenar H, Suzuki M, Tung CS, Westhof E, Wolberger C & Berman HM (2001). „A standard reference frame for the description of nucleic acid base-pair geometry”. J Mol Biol. 313 (1): 229—237. PMID 11601858. doi:10.1006/jmbi.2001.4987.
- ^ Wang AH, Quigley GJ, Kolpak FJ, Crawford JL, van Boom JH, Van der Marel G, Rich A (1979). „Molecular structure of a left-handed double helical DNA fragment at atomic resolution”. Nature (London). 282 (5740): 680—686. Bibcode:1979Natur.282..680W. PMID 514347. doi:10.1038/282680a0.
- ^ Ha SC, Lowenhaupt K, Rich A, Kim YG & Kim KK (2005). „Crystal structure of a junction between B-DNA and Z-DNA reveals two extruded bases”. Nature. 437 (7062): 1183—1186. Bibcode:2005Natur.437.1183H. PMID 16237447. doi:10.1038/nature04088.
- ^ Basu H, Feuerstein B, Zarling D, Shafer R & Marton L (1988). „Recognition of Z-RNA and Z-DNA determinants by polyamines in solution: experimental and theoretical studies”. J Biomol Struct Dyn. 6 (2): 299—309. PMID 2482766.
- ^ Franklin RE & Gosling RG (6. 3. 1953). „The Structure of Sodium Thymonucleate Fibres I. The Influence of Water Content”. Acta Crystallogr. 6 (8–9): 673—7. doi:10.1107/S0365110X53001939.
- ^ Franklin RE & Gosling RG (1953). „The structure of sodium thymonucleate fibres. II. The cylindrically symmetrical Patterson function”. Acta Crystallogr. 6 (8–9): 678—85. doi:10.1107/S0365110X53001940.
- ^ а б Franklin, Rosalind; Gosling, Raymond (1953). „Molecular Configuration in Sodium Thymonucleate. Franklin R. and Gosling R.G” (PDF). Nature. 171 (4356): 740—1. Bibcode:1953Natur.171..740F. PMID 13054694. doi:10.1038/171740a0.
- ^ а б Wilkins M.H.F.; Stokes A.R. & Wilson, H. R. (1953). „Molecular Structure of Deoxypentose Nucleic Acids” (PDF). Nature. 171 (4356): 738—740. Bibcode:1953Natur.171..738W. PMID 13054693. doi:10.1038/171738a0.
- ^ Leslie AG, Arnott S, Chandrasekaran R & Ratliff RL (1980). „Polymorphism of DNA double helices”. J. Mol. Biol. 143 (1): 49—72. PMID 7441761. doi:10.1016/0022-2836(80)90124-2.
- ^ Baianu, I. C. (1980). „Structural Order and Partial Disorder in Biological systems”. Bull. Math. Biol. 42 (4). http://cogprints.org/3822/
- ^ Hosemann R., Bagchi R.N., Direct analysis of diffraction by matter, North-Holland Publs., Amsterdam — New York, 1962.
- ^ Baianu, I. C. (1978). „X-ray scattering by partially disordered membrane systems”. Acta Crystallogr A. 34 (5): 751—753,137—141. Bibcode:1978AcCrA..34..751B. doi:10.1107/S0567739478001540.
- ^ Sidorenkov, Igor; Komissarova, Natalia & Kashle, Mikhail (1998). „Crucial Role of the RNA:DNAHybrid in the Processivity of Transcription”. Molecular Cell. 2 (1): 55—64.
- ^ Milman, G; Langridge, R & Chamberlin, M J (1967). „The structure of a DNA-RNA hybrid”. Proc Natl Acad Sci U S A. 57 (6): 1804—1810. PMC 224550
 .
.
- ^ Casey, James & Davidson, Norman (1977). „Rates of formation and thermal stabilities of RNA:DNA and DNA:DNA duplexes at high concentrations of formamide”. Nucl. Acids Res. 4 (5): 1539—1552. doi:10.1093/nar/4.5.1539.
- ^ Wahl, M. & Sundaralingam, M (1997). „Crystal structures of A-DNA duplexes”. Biopolymers. 44 (1): 45—63. PMID 9097733. doi:10.1002/(SICI)1097-0282(1997)44:1<45::AID-BIP4>3.0.CO;2-#.
- ^ Lu XJ, Shakked Z & Olson WK (2000). „A-form conformational motifs in ligand-bound DNA structures”. J. Mol. Biol. 300 (4): 819—40. PMID 10891271. doi:10.1006/jmbi.2000.3690.
- ^ Rothenburg S, Koch-Nolte F & Haag F (2001). „DNA methylation and Z-DNA formation as mediators of quantitative differences in the expression of alleles”. Immunol Rev. 184: 286—98. PMID 12086319. doi:10.1034/j.1600-065x.2001.1840125.x.
- ^ Oh D, Kim Y & Rich A (2002). „Z-DNA-binding proteins can act as potent effectors of gene expression in vivo”. Proc. Natl. Acad. Sci. U.S.A. 99 (26): 16666—71. Bibcode:2002PNAS...9916666O. PMC 139201
 . PMID 12486233. doi:10.1073/pnas.262672699.
. PMID 12486233. doi:10.1073/pnas.262672699.
- ^ Naylor, Louise H. & Clark, Elizabeth M. (1990). „d(TG)n·d(CA)n sequences upstream of the rat prolactin gene form Z-DNA and inhibit gene transcription”. Nucl. Acids Res. 18 (6): 1595—1601. doi:10.1093/nar/18.6.1595.
- ^ Eden, Sharon & Cedar, Howard (1994). „Role of DNA methylation in the regulation of transcription”. Current Opinion in Genetics & Development. 4 (2): 255—259.
- ^ Broach, J. R.; Y.-Y. Li; Feldman, J.; Jayaram, M.; Abraham, J.; K.A. Nasmyth† & Hicks, J. B. (1983). „Localization and Sequence Analysis of Yeast Origins of DNA Replication”. Cold Spring Harb Symp Quant Biol. 47: 1165—1173. doi:10.1101/SQB.1983.047.01.132.
- ^ Wittig, B; Dorbic, T & Rich, A (1991). „Transcription is associated with Z-DNA formation in metabolically active permeabilized mammalian cell nuclei”. PNAS. 88 (6): 2259—2263. Архивирано из оригинала 24. 09. 2015. г. Приступљено 15. 04. 2012.
- ^ Wölfl, S; Martinez, C; Rich, A & Majzoub, J A (1996). „Transcription of the human corticotropin-releasing hormone gene in NPLC cells is correlated with Z-DNA formation”. PNAS. 16 (8): 3664—3668. Архивирано из оригинала 24. 09. 2015. г. Приступљено 15. 04. 2012.
- ^ Wolfe-Simon Felisa; Switzer, Blum Jodi; Kulp Thomas R.; Gordon Gwyneth W.; Hoeft Shelley E.; Pett-Ridge Jennifer; Stolz John F.; Webb Samuel M. & Weber Peter K. (2. 12. 2010). „A bacterium that can grow by using arsenic instead of phosphorus”. Science. 332 (6034): 1163—1166. PMID 21127214. doi:10.1126/science.1197258. Приступљено 9. 6. 2011.
- ^ а б Palmer, Jason (2. 12. 2010). „Arsenic-loving bacteria may help in hunt for alien life”. BBC News. Приступљено 2. 12. 2010.
- ^ а б Bortman, Henry (2. 12. 2010). „Arsenic-Eating Bacteria Opens New Possibilities for Alien Life”. Space.Com web site. Space.com. Приступљено 2. 12. 2010.
- ^ Katsnelson, Alla (2. 12. 2010). „Arsenic-eating microbe may redefine chemistry of life”. Nature News. doi:10.1038/news.2010.645.
- ^ Kritik an Arsen-Bakterien-Fund, „Forschung aktuell”
- ^ Dai, Jixun; Carver, Megan; Punchihewa, Chandanamali; Jones, Roger A. & Yang, Danzhou (2007). „Structure of the Hybrid-2 type intramolecular human telomeric G-quadruplex in K+ solution: insights into structure polymorphism of the human telomeric sequence”. Nucl. Acids Res. 35: 4927—4940. doi:10.1093/nar/gkm522.
- ^ Passarge 2006.
- ^ Olovnikov Alexei M. (1971). „Принцип маргинотомии в матричном синтезе полинуклеотидов” [Principle of marginotomy in template synthesis of polynucleotides]. Doklady Akademii Nauk SSSR. 201 (6): 1496—9. PMID 5158754.
- ^ Olovnikov, A. M. (1973). „A theory of marginotomy. The incomplete copying of template margin in enzymic synthesis of polynucleotides and biological significance of the phenomenon”. J. Theor. Biol. 41 (1): 181—90. PMID 4754905. doi:10.1016/0022-5193(73)90198-7.
- ^ а б Greider C & Blackburn E (1985). „Identification of a specific telomere terminal transferase activity in Tetrahymena extracts”. Cell. 43 (2 Pt 1): 405—13. PMID 3907856. doi:10.1016/0092-8674(85)90170-9.
- ^ „The Nobel Prize in Physiology or Medicine 2009”. The Nobel Foundation. 5. 10. 2009. Приступљено 23. 10. 2010.
- ^ а б в Nugent C & Lundblad V (1998). „The telomerase reverse transcriptase: components and regulation”. Genes Dev. 12 (8): 1073—85. PMID 9553037. doi:10.1101/gad.12.8.1073.
- ^ Acharya, PV (1971). „The isolation and partial characterization of age-correlated oligo-deoxyribo-ribonucleotides with covalently linked aspartyl-glutamyl polypeptides.”. Johns Hopkins medical journal. Supplement (1): 254—60. PMID 5055816.
- ^ Bjorksten J, Acharya PV, Ashman S & Wetlaufer DB (1971). „Gerogenic fractions in the tritiated rat.”. Journal of the American Geriatrics Society. 19 (7): 561—74. PMID 5106728.
- ^ Wright W, Tesmer V, Huffman K, Levene S & Shay J (1997). „Normal human chromosomes have long G-rich telomeric overhangs at one end”. Genes Dev. 11 (21): 2801—9. PMC 316649
 . PMID 9353250. doi:10.1101/gad.11.21.2801.
. PMID 9353250. doi:10.1101/gad.11.21.2801.
- ^ Moyzis, R K; Buckingham, J M.; Cram, L S; Dani, M; Deaven, L L; Jones, M D.; Meyne, J; Ratliff, R L & Wu, J R. (1988). „A highly conserved repetitive DNA sequence, (TTAGGG)n, present at the telomeres of human chromosomes”. PNAS. 85 (18): 6622—6626. Архивирано из оригинала 16. 01. 2012. г. Приступљено 16. 04. 2012.
- ^ Morin, Gregg B. (1989). „The human telomere terminal transferase enzyme is a ribonucleoprotein that synthesizes TTAGGG repeats”. Cell. 59 (3): 521—529.
- ^ а б Burge S, Parkinson G, Hazel P, Todd A & Neidle S (2006). „Quadruplex DNA: sequence, topology and structure”. Nucleic Acids Res. 34 (19): 5402—15. PMC 1636468
 . PMID 17012276. doi:10.1093/nar/gkl655.
. PMID 17012276. doi:10.1093/nar/gkl655.
- ^ Neidle; Balasubramanian, ур. (2006). Quadruplex Nucleic Acids. ISBN 978-0-85404-374-3. Архивирано из оригинала 30. 9. 2007. г. Приступљено 19. 4. 2012.
- ^ Parkinson G, Lee M & Neidle S (2002). „Crystal structure of parallel quadruplexes from human telomeric DNA”. Nature. 417 (6891): 876—80. PMID 12050675. doi:10.1038/nature755.
- ^ Griffith J, Comeau L, Rosenfield S, Stansel R, Bianchi A, Moss H & de Lange T (1999). „Mammalian telomeres end in a large duplex loop”. Cell. 97 (4): 503—14. PMID 10338214. doi:10.1016/S0092-8674(00)80760-6.
- ^ Simonsson, T.; Pecinka, P. & Kubista, M. (1998). „DNA tetraplex formation in the control region of c-myc”. Nucleic Acids Research. 26 (5): 1167—1172. PMC 147388
 . PMID 9469822. doi:10.1093/nar/26.5.1167.
. PMID 9469822. doi:10.1093/nar/26.5.1167.
- ^ Siddiqui-Jain, A.; Grand, C. L.; Bearss, D. J. & Hurley, L. H. (2002). „Direct evidence for a G-quadruplex in a promoter region and its targeting with a small molecule to repress c-MYC transcription”. Proceedings of the National Academy of Sciences. 99 (18): 11593—11598. PMC 129314
 . PMID 12195017. doi:10.1073/pnas.182256799.
. PMID 12195017. doi:10.1073/pnas.182256799.
- ^ Gross, D S & Garrard, W T. (1988). „Nuclease Hypersensitive Sites in Chromatin”. Annual Review of Biochemistry. 57: 159—197. doi:10.1146/annurev.bi.57.070188.001111. Архивирано из оригинала 08. 05. 2016. г. Приступљено 18. 04. 2012.
- ^ Almer, A & Hörz, W (1986). „Nuclease hypersensitive regions with adjacent positioned nucleosomes mark the gene boundaries of the PHO5/PHO3 locus in yeast”. EMBO J. 5 (10): 2681—2687.
- ^ Johnson JE, Smith JS, Kozak ML & Johnson FB (2008). „In vivo veritas: using yeast to probe the biological functions of G-quadruplexes”. Biochimie. 90 (8): 1250—1263. PMC 2585026
 . PMID 18331848. doi:10.1016/j.biochi.2008.02.013.
. PMID 18331848. doi:10.1016/j.biochi.2008.02.013.
- ^ Hou, Xu; Guo, Wei; Xia, Fan; Fu-Qiang Nie; Dong, Hua; Tian, Ye; Wen, Liping; Wang, Lin; Cao, Liuxuan; Yang Yang; Jianming Xue; Yanlin Song; Yugang Wang; Dongsheng Liu & Lei Jiang (2009). „A biomimetic potassium responsive nanochannel: G-quadruplex DNA conformational switching in a synthetic nanopore”. J. Am. Chem. Soc. 131 (22): 7800—7805. PMID 19435350. doi:10.1021/ja901574c.
- ^ Zhang1, Ren; Lin, Yan & Chun-Ting Zhang (2008). „Greglist: a database listing potential G-quadruplex regulated genes”. Nucl. Acids Res. 36 (suppl 1): D372—D376. doi:10.1093/nar/gkm787.
- ^ Rachwal, Phillip A.; Findlow, I. Stuart; Werner, Joern M.; Brown, Tom & Fox, Keith R. (2007). „Intramolecular DNA quadruplexes with different arrangements of short and long loops”. Nucl. Acids Res. 35 (12): 4214—4222. doi:10.1093/nar/gkm³16.
- ^ Randazzo, Antonio; Esposito, Veronica; Ohlenschläger, Oliver; Ramachandran, Ramadurai; Virgilio, Antonella & Mayol, Luciano (2005). „Structural studies on LNA quadruplexes”. Nucleosides, Nucleotides and Nucleic Acids. 24 (5—7): 795—800.
- ^ Skoblova, Mikhail; Shakhbazov, Konstantin; Oshchepkov, Dmitry; Ivanov, Dmitry; Guskovaa, Anna; Ivanov, Dmitry; Rubtsov, Petr; Prasolov, Vladimir; Yankovsky, Nick & Ancha Baranova (2006). „Human RFP2 gene promoter: Unique structure and unusual strength”. Biochemical and Biophysical Research Communications. 342 (3): 859—866.
- ^ Birerdinc, Aybike; Nohelty, Elizabeth; Marakhonov, Andrey; Manyam, Ganiraju; Panov, Ivan; Coon, Stephanie; Nikitin, Eugene; Skoblov, Mikhail; Chandhoke, Vikas & Ancha Baranova. „Pro-apoptotic and antiproliferative activity of human KCNRG, a putative tumor suppressor in 13q14 region”. Tumor Biology. 31 (1): 33—45. doi:10.1007/s13277-009-0005-0.
- ^ Gan, JianHua; Sheng, Jia & Huang, Zhen. „Chemical and structural biology of nucleic acids and protein-nucleic acid complexes for novel drug discovery”. Science China Chemistry. 54 (1): 3—23. doi:10.1007/s11426-010-4174-x.
- ^ Sales, Kevin M.; Winslet, Marc C. & Seifalian, Alexander M. „Stem Cells and Cancer: An Overview”. Stem Cell Reviews and Reports. 3 (4): 249—255. doi:10.1007/s12015-007-9002-0.
- ^ Apraiz, Aintzane; Boyano, Maria Dolores & Asumendi, Aintzane (2011). „Cell-Centric View of Apoptosis and Apoptotic Cell Death-Inducing Antitumoral Strategies”. Cancers. 3 (1): 1042—1080. doi:10.3390/cancers3011042.
- ^ Duensinga, Stefan & Duensing, Anette (2010). „Targeted therapies of gastrointestinal stromal tumors (GIST)—The next frontiers”. Biochemical Pharmacology. 80 (5): 575—583.
- ^ Dai, Jixun; Dexheimer, Thomas S.; Chen, Ding; Carver, Megan; Ambrus, Attila; Jones, Roger A. & Yang, Danzhou (2006). „An Intramolecular G-Quadruplex Structure with Mixed Parallel/Antiparallel G-Strands Formed in the Human BCL-2 Promoter Region in Solution”. J. Am. Chem. Soc. 128 (4): 1096—1098. doi:10.1021/ja055636a.
- ^ Dexheimer, Thomas S.; Sun, Daekyu & Hurley, Laurence H. (2006). „Deconvoluting the Structural and Drug-Recognition Complexity of the G-Quadruplex-Forming Region Upstream of the bcl-2 P1 Promoter”. J. Am. Chem. Soc. 128 (16): 5404—5415. doi:10.1021/ja0563861.
- ^ Pezzella, Francesco; Turley, Helen; Kuzu, Isinzu; Tungekar, Mohammed Fahim; Dunnill, Michael S.; Pierce, Chris B.; Harris, Adrian; Gatter, Kevin C. & Mason, David Y. (1993). „bcl-2 Protein in Non-Small-Cell Lung Carcinoma”. N Engl J Med. 329: 690—694.
- ^ Sun, Daekyu; Guo, Kexiao; Rusche, Jadrian J. & Hurley, Laurence H. „Facilitation of a structural transition in the polypurine/polypyrimidine tract within the proximal promoter region of the human VEGF gene by the presence of potassium and G-quadruplex-interactive agents”. Nucleic Acids Research. 33 (18): 6070—6080. doi:10.1093/nar/gki917.
- ^ Fernando, Himesh; Reszka, Anthony P.; Huppert, Julian; Ladame, Sylvain; Rankin, Sarah; Venkitaraman, Ashok R.; Neidle, Stephen & Balasubramanian, Shankar (2006). „A Conserved Quadruplex Motif Located in a Transcription Activation Site of the Human c-kit Oncogene”. Biochemistry. 45 (25): 7854—7860. doi:10.1021/bi0601510.
- ^ Sun, Daekyu; Wei-Jun Liu; Guo, Kexiao; Rusche, Jadrian J.; Ebbinghaus, Scot; Gokhale, Vijay & Hurley, Laurence H. „The proximal promoter region of the human vascular endothelial growth factor gene has a G-quadruplex structure that can be targeted by G-quadruplex–interactive agents”. Mol Cancer Ther April. 2008 (7): 880. doi:10.1158/1535-7163.MCT-07-2119.
- ^ Shammas, Masood A.; Shmookler, Robert J.Reis; Akiyama, Masaharu; Koley, Hemanta; Chauhan, Dharminder; Hideshima, Teru; Goya, Raj K.; Hurley, Laurence H.; Anderson, Kenneth C. & Nikhil C. Munshi (2003). „Telomerase inhibition and cell growth arrest by G-quadruplex interactive agent in multiple myeloma”. Mol Cancer Ther. 2: 825.
- ^ Smith, Steven S.; Laayoun, Ali; Lingeman, Robert G.; Baker, David J. & Riley, Jezia (1994). „Hypermethylation of Telomere-like Foldbacks at Codon 12 of the Human c-Ha-ras Gene and the Trinucleotide Repeat of the FMR-1 Gene of Fragile X”. Journal of Molecular Biology. 243 (2): 143—151.
- ^ Laud1, Purnima R.; Multani, Asha S.; Bailey, Susan M.; Wu, Ling; Ma, Jin; Kingsley, Charles; Lebe, Michel; Pathak, Sen; DePinho, Ronald A. & Sandy Chang (2005). „Elevated telomere-telomere recombination in WRN-deficient, telomere dysfunctional cells promotes escape from senescence and engagement of the ALT pathway”. Genes & Dev. 19: 2560—2570. doi:10.1101/gad.1321305.
- ^ Kumari, Sunita; Bugaut, Anthony; Huppert, Julian L & Balasubramanian, Shankar (2007). „An RNA G-quadruplex in the 5' UTR of the NRAS proto-oncogene modulates translation”. Nature Chemical Biology. 3: 218—221. doi:10.1038/nchembio864.
- ^ Gunaratnam, Mekala; Swank, Stephen; Haider, Shozeb M.; Galesa, Katja; Reszka, Anthony P.; Beltran, Monica; Cuenca, Francisco; Fletcher, Jonathan A.; Neidle, Stephen (2009). „Targeting Human Gastrointestinal Stromal Tumor Cells with a Quadruplex-Binding Small Molecule”. J. Med. Chem. 52 (12): 3774—3783. doi:10.1021/jm900424a.
- ^ Redman, James E.; J. M. Granadino-Roldán; Schouten, James A.; Ladame, Sylvain; Reszka, Anthony P.; Neidle, Stephen & Balasubramanian, Shankar (2009). „Targeting Human Gastrointestinal Stromal Tumor Cells with a Quadruplex-Binding Small Molecule”. Org. Biomol. Chem. 7: 76—84. doi:10.1039/B814682A.
- ^ Todd, A. K.; Johnston, M. & Neidle, S. (2005). „Highly prevalent putative quadruplex sequence motifs in human DNA”. Nucleic Acids Research. 33 (9): 2901—2907. PMC 1140077
 . PMID 15914666. doi:10.1093/nar/gki553.
. PMID 15914666. doi:10.1093/nar/gki553.
- ^ а б Huppert, J. L. & Balasubramanian, S. (2005). „Prevalence of quadruplexes in the human genome”. Nucleic Acids Research. 33 (9): 2908—2916. PMC 1140081
 . PMID 15914667. doi:10.1093/nar/gki609.
. PMID 15914667. doi:10.1093/nar/gki609.
- ^ Rawal, P.; Kummarasetti, V. B.; Ravindran, J.; Kumar, N.; Halder, K.; Sharma, R.; Mukerji, M.; Das, S. K.; et al. (2006). „Genome-wide prediction of G4 DNA as regulatory motifs: Role in Escherichia coli global regulation”. Genome Research. 16 (5): 644—655. PMC 1457047
 . PMID 16651665. doi:10.1101/gr.4508806.
. PMID 16651665. doi:10.1101/gr.4508806.
- ^ Cogoi, Susanna & Xodo, Luigi E. „G-quadruplex formation within the promoter of the KRAS proto-oncogene and its effect on transcription”. Nucleic Acids Research. 34 (9): 2536—2549. doi:10.1093/nar/gkl286.
- ^ Lemarteleura, Thibault; Gomeza, Dennis; Paterskia, Rajaa; Mandineb, Eliane; Maillietb, Patrick & Jean-François Riou (2004). „Stabilization of the c-mycgenepromoterquadruplex by specific ligands’ inhibitors of telomerase”. Biochemical and Biophysical Research Communications. 323 (3): 802—808.
- ^ Huppert, Julian Leon (2008). „Four-stranded nucleic acids: structure, function and targeting of G-quadruplexes”. Chem. Soc. Rev. 37: 1375—1384. doi:10.1039/B702491F.
- ^ Ambrus, Attila; Chen, Ding; Dai, Jixun; Bialis, Tiffanie; Jones, Roger A. & Yang, Danzhou. „Human telomeric sequence forms a hybrid-type intramolecular G-quadruplex structure with mixed parallel/antiparallel strands in potassium solution”. Nucleic Acids Research. 34 (9): 2723—2735. doi:10.1093/nar/gkl348.
- ^ He, Yujian; Neumann, Ronald D. & Panyutin, Igor G. „Intramolecular quadruplex conformation of human telomeric DNA assessed with 125I-radioprobing”. Nucleic Acids Research. 32 (18): 5359—5367. doi:10.1093/nar/gkh875.
- ^ Abad, José P. & Villasante, Alfredo (1999). „The 3’ non-coding region of the Drosophila melanogaster HeT-A telomeric retrotransposon contains sequences with propensity to form G-quadruplexDNA”. FEBS letters. 453 (1–2): 59—62.
- ^ Shafer, Richard H. (1997). „Stability and Structure of Model DNA Triplexes and Quadruplexes and Their Interactions with Small Ligands”. Progress in Nucleic Acid Research and Molecular Biology. 59: 55—94.
- ^ Tian-miao Ou; Yu-jing Lu; Jia-heng Tan; Zhi-shu Huang; Kwok-Yin Wong & Lian-quan Gu (2008). „G-Quadruplexes: Targets in Anticancer Drug Design”. 3 (5): 690—713. doi:10.1002/cmdc.200700300.
- ^ Wu, Yuliang; Kazuo Shin-ya & Brosh, Robert M.Jr. (2008). „FANCJ Helicase Defective in Fanconia Anemia and Breast Cancer Unwinds G-Quadruplex DNA To Defend Genomic Stability”. Mol. Cell. Biol. 28 (12): 4116—4128. doi:10.1128/MCB.02210-07. Архивирано из оригинала 06. 05. 2013. г. Приступљено 19. 04. 2012.
- ^ Han, Haiyong; Bennett, Richard J. & Hurley, Laurence H. (2000). „Inhibition of Unwinding of G-Quadruplex Structures by Sgs1 Helicase in the Presence of N,N‘-Bis[2-(1-piperidino)ethyl]-3,4,9,10-perylenetetracarboxylic Diimide, a G-Quadruplex-Interactive Ligand”. Biochemistry. 39 (31): 9311—9316. doi:10.1021/bi000482r.
- ^ Han, Haiyong; Langley, David R.; Rangan, Anupama & Hurley, Laurence H. (2001). „Selective Interactions of Cationic Porphyrins with G-Quadruplex Structures”. J. Am. Chem. Soc. 123 (37): 8902—8913. doi:10.1021/ja002179j.
- ^ а б James 2005
- ^ Straughen, Je; Johnson, J; Mclaren, D; Proytcheva, M; Ellis, N; German, J & Groden, J (1998). „A rapid method for detecting the predominant Ashkenazi Jewish mutation in the Bloom's syndrome gene”. Human mutation. 11 (2): 175—8. PMID 9482582. doi:10.1002/(SICI)1098-1004(1998)11:2<175::AID-HUMU11>3.0.CO;2-W.
- ^ Ozgenc A & Loeb LA (2005). „Current advances in unraveling the function of the Werner syndrome protein”. Mutation research. 577 (1–2): 237—51. PMID 15946710. doi:10.1016/j.mrfmmm.2005.03.020.
- ^ Giraldo, R & Rhodes, D (1994). „The yeast telomere-binding protein RAP1 binds to and promotes the formation of DNA quadruplexes in telomeric DNA”. EMBO J. 13 (10): 2411—2420. PMC 395107
 .
.
- ^ Hershman, Steve G.; Chen, Qijun; Lee, Julia Y.; Kozak, Marina L.; Yue, Peng; Li-San Wang & Johnson, F. Brad (2008). „Genomic distribution and functional analyses of potential G-quadruplex-forming sequences in Saccharomyces cerevisiae”. Nucl. Acids Res. 36 (1): 144—156. doi:10.1093/nar/gkm986.
- ^ König, Peter; Giraldo, Rafael; Chapman, Lynda & Rhodes, Daniela (1996). „The Crystal Structure of the DNA-Binding Domain of Yeast RAP1 in Complex with Telomeric DNA”. Cell. 85 (1): 125—136.
- ^ Miller J, McLachlan AD & Klug A (1985). „Repetitive zinc-binding domains in the protein transcription factor IIIA from Xenopus oocytes”. EMBO J. 4 (6): 1609—14. PMC 554390
 . PMID 4040853.
. PMID 4040853.
- ^ Isalan, Mark; Patel, Sachin D; Balasubramanian, Shankar & Choo, Yen (2001). „Selection of Zinc Fingers that Bind Single-Stranded Telomeric DNA in the G-Quadruplex Conformation”. Biochemistry. 40 (3): 830—836. doi:10.1021/bi001728v.
- ^ Patel, Sachin D.; Isalan, Mark; Gavory, Gérald; Ladame, Sylvain; Choo, Yen & Balasubramanian, Shankar (2004). „Inhibition of Human Telomerase Activity by an Engineered Zinc Finger Protein that Binds G-Quadruplexe”. Biochemistry. 43 (42): 13452—13458. doi:10.1021/bi048892t.
- ^ Ladame, Sylvain; Schouten, James A.; Roldan, Jose; Redman, James E.; Neidle, Stephen & Balasubramanian, Shankar (2006). „Exploring the Recognition of Quadruplex DNA by an Engineered Cys2-His2 Zinc Finger Protein”. Biochemistry. 45 (5): 1393—1399. doi:10.1021/bi050229x.
- ^ Brown, Bernard A.; Li, Yangqi; Brown, Julie C.; Hardin, Charles C.; Roberts, John F.; Pelsue, Stephen C. & Shultz, Leonard D. (1998). „Isolation and Characterization of a Monoclonal Anti-Quadruplex DNA Antibody from Autoimmune “Viable Motheaten” Mice”. Biochemistry. 37 (46): 16325—16337. doi:10.1021/bi981354u.
- ^ Schaffitzel, Christiane; Berger, Imre; Postberg, Jan; Hanes, Jozef; Lipps, Hans J. & Plückthun, Andreas (2001). „In vitro generated antibodies specific for telomeric guanine-quadruplex DNA react with Stylonychia lemnae macronuclei”. PNAS. 98 (15): 8572—8577. doi:10.1073/pnas.141229498. Архивирано из оригинала 24. 09. 2012. г. Приступљено 19. 04. 2012.
- ^ Paeschke, Katrin; Simonsson, Tomas; Postberg, Jan; Rhodes, Daniela & Lipps, Hans Joachim (2005). „Telomere end-binding proteins control the formation of G-quadruplex DNA structures in vivo”. Nature Structural & Molecular Biology. 12: 847—854. doi:10.1038/nsmb982.
- ^ Wei, Chunying; Jia, Guoqing; Zhou, Jun; Han, Gaoyi & Li, Can (2009). „Evidence for the binding mode of porphyrins to G-quadruplex DNA”. Phys. Chem. Chem. Phys. 11: 4025—4032. doi:10.1039/B901027K.
- ^ Wheelhouse, Richard T.; Sun, Daekyu; Han, Haiyong; Han, Frank Xiaoguang & Hurle, Laurence H. (1998). „Cationic Porphyrins as Telomerase Inhibitors: the Interaction of Tetra-(N-methyl-4-pyridyl)porphine with Quadruplex DNA”. J. Am. Chem. Soc. 120: 3261—3262.
- ^ Izbicka, Elzbieta; Wheelhouse, Richard T.; Raymond, Eric; Davidson, Karen K.; Lawrence, Richard A.; Sun, Daekyu; Windle, Bradford E.; Hurley, Laurence H. & Von, Daniel D.Hoff (1999). „Effects of Cationic Porphyrins as G-Quadruplex Interactive Agents in Human Tumor Cells”. Cancer Res. 59 (2): 639.
- ^ Agrawal, Saurabh; Ojha, Rajendra Prasad & Maiti, Souvik (2008). „Energetics of the Human Tel-22 Quadruplex−Telomestatin Interaction: A Molecular Dynamics Study”. J. Phys. Chem. B. 112 (22): 6828—6836. doi:10.1021/jp7102676.
- ^ Mu-Yong Kim; Vankayalapati, Hariprasad; Kazuo Shin-ya; Wierzba, Konstanty & Hurley, Laurence H. (2002). „Telomestatin, a Potent Telomerase Inhibitor That Interacts Quite Specifically with the Human Telomeric Intramolecular G-Quadruplex”. J. Am. Chem. Soc. 124 (10): 2098—2099. doi:10.1021/ja017308q.
- ^ Rezler, Evonne M.; Seenisamy, Jeyaprakashnarayanan; Bashyam, Sridevi; Mu-Yong Kim; White, Elizabeth; Wilson, W. David & Hurley, Laurence H. (2005). „Telomestatin and Diseleno Sapphyrin Bind Selectively to Two Different Forms of the Human Telomeric G-Quadruplex Structure”. J. Am. Chem. Soc. 127 (26): 9439—9447. doi:10.1021/ja0505088.
- ^ Seeman, Nadrian C. (1991). „Construction of Three-Dimensional Stick Figures from Branched DNA”. DNA and Cell Biology. 10 (7): 475—486. doi:10.1089/dna.1991.10.475.
- ^ Seeman, N. C. (2005). „DNA enables nanoscale control of the structure of matter”. Q. Rev. Biophys. 38 (4): 363—71. PMID 16515737. doi:10.1017/S0033583505004087.
- ^ Collins, M. L.; Irvine, B.; Tyner, D.; Fine, E.; Zayati, C.; Chang, C.; Horn, T.; Ahle, D.; Detmer, J.; Shen, L. P.; Kolberg, J.; Bushnell, S.; Urdea, M. S. & Ho, D. D. (1997). „A branched DNA signal amplification assay for quantification of nucleic acid targets below 100 molecules/ml”. Nucleic Acids Research. 25 (15): 2979—2984. PMC 146852
 . PMID 9224596. doi:10.1093/nar/25.15.2979.
. PMID 9224596. doi:10.1093/nar/25.15.2979.
- ^ Saiki, R.; Scharf, S.; Faloona, F.; Mullis, K.; Horn, G.; Erlich, H. & Arnheim, N. (1985). „Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia”. Science. 230 (4732): 1350—1354. PMID 2999980. doi:10.1126/science.2999980.
- ^ Saiki, R.; Gelfand, D.; Stoffel, S.; Scharf, S.; Higuchi, R.; Horn, G.; Mullis, K. & Erlich, H. (1988). „Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase”. Science. 239 (4839): 487—491. PMID 2448875. doi:10.1126/science.2448875.
- ^ Kevil, C. G., Walsh, L., Laroux, F. S., Kalogeris, T., Grisham, M. B., Alexander, J. S. (1997) An Improved, Rapid Northern Protocol. Biochem. and Biophys. Research Comm. 238:277-279.
- ^ Sandelin, A.; et al. (2007). [ttp://www.nature.com/nrg/journal/v8/n6/abs/nrg2026.html „Mammalian RNA polymerase II core promoters: insights from genome-wide studies”]. Nature Rev. Genet. 8: 424—436.
- ^ Painter PC, Mosher LE & Rhoads C (1982). „Low-frequency modes in the Raman spectra of proteins”. Biopolymers. 21 (7): 1469—72. PMID 7115900. doi:10.1002/bip.360210715.
- ^ Urabe H, Tominaga Y & Kubota K (1983). „Experimental evidence of collective vibrations in DNA double helix (Raman spectroscopy)”. Journal of Chemical Physics. 78 (10): 5937—5939. Bibcode:1983JChPh..78.5937U. doi:10.1063/1.444600.
- ^ Chou, K. C. (1984). „Low-frequency vibrations of DNA molecules”. Biochem. J. 221 (1): 27—31. PMC 1143999
 . PMID 6466317.
. PMID 6466317.
- ^ Chou KC, Maggiora GM & Mao B (1989). „Quasi-continuum models of twist-like and accordion-like low-frequency motions in DNA”. Biophys. J. 56 (2): 295—305. Bibcode:1989BpJ....56..295C. PMC 1280479
 . PMID 2775828. doi:10.1016/S0006-3495(89)82676-1.
. PMID 2775828. doi:10.1016/S0006-3495(89)82676-1.
- ^ Jiang-Cheng Shen; Rideout, William M.III & Jones, Peter A. (1994). „The rate of hydrolytic deamination of 5-methylcytosine in double-stranded DNA”. Nucl. Acids Res. 22 (6): 972—976. doi:10.1093/nar/22.6.972.
- ^ Wyatt, G. R. (1951). „Recognition and estimation of 5-methylcytosine in nucleic acids”. Biochem J. 48 (5): 581—584. PMC 1275378
 .
.
- ^ Wang RY, Kuo KC, Gehrke CW, Huang LH & Ehrlich M (1982). „Heat- and alkali-induced deamination of 5-methylcytosine and cytosine residues in DNA”. Biochimica et Biophysica Acta. 697 (3): 371—7. doi:10.1016/0167-4781(82)90101-4.
- ^ Jaenisch, Rudolf & Bird, Adrian (2003). „Epigenetic regulation of gene expression: how the genome integrates intrinsic and environmental signals”. Nature Genetics. 33: 245—254. doi:10.1038/ng1089.
- ^ Andersen, Angela A & Panning, Barbara (2003). „Epigeneticgeneregulation by noncoding RNAs”. Current Opinion in Cell Biology. 15 (3): 281—289. doi:10.1016/S0955-0674(03)00041-3.
- ^ Dolinoya, Dana C.; Weidmana, Jennifer R. & Jirtle, Randy L. (2007). „Epigeneticgeneregulation: Linking early developmental environment to adult disease”. Reproductive Toxicology. 23 (3): 297—307. doi:10.1016/j.reprotox.2006.08.012.
- ^ Reik, Wolf (2007). „Stability and flexibility of epigenetic gene regulation in mammalian development”. Nature. 447: 425—432. doi:10.1038/nature05918.
- ^ Duncan, Bruce K. & Miller, Jeffrey H. (1980). „Mutagenic deamination of cytosine residues in DNA”. Nature. 287: 560—561. doi:10.1038/287560a0.
- ^ WM Rideout, 3rd; Coetzee, GA; Olumi, AF & Jones, PA (1990). „5-Methylcytosine as an endogenous mutagen in the human LDL receptor and p53 genes”. Science. 249 (4974): 1288—1290. doi:10.1126/science.1697983.
- ^ Colot V & Rossignol JL (1999). „Eukaryotic DNA methylation as an evolutionary device”. Bioessays. 21 (5): 402—411. PMID 10376011. doi:10.1002/(SICI)1521-1878(199905)21:5<402::AID-BIES7>3.0.CO;2-B.
- ^ Klose R & Bird A (2006). „Genomic DNA methylation: the mark and its mediators”. Trends Biochem Sci. 31 (2): 89—97. PMID 16403636. doi:10.1016/j.tibs.2005.12.008.
- ^ Simpson, Victoria J.; Johnson, Thomas E. & Hammen, Richard F. (1986). „Caenorhabditis elegans DNA does not contain 5-methylcytosine at any time during development or aging”. Nucl. Acids Res. 14 (16): 6711—6719. doi:10.1093/nar/14.16.6711.
- ^ Lakowski, Bernard & Hekim, Siegfried (1998). „The genetics of caloric restriction in Caenorhabditis elegans”. PNAS. 95 (22): 13091—13096. doi:10.1073/pnas.95.22.13091. Архивирано из оригинала 07. 02. 2019. г. Приступљено 19. 04. 2012.
- ^ Bird, A. (2002). „DNA methylation patterns and epigenetic memory”. Genes Dev. 16 (1): 6—21. PMID 11782440. doi:10.1101/gad.947102.
- ^ Iqbal, K.; Jin, S. -G.; Pfeifer, G. P. & Szabo, P. E. (2011). „Reprogramming of the paternal genome upon fertilization involves genome-wide oxidation of 5-methylcytosine”. Proceedings of the National Academy of Sciences. 108 (9): 3642—3647. PMC 3048122
 . PMID 21321204. doi:10.1073/pnas.1014033108.
. PMID 21321204. doi:10.1073/pnas.1014033108.
- ^ Dodge JE, Ramsahoye BH, Wo ZG, Okano M & Li E (2002). „De novo methylation of MMLV provirus in embryonic stem cells: CpG versus non-CpG methylation”. Gene. 289 (1–2): 41—48. doi:10.1016/S0378-1119(02)00469-9.
- ^ Haines TR, Rodenhiser DI & Ainsworth PJ (2001). „Allele-Specific Non-CpG Methylation of the Nf1 Gene during Early Mouse Development”. Developmental Biology. 240 (2): 585—598. PMID 11784085. doi:10.1006/dbio.2001.0504.
- ^ Lister R, Pelizzola M, Dowen RH, et al. (2009). „Human DNA methylomes at base resolution show widespread epigenomic differences”. Nature. 462 (7271): 315—22. PMC 2857523
 . PMID 19829295. doi:10.1038/nature08514.
. PMID 19829295. doi:10.1038/nature08514.
- ^ Jaenisch, R. & Bird, A. (2003). „Epigenetic regulation of gene expression: how the genome integrates intrinsic and environmental signals”. Nature Genetics. 33 Suppl (3s): 245—254. PMID 12610534. doi:10.1038/ng1089.
- ^ Walsh C & Xu G (2006). „Cytosine methylation and DNA repair”. Curr Top Microbiol Immunol. Current Topics in Microbiology and Immunology. 301: 283—315. ISBN 978-3-540-29114-5. PMID 16570853. doi:10.1007/3-540-31390-7_11.
- ^ Jones, Peter A & Laird, Peter W. (1999). „Cancer-epigenetics comes of age”. Nature Genetics. 21: 163—167. doi:10.1038/5947.
- ^ Esteller, Manel; Corn, Paul G.; Baylin, Stephen B. & Herman, James G. (2001). „A Gene Hypermethylation Profile of Human Cancer”. Cancer Res. 61: 3225.
- ^ Baylin, Stephen B & Herman, James G. (2000). „DNA hypermethylation in tumorigenesis: epigenetics joins genetics”. 16 (4): 168—174. doi:10.1016/S0168-9525(99)01971-X.
- ^ Craig 2011
- ^ Smith, S. S. (1998). „Stalling of DNA methyltransferase in chromosome stability and chromosome remodelling”. Int J Mol Med. 1 (1): 147—56.
- ^ Smith, Ian M.; Mydlarz, Wojciech K.; Mithani, Suhail K. & Califano, Joseph A. (2007). „DNA global hypomethylation in squamous cell head and neck cancer associated with smoking, alcohol consumption and stage”. International Journal of Cancer. 121 (8): 1724—1728. doi:10.1002/ijc.22889.
- ^ Heithoff, Douglas M.; Sinsheimer, Robert L.; Low, David A. & Mahan, Michael J. „An Essential Role for DNA Adenine Methylation in Bacterial Virulence”. 1999. 284 (5416): 967—970. doi:10.1126/science.284.5416.967.
- ^ Pukkila, Patricia J.; Peterson, Janet; Herman, Gail; Modrich, Paul & Meselson, Matthew (1983). „Effects of high levels of DNA adenine methylation on methyl-directed mismatch repair in Escherichia coli”. Genetics. 104 (4): 571—582.
- ^ Kriaucionis S & Heintz N (2009). „The nuclear DNA base 5-hydroxymethylcytosine is present in Purkinje neurons and the brain”. Science. 324 (5929): 929—30. Bibcode:2009Sci...324..929K. PMC 3263819
 . PMID 19372393. doi:10.1126/science.1169786.
. PMID 19372393. doi:10.1126/science.1169786.
- ^ Ratel D, Ravanat J, Berger F & Wion D (2006). „N6-methyladenine: the other methylated base of DNA”. Bioessays. 28 (3): 309—15. PMC 2754416
 . PMID 16479578. doi:10.1002/bies.20342.
. PMID 16479578. doi:10.1002/bies.20342.
- ^ Gommers-Ampt J, Van Leeuwen F, de Beer A, Vliegenthart J, Dizdaroglu M, Kowalak J, Crain P & Borst P (1993). „beta-D-glucosyl-hydroxymethyluracil: a novel modified base present in the DNA of the parasitic protozoan T. brucei”. Cell. 75 (6): 1129—36. PMID 8261512. doi:10.1016/0092-8674(93)90322-H.
- ^ Pradhan, Padmanava; Tirumala, Sampath; Liu, Xiaohong; Sayer, Jane M.; Jerina, Donald M. & Herman J. C. Yeh (2001). „Solution structure of a trans-opened (10S)-dA adduct of (+)-(7S,8R,9S,10R)-7,8-dihydroxy-9,10-epoxy-7,8,9,10-tetrahydrobenzo[a]pyrene in a fully complementary DNA duplex: evidence for a major syn conformation”. Biochemistry. 40 (20): 5870—5881. doi:10.1021/bi002896q.
- ^ Schurter, Eric J.; Herman J. C. Yeh; Sayer, Jane M.; Lakshman, Mahesh K.; Yagi, Haruhiko; Jerina, Donald M. & Gorenstein, David G. (1995). „NMR Solution Structure of a Nonanucleotide Duplex with a dG Mismatch Opposite a 10R Adduct Derived from Trans Addition of a Deoxyadenosine N6-Amino Group to (-)-(7S,8R,9R,10S)-7,8-Dihydroxy-9,10-epoxy-7,8,9,10-tetrahydrobenzo[a]pyrene”. Biochemistry. 34 (4): 1364—1375. doi:10.1021/bi00004a031.
- ^ Volk, D. E.; Rice, J. S.; Luxon, B. A.; H. J. C. Yeh; Liang, C.; Xie, G.; Sayer, J. M.; Jerina, D. M. & Gorenstein, D. G. (2000). „NMR Evidence for Syn-Anti Interconversion of a Trans Opened (10R)-dA Adduct of Benzo[a]pyrene (7S,8R)-Diol (9R,10S)-Epoxide in a DNA Duplex”. Biochemistry. 39 (46,): 14040—14053. doi:10.1021/bi001669l.
- ^ Epe, B. (1996). „DNA damage profiles induced by oxidizing agents”. Reviews of Physiology Biochemistry and Pharmacology. 127: 223—249. doi:10.1007/BFb0048268.
- ^ Kennedy, Laura J.; Kenneth Moore Jr.; Caulfield, Jennifer L.; Tannenbaum, Steven R. & Dedon, Peter C. (1997). „Quantitation of 8-Oxoguanine and Strand Breaks Produced by Four Oxidizing Agents”. Chem. Res. Toxicol. 10 (4): 386—392. doi:10.1021/tx960102w.
- ^ Marnett, Lawrence J. (1999). „Lipid peroxidation—DNAdamage by malondialdehyde”. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 424 (1–2): 83—95.
- ^ Wei-Xing Zong1; Ditsworth, Dara; Bauer, Daniel E.; Zhao-Qi Wang & Thompson, Craig B. (2004). „Alkylating DNA damage stimulates a regulated form of necrotic cell death”. Genes & Dev. 18: 1272—1282. doi:10.1101/gad.1199904.
- ^ Raymond, R.; Gary H.S. Straussb; Peters, William P. (1992). „High-dose combination alkylatingagents with autologous bone-marrow support in patients with breast cancer: preliminary assessment of DNA damage in individual peripheral blood lymphocytes using the single cell gel electrophoresis assay”. Mutation Research/Environmental Mutagenesis and Related Subjects. 271 (2): 101—113.
- ^ Tornaletti, Silvia; Pfeifer, Gerd P. (1995). „UV Light as a Footprinting Agent: Modulation of UV-induced DNA Damage by Transcription Factors Bound at the Promoters of Three Human Genes”. Journal of Molecular Biology. 249 (4): 714—728.
- ^ C Kielbassa, L Roza & Epe, B (1997). „Wavelength dependence of oxidative DNA damage induced by UV and visible light”. Carcinogenesis. 18 (4): 811—816. doi:10.1093/carcin/18.4.811.
- ^ Rothkamm, Kai & Löbrich, Markus (2003). „Evidence for a lack of DNA double-strand break repair in human cells exposed to very low x-ray doses”. PNAS. 100 (9): 5057—5062. doi:10.1073/pnas.0830918100. Архивирано из оригинала 24. 09. 2015. г. Приступљено 20. 04. 2012.
- ^ Kinsella, Timothy J.; Dobson, Patricia P.; Mitchell, James B.; Fornace, Albert J.Jr. (1987). „Enhancement of Xray induced DNA damage by pre-treatment with halogenated pyrimidine analogs”. International Journal of Radiation. 13 (5): 733—739.
- ^ Douki T, Reynaud-Angelin A, Cadet J, Sage E (2003). „Bipyrimidine photoproducts rather than oxidative lesions are the main type of DNA damage involved in the genotoxic effect of solar UVA radiation”. Biochemistry. 42 (30): 9221—6. PMID 12885257. doi:10.1021/bi034593c.
- ^ Marnett, Lawrence J. (2000). „Oxyradicals and DNA damage”. Carcinogenesis. 21 (3): 361—370. doi:10.1093/carcin/21.3.361.
- ^ Wallace, Susan S. (1998). „Enzymatic Processing of Radiation-Induced Free Radical Damage in DNA”. Radiation Research. 150 (5s): S60—S79.
- ^ Bradleya, Matthews O; Erickson, Leonard C. (1981). „Comparison of the effects of hydrogen peroxide and X-ray irradiation on toxicity, mutation, and DNA damage/repair in mammalian cells (V-79)”. Biochimica et Biophysica Acta (BBA) — Nucleic Acids and Protein Synthesis. 654 (1): 135—141.
- ^ Imlay, JA; Chin, SM & Linn, S (1988). „Toxic DNA damage by hydrogen peroxide through the Fenton reaction in vivo and in vitro”. Science. 240 (4852): 640—642. doi:10.1126/science.2834821.
- ^ Cadet J, Delatour T, Douki T, Gasparutto D, Pouget J, Ravanat J, Sauvaigo S (1999). „Hydroxyl radicals and DNA base damage”. Mutat Res. 424 (1–2): 9—21. PMID 10064846. doi:10.1016/S0027-5107(99)00004-4.
- ^ Beckman KB, Ames BN (1997). „Oxidative decay of DNA”. J. Biol. Chem. 272 (32): 19633—6. PMID 9289489. doi:10.1074/jbc.272.32.19633.
- ^ Valerie K, Povirk L (2003). „Regulation and mechanisms of mammalian double-strand break repair”. Oncogene. 22 (37): 5792—812. PMID 12947387. doi:10.1038/sj.onc.1206679.
- ^ Kikkawa, S.; Kanamaru, F.; Koizumi, M. (1983). „Layered Intercalation Compounds”. Inorganic Syntheses. 22 (86). doi:10.1002/9780470132531.ch17.
- ^ Cohen, Seth M.; Stephen, J. (2001). „Cisplatin: From DNA damage to cancer chemotherapy”. Progress in Nucleic Acid Research and Molecular Biology. 67: 93—130. doi:10.1016/S0079-6603(01)67026-0.
- ^ Prütz, W. A. (1984). „Inhibition of DNA-ethidium bromide intercalation due to free radical attack upon DNA. II. Copper(II)-catalysed DNA damage by O.2-”. Radiation and Environmental Biophysics. 23 (1): 7—18. doi:10.1007/BF01326732.
- ^ Singh, N. P.; Stephens, R. E.; Schneider, E. L. (1994). „Modifications of Alkaline Microgel Electrophoresis for Sensitive Detection of DNA Damage”. 66 (1): 23—28. doi:10.1080/09553009414550911.
- ^ Herman RK, Dworkin NB (1971). „Effect of gene induction on the rate of mutagenesis by ICR-191 in Escherichia coli”. Journal of Bacteriology. 106 (2): 543—50. PMC 285129
 . PMID 4929867. Приступљено 15. 5. 2010.
. PMID 4929867. Приступљено 15. 5. 2010.
- ^ Rowe, Thomas C.; Chen, Grace L.; Yaw-Huei Hsiang & Liu, Leroy F. (1986). „DNA Damage by Antitumor Acridines Mediated by Mammalian DNA Topoisomerase II”. Cancer Res. 46: 2021.
- ^ а б Weiss, R. B. (1992). „The anthracyclines: will we ever find a better doxorubicin?”. Seminars in Oncology. 19 (6): 670—86. PMID 1462166.
- ^ а б Tan C, Tasaka H, Yu KP, Murphy ML, Karnofsky DA (1967). „Daunomycin, an antitumor antibiotic, in the treatment of neoplastic disease. Clinical evaluation with special reference to childhood leukemia”. Cancer. 20 (3): 333—53. PMID 4290058. doi:10.1002/1097-0142(1967)20:3<333::AID-CNCR2820200302>3.0.CO;2-K.
- ^ Palečeka, Emil; Fojtaa, Miroslav; Tomschika, Miroslav; Wang, Joseph (1998). „Electrochemical biosensors for DNA hybridization and DNA damage”. Biosensors and Bioelectronics. 13 (6): 621—628.
- ^ Laginha, K. M. (2005). „Determination of Doxorubicin Levels in Whole Tumor and Tumor Nuclei in Murine Breast Cancer Tumors”. Clinical Cancer Research. 11 (19).
- ^ Ferguson L, Denny W (1991). „The genetic toxicology of acridines”. Mutat Res. 258 (2): 123—60. PMID 1881402.
- ^ Stephens T, Bunde C, Fillmore B (2000). „Mechanism of action in thalidomide teratogenesis”. Biochem Pharmacol. 59 (12): 1489—99. PMID 10799645. doi:10.1016/S0006-2952(99)00388-3.
- ^ Parman, Toufan; Wiley, Michael J. & Wells, Peter G. (1999). „Free radical-mediated oxidative DNA damage in the mechanism of thalidomide teratogenicity”. Nature Medicine. 5: 582—585. doi:10.1038/8466.
- ^ Kazerouni N, Sinha R, Hsu CH, Greenberg A, Rothman N (2002). „Analysis of 200 food items for benzo[a]pyrene and estimation of its intake in an epidemiologic study”. Food and Chemical Toxicology. 40 (1): 133. doi:10.1016/S0278-6915(00)00158-7.
- ^ Lee BM, Shim GA (2007). „Dietary exposure estimation of benzo[a]pyrene and cancer risk assessment”. Journal of Toxicology and Environmental Health Part A. 70 (15—16): 1391—4. PMID 17654259.
- ^ Williams, Jonathan H; Phillips, Timothy D.; Jolly, Pauline E; Stiles, Jonathan K.; Jolly, Curtis M & Aggarwal, Deepak (2004). „Human aflatoxicosis in developing countries: a review of toxicology, exposure, potential health consequences, and interventions”. American Journal of Clinical Nutrition. 80 (5): 1106—1122.
- ^ Abbas Hamed K. (2005). Aflatoxin and Food Safety. CRC Press. ISBN 978-0-8247-2303-3.
- ^ Hudler 1985.
- ^ Jeffrey 1985, стр. 237–72.
- ^ Braña M, Cacho M, Gradillas A, de Pascual-Teresa B, Ramos A (2001). „Intercalators as anticancer drugs”. Curr Pharm Des. 7 (17): 1745—80. PMID 11562309. doi:10.2174/1381612013397113.
- ^ Hastings, P J; Lupski, JR; Rosenberg, SM; Ira, G (2009). „Mechanisms of change in gene copy number”. Nature Reviews. Genetics. 10 (8): 551—564. PMC 2864001
 . PMID 19597530. doi:10.1038/nrg2593.
. PMID 19597530. doi:10.1038/nrg2593.
- ^ Carroll SB, Grenier J, Weatherbee SD (2005). From DNA to Diversity: Molecular Genetics and the Evolution of Animal Design (Second изд.). Oxford: Blackwell Publishing. ISBN 978-1-4051-1950-4.
- ^ а б Harrison P, Gerstein M (2002). „Studying genomes through the aeons: protein families, pseudogenes and proteome evolution”. J Mol Biol. 318 (5): 1155—74. PMID 12083509. doi:10.1016/S0022-2836(02)00109-2.
- ^ Orengo CA, Thornton JM (2005). „Protein families and their evolution-a structural perspective”. Annu. Rev. Biochem. 74: 867—900. PMID 15954844. doi:10.1146/annurev.biochem.74.082803.133029. Архивирано из оригинала 11. 07. 2021. г. Приступљено 20. 04. 2012.
- ^ Long M, Betrán E, Thornton K, Wang W (2003). „The origin of new genes: glimpses from the young and old”. Nat. Rev. Genet. 4 (11): 865—75. PMID 14634634. doi:10.1038/nrg1204.
- ^ Wang M, Caetano-Anollés G (2009). „The evolutionary mechanics of domain organization in proteomes and the rise of modularity in the protein world”. Structure. 17 (1): 66—78. PMID 19141283. doi:10.1016/j.str.2008.11.008.
- ^ Bowmaker, J. K. (1998). „Evolution of colour vision in vertebrates”. Eye (London, England). 12 (Pt 3b): 541—7. PMID 9775215. doi:10.1038/eye.1998.143.
- ^ Gregory TR, Hebert PD (1999). „The modulation of DNA content: proximate causes and ultimate consequences”. Genome Res. 9 (4): 317—24. PMID 10207154. doi:10.1101/gr.9.4.317.
- ^ Hurles, M. (2004). „Gene Duplication: The Genomic Trade in Spare Parts”. PLoS Biol. 2 (7): E206. PMC 449868
 . PMID 15252449. doi:10.1371/journal.pbio.0020206.
. PMID 15252449. doi:10.1371/journal.pbio.0020206.
- ^ Liu N, Okamura K, Tyler DM (2008). „The evolution and functional diversification of animal microRNA genes”. Cell Res. 18 (10): 985—96. PMC 2712117
 . PMID 18711447. doi:10.1038/cr.2008.278.
. PMID 18711447. doi:10.1038/cr.2008.278.
- ^ Siepel, A. (2009). „Darwinian alchemy: Human genes from noncoding DNA”. Genome Res. 19 (10): 1693—5. PMC 2765273
 . PMID 19797681. doi:10.1101/gr.098376.109.
. PMID 19797681. doi:10.1101/gr.098376.109.
- ^ Zhang J, Wang X, Podlaha O (2004). „Testing the Chromosomal Speciation Hypothesis for Humans and Chimpanzees”. Genome Res. 14 (5): 845—51. PMC 479111
 . PMID 15123584. doi:10.1101/gr.1891104.
. PMID 15123584. doi:10.1101/gr.1891104.
- ^ Ayala FJ, Coluzzi M (2005). „Chromosome speciation: Humans, Drosophila, and mosquitoes”. Proc. Natl. Acad. Sci. U.S.A. 102 (Suppl 1): 6535—42. PMC 1131864
 . PMID 15851677. doi:10.1073/pnas.0501847102.
. PMID 15851677. doi:10.1073/pnas.0501847102.
- ^ Hurst GD, Werren JH (2001). „The role of selfish genetic elements in eukaryotic evolution”. Nat. Rev. Genet. 2 (8): 597—606. PMID 11483984. doi:10.1038/35084545.
- ^ Häsler J, Strub K (2006). „Alu elements as regulators of gene expression”. Nucleic Acids Res. 34 (19): 5491—7. PMC 1636486
 . PMID 17020921. doi:10.1093/nar/gkl706.
. PMID 17020921. doi:10.1093/nar/gkl706.
- ^ Aminetzach YT, Macpherson JM, Petrov DA (2005). „Pesticide resistance via transposition-mediated adaptive gene truncation in Drosophila”. Science. 309 (5735): 764—7. PMID 16051794. doi:10.1126/science.1112699.
- ^ Bertram, J. (2000). „The molecular biology of cancer”. Mol. Aspects Med. 21 (6): 167—223. PMID 11173079. doi:10.1016/S0098-2997(00)00007-8.
- ^ Burrus V, Waldor M (2004). „Shaping bacterial genomes with integrative and conjugative elements”. Res. Microbiol. 155 (5): 376—86. PMID 15207870. doi:10.1016/j.resmic.2004.01.012.
- ^ Eyre-Walker A, Keightley PD (2007). „The distribution of fitness effects of new mutations” (PDF). Nature Reviews Genetics. 8 (8): 610—8. PMID 17637733. doi:10.1038/nrg2146. Архивирано из оригинала (PDF) 04. 03. 2016. г. Приступљено 22. 04. 2012.
- ^ Sober 2001, стр. 309–321.
- ^ Orr, H. A. (2009). „Fitness and its role in evolutionary genetics”. Nat. Rev. Genet. 10 (8): 531—9. PMC 2753274
 . PMID 19546856. doi:10.1038/nrg2603.
. PMID 19546856. doi:10.1038/nrg2603.
- ^ Whitlock, Michael C. (2000). „Fixation of new alleles and the extinction of small populations: drift load, beneficial alleles, and sexual selection”. 54 (6): 1855—1861. doi:10.1111/j.0014-3820.2000.tb01232.x.
- ^ Lenormand, Thomas (2002). „Gene flow and the limits to natural selection”. 17 (4): 183—189.
- ^ Thorpe, James H; Gale, Benjamin C.; Susana C.M Teixeira; Cardin, Christine J (2003). „Conformational and Hydration Effects of Site-selective Sodium, Calcium and Strontium Ion Binding to the DNA HollidayJunction Structure d(TCGGTACCGA)4”. Journal of Molecular Biology. 327 (1): 97—109. doi:10.1016/S0022-2836(03)00088-3.
- ^ Conway AB, Lynch TW, Zhang Y, Fortin GS, Fung CW, Symington LS, Rice PA (2004). „Crystal structure of a Rad51 filament”. Nat Struct Mol Biol. 11 (8): 791—6. PMID 15235592.
- ^ Cremer T, Cremer C (2001). „Chromosome territories, nuclear architecture and gene regulation in mammalian cells”. Nat Rev Genet. 2 (4): 292—301. PMID 11283701. doi:10.1038/35066075.
- ^ Pál C, Papp B, Lercher M (2006). „An integrated view of protein evolution”. Nat Rev Genet. 7 (5): 337—48. PMID 16619049. doi:10.1038/nrg1838.
- ^ O'Driscoll M, Jeggo P (2006). „The role of double-strand break repair – insights from human genetics”. Nat Rev Genet. 7 (1): 45—54. PMID 16369571. doi:10.1038/nrg1746.
- ^ Vispé S, Defais M (1997). „Mammalian Rad51 protein: a RecA homologue with pleiotropic functions”. Biochimie. 79 (9–10): 587—92. PMID 9466696. doi:10.1016/S0300-9084(97)82007-X.
- ^ Neale MJ, Keeney S (2006). „Clarifying the mechanics of DNA strand exchange in meiotic recombination”. Nature. 442 (7099): 153—8. Bibcode:2006Natur.442..153N. PMID 16838012. doi:10.1038/nature04885.
- ^ Middleton, Claire L.; Parker, Joanne L.; Richard, Derek J.; White, Malcolm F. & Bond, Charles S. (2004). „Substrate recognition and catalysis by the Holliday junction resolving enzyme Hje”. Nucl. Acids Res. 32 (18): 5442—5451. doi:10.1093/nar/gkh869.
- ^ Hays, Franklin A.; Vargason, Jeffrey M. & Ho, P. Shing (2003). „Effect of Sequence on the Conformation of DNA Holliday Junctions”. Biochemistry. 42 (32): 9586—9597. doi:10.1021/bi0346603.
- ^ Dickman M, Ingleston S, Sedelnikova S, Rafferty J, Lloyd R, Grasby J, Hornby D (2002). „The RuvABC resolvasome”. Eur J Biochem. 269 (22): 5492—501. PMID 12423347. doi:10.1046/j.1432-1033.2002.03250.x.
- ^ Sick, Knud; Nielsen, Jorn Tones (1964). „Genetics of amylase isozymes in the mouse”. 51 (2—3): 291—296. doi:10.1111/j.1601-5223.1964.tb01937.x.
- ^ Robertson, D. S. (1984). „Different frequency in the recovery of crossover products from male and female gametes of plants hypoploid for BA translocations in maize”. Genetics. 107 (1): 117—130.
- ^ Terwilliger1, Joseph D.; Speer, Marcy; Ott, Jurg (1993). „Chromosome-based method for rapid computer simulation in human genetic linkage analysis”. Genetic Epidemiology. 10 (4): 217—224. doi:10.1002/gepi.1370100402.
- ^ Giovannoni, James J.; Wing, Rod A.; Ganal, Martin W. & Tanksley, Steven D. (1991). „Isolation of molecular markers from specific chromosomal intervals using DNA pools from existing mapping populations”. Nucl. Acids Res. 19 (23): 6553—6568. doi:10.1093/nar/19.23.6553.
- ^ Xin-zhuan Su; Ferdig, Michael T.; Huang, Yaming; Huynh, Chuong Q.; Liu, Anna; You, Jingtao; Wootton3, John C. & Wellems, Thomas E. (1999). „A Genetic Map and Recombination Parameters of the Human Malaria Parasite Plasmodium falciparum”. Science. 286 (5443): 1351—1353. doi:10.1126/science.286.5443.1351.
- ^ Dietrich, W.; Katz, H.; Lincoln, S. E.; Shin, H. S.; Friedman, J.; Dracopoli, N. L. & Lander, E. S. (1992). „A Genetic Map of the Mouse Suitable for Typing Intraspecific Crosses”. Genetics. 131 (2): 423—447.
- ^ Abecasis, Gonçalo R.; Cherny, Stacey S.; Cookson, William O. & Cardon, Lon R. (2001). „Merlin—rapid analysis of dense genetic maps using sparse gene flow trees”. Nature Genetics. 30: 97—101. doi:10.1038/ng786.
- ^ Murray, JC; Buetow, KH; Weber, JL; Ludwigsen, S; T Scherpbier-Heddema; Manion, F; Quillen, J; Sheffield, VC; Sunden, S; GM Duyk; et al. (1994). „A comprehensive human linkage map with centimorgan density. Cooperative Human Linkage Center (CHLC)”. Science. 265 (5181): 2049—2054. doi:10.1126/science.8091227.
- ^ Cavell, A. C.; Lydiate, D. J.; I.A.P. Parkin; Dean, C. & Trick, M. (1998). „Collinearity between a 30-centimorgan segment of Arabidopsis thaliana chromosome 4 and duplicated regions within the Brassica napus genome” (PDF). Genome. 41: 62—69.
- ^ Rinchik, E M; Carpenter, D A. & Selby, P B (1990). „A strategy for fine-structure functional analysis of a 6- to 11-centimorgan region of mouse chromosome 7 by high-efficiency mutagenesis”. PNAS. 87 (3): 896—900. Архивирано из оригинала 24. 09. 2015. г. Приступљено 22. 04. 2012.
- ^ Venter, J.; Adams, MD; Myers, EW; Li, PW; Mural, RJ; Sutton, GG; Smith, HO; Yandell, M; et al. (2001). „The sequence of the human genome”. Science. 291 (5507): 1304—51. Bibcode:2001Sci...291.1304V. PMID 11181995. doi:10.1126/science.1058040.
- ^ Thanbichler M, Wang S, Shapiro L (2005). „The bacterial nucleoid: a highly organized and dynamic structure”. J Cell Biochem. 96 (3): 506—21. PMID 15988757. doi:10.1002/jcb.20519.
- ^ Richard, Tavaré & Waterman 2005.
- ^ Link, A J; Phillips, D & Church, G M (1997). „Methods for generating precise deletions and insertions in the genome of wild-type Escherichia coli: application to open reading frame characterization”. J. Bacteriol. 179 (20): 6228—6237. Архивирано из оригинала 13. 06. 2016. г. Приступљено 22. 04. 2012.
- ^ Austin S, Dixon R (1992). „The prokaryotic enhancer binding protein NTRC has an ATPase activity which is phosphorylation and DNA dependent”. EMBO J. 11 (6): 2219—28. PMC 556689
 . PMID 1534752.
. PMID 1534752.
- ^ Wolfsberg T, McEntyre J, Schuler G (2001). „Guide to the draft human genome”. Nature. 409 (6822): 824—6. PMID 11236998. doi:10.1038/35057000.
- ^ Gregory, T. (2005). „The C-value enigma in plants and animals: a review of parallels and an appeal for partnership”. Ann Bot (Lond). 95 (1): 133—46. PMID 15596463. doi:10.1093/aob/mci009.
- ^ The ENCODE Project Consortium (2007). „Identification and analysis of functional elements in 1% of the human genome by the ENCODE pilot project”. Nature. 447 (7146): 799—816. Bibcode:2007Natur.447..799B. PMC 2212820
 . PMID 17571346. doi:10.1038/nature05874.
. PMID 17571346. doi:10.1038/nature05874.
- ^ Shimoni, Yishai; Friedlander, Gilgi; Hetzroni, Guy; Niv, Gali; Altuvia, Shoshy; Biham, Ofer & Margalit, Hanah (2007). „Regulation of gene expression by small non-coding RNAs: a quantitative view”. Molecular Systems Biology. doi:10.1038/msb4100181.
- ^ Pollard 2007, стр. 200–203.
- ^ „Sister chromatid cohesion”. Genetics Home Reference. United States National Library of Medicine. 15. 5. 2011.
- ^ Pidoux A, Allshire R (2005). „The role of heterochromatin in centromere function”. Philos Trans R Soc Lond B Biol Sci. 360 (1455): 569—79. PMC 1569473
 . PMID 15905142. doi:10.1098/rstb.2004.1611.
. PMID 15905142. doi:10.1098/rstb.2004.1611.
- ^ Vanin, E. F. (1985). „Processed pseudogenes: characteristics and evolution”. Annu. Rev. Genet. 19: 253—72. PMID 3909943. doi:10.1146/annurev.ge.19.120185.001345.
- ^ Harrison P, Hegyi H, Balasubramanian S, Luscombe N, Bertone P, Echols N, Johnson T, Gerstein M (2002). „Molecular Fossils in the Human Genome: Identification and Analysis of the Pseudogenes in Chromosomes 21 and 22”. Genome Res. 12 (2): 272—80. PMC 155275
 . PMID 11827946. doi:10.1101/gr.207102.
. PMID 11827946. doi:10.1101/gr.207102.
- ^ Zhang, J. (2003). „Evolution by gene duplication: an update”. Trends in Ecology & Evolution. 18 (6): 292—8. doi:10.1016/S0169-5347(03)00033-8.
- ^ Taylor JS, Raes J (2004). „Duplication and divergence: the evolution of new genes and old ideas”. Annu. Rev. Genet. 38: 615—43. PMID 15568988. doi:10.1146/annurev.genet.38.072902.092831.
- ^ Harrison P, Gerstein M (2002). „Studying genomes through the aeons: protein families, pseudogenes and proteome evolution”. J Mol Biol. 318 (5): 1155—74. PMID 12083509. doi:10.1016/S0022-2836(02)00109-2.
- ^ A., Schneider R. (2005). „Developmental mechanisms facilitating the evolution of bills and quills”. Journal of Anatomy. 207 (5): 563—573. PMC 1571558
 . PMID 16313392. doi:10.1111/j.1469-7580.2005.00471.x.
. PMID 16313392. doi:10.1111/j.1469-7580.2005.00471.x.
- ^ Good, JM; Hayden, CA; Wheeler, TJ (2006). „Adaptive protein evolution and regulatory divergence in Drosophila”. Mol Biol Evol. 23 (6): 1101—3. PMID 16537654.
- ^ Yoshikuni, Y.; Ferrin, T. E.; Keasling, J. D. (2006). „Designed divergent evolution of enzyme function”. Nature. 440 (7087): 1078—1082. Bibcode:2006Natur.440.1078Y. PMID 16495946. doi:10.1038/nature04607.
- ^ Yin, Y. Whitney & Steitz, Thomas A. (2002). „Structural Basis for the Transition from Initiation to Elongation Transcription in T7 RNA Polymerase”. Science. 298 (5597): 1387—1395. doi:10.1126/science.1077464.
- ^ Churchill F.B. (1974). „William Johannsen and the genotype concept”. Journal of the History of Biology. 7: 5—30. doi:10.1007/BF00179291.
- ^ Johannsen, W. (1911). „The genotype conception of heredity”. American Naturalist. 45: 129—159.
- ^ Turanov AA, Lobanov AV, Fomenko DE, Morrison HG, Sogin ML, Klobutcher LA, Hatfield DL, Gladyshev VN (2009). „Genetic code supports targeted insertion of two amino acids by one codon”. Science. 323 (5911): 259—61. PMID 19131629. doi:10.1126/science.1164748.
- ^ Crick 1988, стр. 89–101
- ^ Maloy, S. (29. 11. 2003). „How nonsense mutations got their names”. Microbial Genetics Course. San Diego State University. Архивирано из оригинала 23. 09. 2020. г. Приступљено 10. 3. 2010.
- ^ а б Kornberg, Arthur (1984). „DNA replication”. Trends in Biochemical Sciences. 9 (4): 122—124. doi:10.1016/0968-0004(84)90114-2.
- ^ а б Bell, SP; Stillman, B (1992). „ATP-dependent recognition of eukaryotic origins of DNA replication by a multiprotein complex” (PDF). Nature. 357: 128—134. Архивирано из оригинала (PDF) 10. 11. 2013. г. Приступљено 26. 4. 2012.
- ^ а б Hill, T M & Marians, K J. (1990). „Escherichia coli Tus protein acts to arrest the progression of DNA replication forks in vitro”. PNAS. 87 (7): 2481—2485. Архивирано из оригинала 28. 11. 2018. г. Приступљено 26. 04. 2012.
- ^ а б Hill, T M; Tecklenburg, M L.; Pelletier, A J & Kuempe, P L. (1989). „Tus, the trans-acting gene required for termination of DNA replication in Escherichia coli, encodes a DNA-binding protein”. PNAS. 86 (5): 1593—1597. Архивирано из оригинала 28. 11. 2018. г. Приступљено 26. 04. 2012.
- ^ Albà, M. (2001). „Replicative DNA polymerases” (PDF). Genome Biol. 2 (1): REVIEWS3002. PMC 150442
 . PMID 11178285. doi:10.1186/gb-2001-2-1-reviews3002.
. PMID 11178285. doi:10.1186/gb-2001-2-1-reviews3002.
- ^ Pelletier, Huguette; Sawaya, Michael R.; Wolfle, William; Wilson, Samuel H. & Kraut, Joseph (1996). „A Structural Basis for Metal Ion Mutagenicity and Nucleotide Selectivity in Human DNA Polymerase β”. Biochemistry. 35 (39): 12762—12777. doi:10.1021/bi9529566.
- ^ Moyer, Stephen E.; Lewis, Peter W. & Botchan, Michael R. (2006). „Isolation of the Cdc45/Mcm2–7/GINS (CMG) complex, a candidate for the eukaryotic DNA replication fork helicase”. PNAS. 103 (27): 10236—10241. doi:10.1073/pnas.0602400103. Архивирано из оригинала 24. 09. 2015. г. Приступљено 26. 04. 2012.
- ^ а б Bambara, Robert A.; Murante, Richard S.; Henricksen, Leigh A. (1997). „Enzymes and Reactions at the Eukaryotic DNA Replication Fork”. The Journal of Biological Chemistry. 272: 4647—4650. doi:10.1074/jbc.272.8.4647.
- ^ Hyrien, Olivier; Marheineke, Kathrin; Goldar, Arach (2003). „Paradoxes of eukaryotic DNA replication: MCM proteins and the random completion problem”. 25 (2): 116—125. doi:10.1002/bies.10208.
- ^ Hindges R, Hübscher U (1997). „DNA polymerase delta, an essential enzyme for DNA transactions”. Biol Chem. 378 (5): 345—62.
- ^ Yang, C L; Chang, L S.; Zhang, P; Hao, H; Zhu, L; Toomey, N L & Lee, M Y. (1992). „Molecular cloning of the cDNA for the catalytic subunit of human DNA polymerase delta”. Nucleic Acids Res. 20 (4): 735—745. PMC 312012
 .
.
- ^ „The DNA replication fork in eukaryotic cells”. Annual Review of Biochemistry. 67: 721—751. 1998. doi:10.1146/annurev.biochem.67.1.721. Архивирано из оригинала 20. 05. 2016. г. Приступљено 26. 04. 2012.
- ^ Bell1, Stephen P. & Dutta, Anindya (2002). „DNA replication in eukaryotic cells”. Annual Review of Biochemistry. 71: 333—374. doi:10.1146/annurev.biochem.71.110601.135425. Архивирано из оригинала 07. 02. 2019. г. Приступљено 26. 04. 2012.
- ^ Wood, R D (1996). „DNA Repair in Eukaryotes”. Annual Review of Biochemistry. 65: 135—167. doi:10.1146/annurev.bi.65.070196.001031. Архивирано из оригинала 16. 03. 2022. г. Приступљено 26. 04. 2012.
- ^ Weiss, Bernard & Richardson, Charles C. (1967). „Enzymatic breakage and joining of deoxyribonucleic acid, I. Repair of single-strand breaks in DNA by an enzyme system from Escherichia coli infected with T4 bacteriophage” (pdf). PNAS. 57: 1021—1028. PMID 5340583.
- ^ Burgers, Peter M. J. (1998). „Eukaryotic DNA polymerases in DNA replication and DNA repair”. Chromosoma. 107 (4): 218—227. doi:10.1007/s004120050300.
- ^ MacNeill, Stuart A (2001). „DNA replication: Partners in the Okazaki two-step”. Current Biology. 11 (20): R842—R844. doi:10.1016/S0960-9822(01)00500-0.
- ^ Sakabe K, Okazaki R (1966). „A unique property of the replicating region of chromosomal DNA”. Biochimica et Biophysica Acta. 129 (3): 651—54. PMID 5337977.
- ^ Beard, William A; Wilson, Samuel H. (2000). „Structural design of a eukaryotic DNA repair polymerase: DNA polymerase β”. Mutation Research/DNA Repair. 460 (3–4): 231—244. doi:10.1016/S0921-8777(00)00029-X.
- ^ Sawaya, MR; Pelletier, H; Kumar, A; Wilson, SH; Kraut, J (1994). „Crystal structure of rat DNA polymerase beta: evidence for a common polymerase mechanism”. Science. 264 (5167): 1930—1935. doi:10.1126/science.7516581.
- ^ Fujikawa, Norie; Kurumizaka, Hitoshi; Nureki, Osamu; Terada, Takaho; Shirouzu, Mikako; Katayama, Tsutomu; Yokoyama, Shigeyuki (2003). „Structural basis of replication origin recognition by the DnaA protein”. Nucl. Acids Res. 31 (8): 2077—2086. doi:10.1093/nar/gkg309.
- ^ Jacq, Annick; Kohiyama, Masamichi (1980). „A DNA-Binding Protein Specific for the Early Replicated Region of the Chromosome Obtained from Escherichia coli Membrane Fractions”. European Journal of Biochemistry. 105 (1): 25—31. doi:10.1111/j.1432-1033.1980.tb04470.x.
- ^ а б в Slonczewski & Richter 2010, стр. 301–311
- ^ Uwe Langer†; Richter, Stefan; Roth, Angelika; Weigel, Christoph; Messer, Walter (1996). „A comprehensive set of DnaA-box mutations in the replication origin, oriC, of Escherichia coli”. Molecular Microbiology. 21 (2): 301—311. doi:10.1046/j.1365-2958.1996.6481362.x.
- ^ Bramhill, D; Kornberg, A (1988). „A model for initiation at origins of DNA replication” (PDF). Cell. 54: 915—918. Архивирано из оригинала (PDF) 10. 11. 2013. г. Приступљено 26. 4. 2012.
- ^ Mizraji, E. (1986). „Energy storage during DNA girase activity”. Journal of Theoretical Biology. 120 (1): 63—71. doi:10.1016/S0022-5193(86)80017-0.
- ^ Anselmi, C.; Bocchinfuso, G.; Santis, P. De; Fuà, M.; Scipioni, A. & Savino, M. (1998). „Statistical Thermodynamic Approach for Evaluating the Writhe Transformations in Circular DNAs”. J. Phys. Chem. B. 102 (29): 5704—5714. doi:10.1021/jp981552v.
- ^ LeBowitz, J H & McMacken, R (1986). „The Escherichia coli dnaB replication protein is a DNA helicase”. The Journal of Biological Chemistry. 261: 4738—4748.
- ^ San Martin MC, Stamford NP, Dammerova N, Dixon NE, Carazo JM (1995). „A structural model for the Escherichia coli DnaB helicase based on electron microscopy data”. Journal of Structural Biology. 114 (3): 167—76. doi:10.1006/jsbi.1995.1016.
- ^ Fay, Philip J.; Johansonn, Kyung Oh; McHenryn, Charles S. & Bambara, Robert A. (1981). „Size Classes of Products Synthesized Processively by DNA Polymerase III and DNA Polymerase III Holoenzyme of Escherichia coli”. The Journal of Biological Chemistry. 256: 976—983.
- ^ Keck, James L.; Roche, Daniel D.; Lynch, A. Simon; Berger, James M. (2000). „Structure of the RNA Polymerase Domain of E. coli Primase”. Science. 287 (5462): 2482—2486. doi:10.1126/science.287.5462.2482.
- ^ Olson, M. W.; Dallmann, H. G.; McHenry, C. S. (1995). „DnaX complex of Escherichia coli DNA polymerase III holoenzyme. The chi psi complex functions by increasing the affinity of tau and gamma for delta.delta' to a physiologically relevant range”. The Journal of Biological Chemistry. 270 (49): 29570—29577. PMID 7494000.
- ^ Kelman, Z.; O'Donnell, M. (1995). „Dna Polymerase III Holoenzyme: Structure and Function of a Chromosomal Replicating Machine”. Annual Review of Biochemistry. 64: 171. doi:10.1146/annurev.bi.64.070195.001131.
- ^ Adams DE, Shekhtman EM, Zechiedrich EL, Schmid MB, Cozzarelli NR (1992). „The role of topoisomerase IV in partitioning bacterial replicons and the structure of catenated intermediates in DNA replication”. Cell. 71 (2): 277—88. doi:10.1016/0092-8674(92)90356-H.
- ^ Peng, H & Marians, K J (1993). „Escherichia coli topoisomerase IV. Purification, characterization, subunit structure, and subunit interactions”. The Journal of Biological Chemistry. 268: 24481—24490.
- ^ Martin, Robert G.; J.Heinrich Matthaei; Jones, Oliver W.; Nirenberg, Marshall W. (1961). „Ribonucleotide composition of the genetic code”. Biochemical and Biophysical Research Communications. 6 (6): 410—414. doi:10.1016/0006-291X(62)90365-0.
- ^ Nakamoto T (2009). „Evolution and the universality of the mechanism of initiation of protein synthesis”. Gene. 432 (1–2): 1—6. PMID 19056476. doi:10.1016/j.gene.2008.11.001.
- ^ Iupac-Iub Comm. On Biochem. Nomencl (1970). „Abbreviations and symbols for nucleic acids, polynucleotides, and their constituents”. Biochemistry. 9: 4022—4027. doi:10.1021/bi00822a023.
- ^ Crick FH, Orgel LE (1973). „Directed panspermia”. Icarus. 19 (3). Bibcode:1973Icar...19..341C. doi:10.1016/0019-1035(73)90110-3. „It is a little surprising that organisms with somewhat different codes do not coexist.” (p. 344) | url = http://www.talkorigins.org/faqs/comdesc/section1.html Further discussion)
- ^ а б в Elzanowski A, Ostell J (7. 4. 2008). „The Genetic Codes”. National Center for Biotechnology Information (NCBI). Приступљено 10. 3. 2010.
- ^ Jukes TH, Osawa S (1990). „The genetic code in mitochondria and chloroplasts”. Experientia. 46 (11–12): 1117—26,341—6. PMID 2253709. doi:10.1007/BF01936921.
- ^ Santos M.A.; Tuite M.F. (1995). „The CUG codon is decoded in vivo as serine and not leucine in Candida albicans”. Nucleic Acids Research. 23 (9): 1481—6. PMC 306886
 . PMID 7784200. doi:10.1093/nar/23.9.1481.
. PMID 7784200. doi:10.1093/nar/23.9.1481.
- ^ Butler G, Rasmussen MD, Lin MF, Santos MA, Sakthikumar S, Munro CA, Rheinbay E, Grabherr M, Forche A, Reedy JL, Agrafioti I, Arnaud MB, Bates S, Brown AJ, Brunke S, Costanzo MC, Fitzpatrick DA, de Groot PW, Harris D, Hoyer LL, Hube B, Klis FM, Kodira C, Lennard N, Logue ME, Martin R, Neiman AM, Nikolaou E, Quail MA, Quinn J, Santos MC, Schmitzberger FF, Sherlock G, Shah P, Silverstein KA, Skrzypek MS, Soll D, Staggs R, Stansfield I, Stumpf MP, Sudbery PE, Srikantha T, Zeng Q, Berman J, Berriman M, Heitman J, Gow NA, Lorenz MC, Birren BW, Kellis M, Cuomo CA (2009). „Evolution of pathogenicity and sexual reproduction in eight Candida genomes”. Nature. 459 (7247): 657—62. PMC 2834264
 . PMID 19465905. doi:10.1038/nature08064.
. PMID 19465905. doi:10.1038/nature08064.
- ^ Beamer, Lesa J.; Pabo, Carl O. (1992). „Refined1.8Åcrystalstructure of the λ repressor-operatorcomplex”. Journal of Molecular Biology. 227 (1): 177—196. doi:10.1016/0022-2836(92)90690-L.
- ^ Sandman K, Pereira S, Reeve J (1998). „Diversity of prokaryotic chromosomal proteins and the origin of the nucleosome”. Cell Mol Life Sci. 54 (12): 1350—64. PMID 9893710. doi:10.1007/s000180050259.
- ^ Dame, RT (2005). „The role of nucleoid-associated proteins in the organization and compaction of bacterial chromatin”. Mol. Microbiol. 56 (4): 858—70. PMID 15853876. doi:10.1111/j.1365-2958.2005.04598.x.
- ^ Jenuwein T, Allis C (2001). „Translating the histone code”. Science. 293 (5532): 1074—80. PMID 11498575. doi:10.1126/science.1063127.
- ^ Ito, T. (2003). „Nucleosome assembly and remodelling”. Curr Top Microbiol Immunol. Current Topics in Microbiology and Immunology. 274: 1—22. ISBN 978-3-540-44208-0. PMID 12596902. doi:10.1007/978-3-642-55747-7_1.
- ^ Thomas, J. (2001). „HMG1 and 2: architectural DNA-binding proteins”. Biochem Soc Trans. 29 (Pt 4): 395—401. PMID 11497996. doi:10.1042/BST0290395.
- ^ Grosschedl R, Giese K, Pagel J (1994). „HMG domain proteins: architectural elements in the assembly of nucleoprotein structures”. Trends Genet. 10 (3): 94—100. PMID 8178371. doi:10.1016/0168-9525(94)90232-1.
- ^ Iftode C, Daniely Y, Borowiec J (1999). „Replication protein A (RPA): the eukaryotic SSB”. Crit Rev Biochem Mol Biol. 34 (3): 141—80. PMID 10473346. doi:10.1080/10409239991209255.
- ^ Myers L, Kornberg R (2000). „Mediator of transcriptional regulation”. Annu Rev Biochem. 69: 729—49. PMID 10966474. doi:10.1146/annurev.biochem.69.1.729. Архивирано из оригинала 24. 05. 2016. г. Приступљено 28. 04. 2012.
- ^ Spiegelman B, Heinrich R (2004). „Biological control through regulated transcriptional coactivators”. Cell. 119 (2): 157—67. PMID 15479634. doi:10.1016/j.cell.2004.09.037.
- ^ Li Z, Van Calcar S, Qu C, Cavenee W, Zhang M, Ren B (2003). „A global transcriptional regulatory role for c-Myc in Burkitt's lymphoma cells”. Proc Natl Acad Sci USA. 100 (14): 8164—9. Bibcode:2003PNAS..100.8164L. PMC 166200
 . PMID 12808131. doi:10.1073/pnas.1332764100. Архивирано из оригинала 22. 10. 2012. г. Приступљено 28. 04. 2012.
. PMID 12808131. doi:10.1073/pnas.1332764100. Архивирано из оригинала 22. 10. 2012. г. Приступљено 28. 04. 2012.
- ^ Roberts, R. J.; Kenneth, Murray (1976). „Restriction endonucleases”. CRC Crit. Rev. Biochem. 4 (2): 123—64. PMID 795607. doi:10.3109/10409237609105456.
- ^ Kessler C, Manta V (1990). „Specificity of restriction endonucleases and DNA modification methyltransferases a review (Edition 3)”. Gene. 92 (1–2): 1—248. PMID 2172084. doi:10.1016/0378-1119(90)90486-B.
- ^ Pingoud A, Alves J, Geiger R (1993). „Chapter 8: Restriction Enzymes”. Ур.: Burrell M. Enzymes of Molecular Biology. Methods of Molecular Biology. 16. Totowa, NJ: Humana Press. стр. 107—200. ISBN 978-0-89603-234-7.
- ^ Kostrewa 1995, стр. 683–696.
- ^ Mukherjee, Devi; Fritz, David T.; Kilpatrick, Walter J.; Gao, Min & Wilusz, Jeffrey (2004). „Analysis of RNA Exonucleolytic Activities in Cellular Extracts”. Springer protocols. 257: 193—211. ISBN 978-1-59259-750-5. PMID 14770007. doi:10.1385/1-59259-750-5:193.
- ^ Frischmeyer, Pamela A.; et al. (2002). „An mRNA Surveillance Mechanism That Eliminates Transcripts Lacking Termination Codons”. Science. 295 (5563): 2258—61. PMID 11910109. doi:10.1126/science.1067338.
- ^ Bickle T, Krüger D (1993). „Biology of DNA restriction”. Microbiol Rev. 57 (2): 434—50. PMC 372918
 . PMID 8336674.
. PMID 8336674.
- ^ Sayers, J. R. (1994). „Computer aided identification of a potential 5'-3' exonuclease gene encoded by Escherichia coli”. J Theor Biol. 170 (4): 415—421. PMID 7996866.
- ^ Liu Y, Kao HI, Bambara RA (2004). „Flap endonuclease 1: a central component of DNA metabolism”. Annu. Rev. Biochem. 73: 589—615. PMID 15189154.
- ^ Ceska TA, Sayers JR (1998). „Structure-specific DNA cleavage by 5' nucleases”. Trends Biochem Sci. 23 (9): 331—6.
- ^ Helling, Robert B.; Goodman, Howard M. & Boyer, Herbert W. (1974). „Analysis of Endonuclease R·EcoRI Fragments of DNA from Lambdoid Bacteriophages and Other Viruses by Agarose-Gel Electrophoresis”. J. Virol. 14 (5): 1235—1244. Архивирано из оригинала 11. 11. 2014. г. Приступљено 29. 04. 2012.
- ^ Dugaiczyk, A; Boyer, H W; Goodman, H M. (1975). „Ligation of EcoRI endonuclease-generated DNA fragments into linear and circular structures”. Journal of Molecular Biology. 96 (1): 171—184.
- ^ а б Doherty A, Suh S (2000). „Structural and mechanistic conservation in DNA ligases”. Nucleic Acids Res. 28 (21): 4051—8. PMC 113121
 . PMID 11058099. doi:10.1093/nar/28.21.4051.
. PMID 11058099. doi:10.1093/nar/28.21.4051.
- ^ Pascal, John M.; Patrick J. O'Brien; Tomkinson, Alan E. & Ellenberger, Tom (2004). „Human DNA ligase I completely encircles and partially unwinds nicked DNA”. Nature. 432: 473—478. doi:10.1038/nature03082.
- ^ Wilkinson, Adam; Day, Jonathan; Bowater, Richard (2001). „Bacterial DNA ligases”. Molecular Microbiology. 40 (6): 1241—1248.
- ^ R., Lehnman I. (1974). „DNA Ligase: Structure, Mechanism, and Function”. Science. 186 (4166): 790—7. PMID 4377758. doi:10.1126/science.186.4166.790.
- ^ Lee, Jae Young; Chang, Changsoo; Song, Hyun Kyu; Moon, Jinho; Yang, Jin Kuk; Hyun-Kyu Kim; Suk-Tae Kwon & Suh, Se Won (2000). „Crystal structure of NAD+-dependent DNA ligase: modular architecture and functional implications”. The EMBO Journal. 19: 1119—1129. doi:10.1093/emboj/19.5.1119.
- ^ Singleton, Martin R; Håkansson, Kjell; Timson, David J; Wigley, Dale B. (1999). „Structure of the adenylation domain of an NAD+-dependent DNA ligase”. Structure. 7 (1): 35—42. doi:10.1016/S0969-2126(99)80007-0.
- ^ Zimmerman, S B & Pheiffer, B H. (1983). „Macromolecular crowding allows blunt-end ligation by DNA ligases from rat liver or Escherichia coli”. PNAS. 80 (19): 5852—5856. Архивирано из оригинала 24. 09. 2015. г. Приступљено 29. 04. 2012.
- ^ Barringera, Kevin J.; Orgelb, Leslie; Wahlb, Geoff; Gingeras, Thomas R. (1990). „Blunt-end and single-strand ligations by Escherichia coliligase: influence on an in vitro amplication scheme”. Gene. 89 (1): 117—122. doi:10.1016/0378-1119(90)90213-B.
- ^ Tomkinson, Alan E.; Levin, David S. (1997). „Mammalian DNA ligases”. BioEssays. 19 (10): 893—901. doi:10.1002/bies.950191009.
- ^ а б Redinbo, Matthew R.; Stewart, Lance; Kuhn, Peter; Champoux, James J. & Wim G. J. Ho (1998). „Crystal Structures of Human Topoisomerase I in Covalent and Noncovalent Complexes with DNA”. Science. 279 (5356): 1504—1513. doi:10.1126/science.279.5356.1504.
- ^ Schoeffler A, Berger J (2005). „Recent advances in understanding structure-function relationships in the type II topoisomerase mechanism”. Biochem Soc Trans. 33 (Pt 6): 1465—70. PMID 16246147. doi:10.1042/BST20051465.
- ^ Wang, J. C. (1991). „DNA topoisomerases: why so many?”. J. Biol. Chem. 266 (11): 6659—62. PMID 1849888. Архивирано из оригинала 18. 09. 2019. г. Приступљено 29. 04. 2012.
- ^ Chernavskii 2001
- ^ Tuteja N, Tuteja R (2004). „Unraveling DNA helicases. Motif, structure, mechanism and function”. Eur J Biochem. 271 (10): 1849—63. PMID 15128295. doi:10.1111/j.1432-1033.2004.04094.x.
- ^ а б Hall1, Mark C.; Matson, Steven W. (1999). „Helicase motifs: the engine that powers DNA unwinding”. Molecular Microbiology. 34 (5): 867—877. doi:10.1046/j.1365-2958.1999.01659.x.
- ^ Rafferty, John B.; Sedelnikova, Svetlana E.; Hargreaves, David; Artymiuk, Peter J.; Baker, Patrick J.; Sharples, Gary J.; Mahdi, Akeel A.; Lloyd, Robert G.; Rice, David W. (1996). „Crystal Structure of DNA Recombination Protein RuvA and a Model for Its Binding to the Holliday Junction”. Science. 274 (5286): 415—421. doi:10.1126/science.274.5286.415.
- ^ Lionnet T, Spiering MM, Benkovic SJ, Bensimon D, Croquette V (2007). „Real-time observation of bacteriophage T4 gp41 helicase reveals an unwinding mechanism”. PNAS. 104 (50): 19790—19795. PMC 2148377
 . PMID 18077411. doi:10.1073/pnas.0709793104. Архивирано из оригинала 06. 12. 2014. г. Приступљено 29. 04. 2012.
. PMID 18077411. doi:10.1073/pnas.0709793104. Архивирано из оригинала 06. 12. 2014. г. Приступљено 29. 04. 2012.
- ^ Johnson DS, Bai L, Smith BY, Patel SS, Wang MD (2007). „Single-molecule studies reveal dynamics of DNA unwinding by the ring-shaped t7 helicase”. Cell. 129 (7): 1299—309. PMC 2699903
 . PMID 17604719. doi:10.1016/j.cell.2007.04.038.
. PMID 17604719. doi:10.1016/j.cell.2007.04.038.
- ^ а б „Researchers solve mystery of how DNA strands separate”. 29. 5. 2012. Приступљено 29. 5. 2012.
- ^ Garcia JA, Kaariainen L, Gomez de cedron M, Ehsani N, Mikkola ML (1999). „RNA helicase activity of Semliki Forest virus replicase protein NSP2”. FEBS Lett. 448 (1): 19—22. PMID 10217401. doi:10.1016/S0014-5793(99)00321-X.
- ^ Dumont, S.; Cheng, W; Serebrov, V; Beran, RK; I, Tinoco Jr; Pylr, AM; Bustamante, Carlos (2006). „RNA Translocation and Unwinding Mechanism of HCV NS3 Helicase and its Coordination by ATP”. Nature. 439: 105—108.
- ^ Iyer, Lakshminarayan M.; Aravind, L. & Koonin, Eugene V. (2001). „Common origin of four diverse families of large eukaryotic DNA viruses”. J. Virol. 75 (23): 11720—34. PMC 114758
 . PMID 11689653. doi:10.1128/JVI.75.23.11720-11734.2001. Архивирано из оригинала 14. 04. 2017. г. Приступљено 29. 04. 2012.
. PMID 11689653. doi:10.1128/JVI.75.23.11720-11734.2001. Архивирано из оригинала 14. 04. 2017. г. Приступљено 29. 04. 2012.
- ^ Fan L, Arvai A, Cooper P, Iwai S, Hanaoka F, Tainer J (2006). „Conserved XPB core structure and motifs for DNA unwinding: implications for pathway selection of transcription or excision repair”. Mol Cell. 22 (1): 27—37. PMID 16600867. doi:10.1016/j.molcel.2006.02.017.
- ^ Duell, Eric J.; Wiencke, John K.; Tsun-Jen Cheng; Varkonyi, Andrea; Zuo, Zheng Fa; Tara Devi S. Ashok; Mark, Eugene J.; Wain, John C.; Christiani, David C. & Karl T. Kelsey (2000). „Polymorphisms in the DNA repair genes XRCC1 and ERCC2 and biomarkers of DNA damage in human blood mononuclear cells”. Carcinogenesis. 21 (5): 965—971. doi:10.1093/carcin/21.5.965.
- ^ Ozgenc A, Loeb LA (2005). „Current advances in unraveling the function of the Werner syndrome protein”. Mutation research. 577 (1–2): 237—51. PMID 15946710. doi:10.1016/j.mrfmmm.2005.03.020.
- ^ Gray MD, Shen JC, Kamath-Loeb AS, Blank A, Sopher BL, Martin GM, Oshima J, Loeb LA (1997). „The Werner syndrome protein is a DNA helicase”. Nature Genetics. 17 (1): 100—3. PMID 9288107. doi:10.1038/ng0997-100.
- ^ Meyer PA, Ye P, Zhang M, Suh MH, Fu J (2006). „Phasing RNA polymerase II using intrinsically bound Zn atoms: an updated structural model”. Structure. 14 (6): 973—82. PMID 16765890. doi:10.1016/j.str.2006.04.003.
- ^ Joyce C, Steitz T (1995). „Polymerase structures and function: variations on a theme?”. J Bacteriol. 177 (22): 6321—9. PMC 177480
 . PMID 7592405.
. PMID 7592405.
- ^ Hubscher U, Maga G, Spadari S (2002). „Eukaryotic DNA polymerases”. Annu Rev Biochem. 71: 133—63. PMID 12045093. doi:10.1146/annurev.biochem.71.090501.150041.
- ^ Johnson A, O'Donnell M (2005). „Cellular DNA replicases: components and dynamics at the replication fork”. Annu Rev Biochem. 74: 283—315. PMID 15952889. doi:10.1146/annurev.biochem.73.011303.073859. Архивирано из оригинала 07. 02. 2019. г. Приступљено 30. 04. 2012.
- ^ Tarrago-Litvak L, Andréola M, Nevinsky G, Sarih-Cottin L, Litvak S (1994). „The reverse transcriptase of HIV-1: from enzymology to therapeutic intervention”. FASEB J. 8 (8): 497—503. PMID 7514143.
- ^ Martinez, E. (2002). „Multi-protein complexes in eukaryotic gene transcription”. Plant Mol Biol. 50 (6): 925—47. PMID 12516863. doi:10.1023/A:1021258713850.
- ^ Kornberg, R. (1999). „Eukaryotic transcriptional control”. Trends in Cell Biology. 9 (12): M46. PMID 10611681. doi:10.1016/S0962-8924(99)01679-7.
- ^ Sims RJ 3rd, Mandal SS, Reinberg D (2004). „Recent highlights of RNA-polymerase-II-mediated transcription”. Current opinion in cell biology. 16 (3): 263—271. ISSN 0955-0674. PMID 15145350. doi:10.1016/j.ceb.2004.04.004.
- ^ Joyce, G. (2002). „The antiquity of RNA-based evolution”. Nature. 418 (6894): 214—21. PMID 12110897. doi:10.1038/418214a.
- ^ Orgel, L. (2004). „Prebiotic chemistry and the origin of the RNA world”. Crit Rev Biochem Mol Biol. 39 (2): 99—123. PMID 15217990. doi:10.1080/10409230490460765.
- ^ Davenport, R. (2001). „Ribozymes. Making copies in the RNA world”. Science. 292 (5520): 1278. PMID 11360970. doi:10.1126/science.292.5520.1278a.
- ^ Szathmáry, E. (1992). „What is the optimum size for the genetic alphabet?”. Proc Natl Acad Sci USA. 89 (7): 2614—8. Bibcode:1992PNAS...89.2614S. PMC 48712
 . PMID 1372984. doi:10.1073/pnas.89.7.2614. Архивирано из оригинала 24. 09. 2015. г. Приступљено 30. 04. 2012.
. PMID 1372984. doi:10.1073/pnas.89.7.2614. Архивирано из оригинала 24. 09. 2015. г. Приступљено 30. 04. 2012.
- ^ Lindahl, T. (1993). „Instability and decay of the primary structure of DNA”. Nature. 362 (6422): 709—15. Bibcode:1993Natur.362..709L. PMID 8469282. doi:10.1038/362709a0.
- ^ Vreeland R, Rosenzweig W, Powers D (2000). „Isolation of a 250 million-year-old halotolerant bacterium from a primary salt crystal”. Nature. 407 (6806): 897—900. PMID 11057666. doi:10.1038/35038060.
- ^ Hebsgaard M, Phillips M, Willerslev E (2005). „Geologically ancient DNA: fact or artefact?”. Trends Microbiol. 13 (5): 212—20. PMID 15866038. doi:10.1016/j.tim.2005.03.010.
- ^ Nickle D, Learn G, Rain M, Mullins J, Mittler J (2002). „Curiously modern DNA for a „250 million-year-old“ bacterium”. J Mol Evol. 54 (1): 134—7. PMID 11734907. doi:10.1007/s00239-001-0025-x.
- ^ Callahan, M. P.; Smith, K. E.; Cleaves, H. J.; Ruzica, J.; Stern, J. C.; Glavin, D. P.; House, C. H.; Dworkin, J. P. (2011). „Carbonaceous meteorites contain a wide range of extraterrestrial nucleobases”. PNAS. doi:10.1073/pnas.1106493108. Архивирано из оригинала 18. 09. 2011. г. Приступљено 30. 4. 2012.
- ^ John, Steigerwald (2011). „NASA Researchers: DNA Building Blocks Can Be Made in Space”. NASA. Архивирано из оригинала 11. 05. 2020. г. Приступљено 30. 4. 2011.
- ^ Staff, ScienceDaily (2011). „DNA Building Blocks Can Be Made in Space, NASA Evidence Suggests”. ScienceDaily. Приступљено 30. 4. 2012.
- ^ Goff SP, Berg P (1976). „Construction of hybrid viruses containing SV40 and lambda phage DNA segments and their propagation in cultured monkey cells”. Cell. 9 (4 PT 2): 695—705. PMID 189942. doi:10.1016/0092-8674(76)90133-1.
- ^ Kim, YG; Cha, J.; Chandrasegaran, S. (1996). „Hybrid restriction enzymes: zinc finger fusions to Fok I cleavage domain”. Proc Natl Acad Sci USA. 93 (3): 1156—60. PMC 40048
 . PMID 8577732. doi:10.1073/pnas.93.3.1156. Архивирано из оригинала 28. 01. 2015. г. Приступљено 01. 05. 2012.
. PMID 8577732. doi:10.1073/pnas.93.3.1156. Архивирано из оригинала 28. 01. 2015. г. Приступљено 01. 05. 2012.
- ^ Edgell, D. R. (2009). „Selfish DNA: homing endonucleases find a home”. Curr Biol. 19 (3): R115—R117. PMID 19211047. doi:10.1016/j.cub.2008.12.019.
- ^ Houdebine, L. (2007). „Transgenic animal models in biomedical research”. Methods Mol Biol. 360: 163—202. ISBN 978-1-59745-165-9. PMID 17172731. doi:10.1385/1-59745-165-7:163.
- ^ Daniell H, Dhingra A (2002). „Multigene engineering: dawn of an exciting new era in biotechnology”. Curr Opin Biotechnol. 13 (2): 136—41. PMID 11950565. doi:10.1016/S0958-1669(02)00297-5.
- ^ Job, D. (2002). „Plant biotechnology in agriculture”. Biochimie. 84 (11): 1105—10. PMID 12595138. doi:10.1016/S0300-9084(02)00013-5.
- ^ Lindsey, K.; Jones, M. G. K. (1989). Plant biotechnology in agriculture. ISBN 978-0-335-15818-8. Архивирано из оригинала 10. 11. 2013. г. Приступљено 01. 05. 2012.
- ^ Adiguzel et al. 2009, стр. 645–651.
- ^ „Use of DNA in Identification”. Accessexcellence.org. Архивирано из оригинала 10. 5. 2015. г. Приступљено 1. 5. 2012.
- ^ Jeffreys, Alec J.; Wilson, Victoria; Neumann, Rita & Keyte, John (1988). „Amplification of human minisatellites by the polymerase chain reaction: towards DNA fingerprinting of single cells”. Nucl. Acids Res. 16 (23): 10953—10971. doi:10.1093/nar/16.23.10953.
- ^ Collins A, Morton N (1994). „Likelihood ratios for DNA identification”. Proc Natl Acad Sci USA. 91 (13): 6007—11. Bibcode:1994PNAS...91.6007C. PMC 44126
 . PMID 8016106. doi:10.1073/pnas.91.13.6007. Архивирано из оригинала 24. 09. 2015. г. Приступљено 01. 05. 2012.
. PMID 8016106. doi:10.1073/pnas.91.13.6007. Архивирано из оригинала 24. 09. 2015. г. Приступљено 01. 05. 2012.
- ^ Weir B, Triggs C, Starling L, Stowell L, Walsh K, Buckleton J (1997). „Interpreting DNA mixtures” (PDF). J Forensic Sci. 42 (2): 213—22. PMID 9068179.
- ^ Evett, Ian W.; Buffery, Cecilia; Willott, Geoffrey; Stoney, David (1991). „A guide to interpreting single locus profiles of DNAmixtures in forensic cases”. Journal of the Forensic Science Society. 31 (1): 41—47. doi:10.1016/S0015-7368(91)73116-2.
- ^ Jeffreys A, Wilson V, Thein S (1985). „Individual-specific 'fingerprints' of human DNA” (PDF). Nature. 316 (6023): 76—9. Bibcode:1985Natur.316...76J. PMID 2989708. doi:10.1038/316076a0.
- ^ Service, Forensic Science. „First murder conviction on DNA evidence also clears the prime suspect”. Архивирано из оригинала 14. 12. 2006. г. Приступљено 1. 5. 2012.
- ^ Foreman, L. A.; Champod, C.; Evett, I. W.; Lambert, J. A.; Pope, S. (2003). „Interpreting DNA Evidence: A Review”. International Statistical Review. 71 (3): 473—495. doi:10.1111/j.1751-5823.2003.tb00207.x.
- ^ „DNA Identification in Mass Fatality Incidents”. National Institute of Justice. 2006. Архивирано из оригинала 12. 11. 2006. г. Приступљено 1. 5. 2012.
- ^ Gornik, Ivan; Marcikic, Mladen; Kubat, Milovan; Primorac, Dragan & Lauc, Gordan (2002). „The identification of war victims by reverse paternity is associated with significant risks of false inclusion”. International Journal of Legal Medicine. 116 (5): 255—257. doi:10.1007/s00414-001-0280-9.
- ^ Hogeweg, P. (1978). „Simulating the growth of cellular forms”. Simulation. 31 (3): 90—96. doi:10.1177/003754977803100305.
- ^ а б Hogeweg, P. (2011). Searls David B., ур. „The Roots of Bioinformatics in Theoretical Biology”. PLoS Computational Biology. 7 (3): e1002021. Bibcode:2011PLSCB...7E0020H. PMC 3068925
 . PMID 21483479. doi:10.1371/journal.pcbi.1002021.
. PMID 21483479. doi:10.1371/journal.pcbi.1002021.
- ^ Pierre & Soren 2001.
- ^ Gusfield 1997.
- ^ Sjölander, K. (2004). „Phylogenomic inference of protein molecular function: advances and challenges”. Bioinformatics. 20 (2): 170—9. PMID 14734307. doi:10.1093/bioinformatics/bth021.
- ^ Mount 2004
- ^ Attwood T.K.; Gisel, A.; Eriksson N-E. & Bongcam-Rudloff E. (2011). „Concepts, Historical Milestones and the Central Place of Bioinformatics in Modern Biology: A European Perspective”. Bioinformatics — Trends and Methodologies. InTech. Архивирано из оригинала 25. 01. 2012. г. Приступљено 4. 5. 2012.
- ^ Strong, Michael (2004). „Protein Nanomachines”. PLoS Biol. 2 (3): e73. doi:10.1371/journal.pbio.0020073.
- ^ Rothemund, PW (2006). „Folding DNA to create nanoscale shapes and patterns”. Nature. 440 (7082): 297—302. Bibcode:2006Natur.440..297R. PMID 16541064. doi:10.1038/nature04586.
- ^ Andersen ES, Dong M, Nielsen MM (2009). „Self-assembly of a nanoscale DNA box with a controllable lid”. Nature. 459 (7243): 73—6. Bibcode:2009Natur.459...73A. PMID 19424153. doi:10.1038/nature07971.
- ^ Ishitsuka Y, Ha T (2009). „DNA nanotechnology: a nanomachine goes live”. Nat Nanotechnol. 4 (5): 281—2. Bibcode:2009NatNa...4..281I. PMID 19421208. doi:10.1038/nnano.2009.101.
- ^ Aldaye FA, Palmer AL, Sleiman HF (2008). „Assembling materials with DNA as the guide”. Science. 321 (5897): 1795—9. Bibcode:2008Sci...321.1795A. PMID 18818351. doi:10.1126/science.1154533.
- ^ а б Zhang, David Yu & Seelig, Georg (2011). „Dynamic DNA nanotechnology using strand-displacement reactions”. Nature Chemistry. 3: 103—113. doi:10.1038/nchem.957.
- ^ Seeman Nadrian C. (2007). „An overview of structural DNA nanotechnology”. Molecular Biotechnology. 37 (3): 246—257. PMID 17952671. doi:10.1007/s12033-007-0059-4.
- ^ Chengde, Mao (2004). „The emergence of complexity: lessons from DNA”. PLoS Biology. 2 (12): 2036—2038. PMC 535573
 . PMID 15597116. doi:10.1371/journal.pbio.0020431.
. PMID 15597116. doi:10.1371/journal.pbio.0020431.
- ^ Seeman Nadrian C. (2010). „Nanomaterials based on DNA”. Annual Review of Biochemistry. 79: 65—87. PMID 20222824. doi:10.1146/annurev-biochem-060308-102244. Архивирано из оригинала 23. 03. 2011. г. Приступљено 02. 05. 2012.
- ^ Seeman Nadrian C. (2004). „Nanotechnology and the double helix”. Scientific American. 290 (6): 64—75. PMID 15195395. doi:10.1038/scientificamerican0604-64.
- ^ Lu, Yi; Liu, Juewen (2006). „Functional DNA nanotechnology: Emerging applications of DNAzymes and aptamers”. Current Opinion in Biotechnology. 17 (6): 580—588. PMID 17056247. doi:10.1016/j.copbio.2006.10.004.
- ^ а б Pinheiro, Vitor B.; Taylor, Alexander I.; Cozens, Christopher; Abramov, Mikhail; Renders, Marleen; Zhang, Su; Chaput, John C.; Wengel, Jesper; Sew-Yeu Peak-Chew; Stephen H. McLaughlin; Piet Herdewijn; Philipp Holliger (2012). „Synthetic Genetic Polymers Capable of Heredity and Evolution”. Science. 336 (6079): 341—344. doi:10.1126/science.1217622.
- ^ Joyce, G. F.; Schwartz, A. W.; Miller, S. L.; Orgel, L. E. (1987). „The case for an ancestral genetic system involving simple analogues of the nucleotides” (PDF). Proc. Natl. Acad. Sci. U.S.A. 84: 4398—4402. Архивирано из оригинала (PDF) 10. 01. 2017. г. Приступљено 06. 05. 2012.
- ^ K.-U. Schöning; Scholz, P.; Guntha, S.; Wu, X.; Krishnamurthy, R. & Eschenmoser, A. (2000). „Chemical Etiology of Nucleic Acid Structure: The α-Threofuranosyl-(3'→2') Oligonucleotide System”. Science. 290 (5495): 1347—1351. doi:10.1126/science.290.5495.1347.
- ^ Lilu, Zhang; Adam, Peritz; Eric, Meggers (2005). „A simple glycol nucleic acid”. J. Am. Chem. Soc. 127 (12): 4174—5. PMID 15783191. doi:10.1021/ja042564z.
- ^ Yu, Hanyang; Zhang, Su; Chaput, John C. (2012). „Darwinian evolution of an alternative genetic system provides support for TNA as an RNA progenitor”. Nature Chemistry. 4: 183—187. doi:10.1038/nchem.1241.
- ^ Wray, G.; Martindale, Mark Q. (2002). „Dating branches on the Tree of Life using DNA” (PDF). Genome Biol. 3 (1): REVIEWS0001. PMC 150454
 . PMID 11806830. doi:10.1046/j.1525-142X.1999.99010.x.
. PMID 11806830. doi:10.1046/j.1525-142X.1999.99010.x.
- ^ а б Brown, Kathryn (2002). „Tangled Roots? Genetics Meets Genealogy”. Science. 295 (5560): 1634—1635. doi:10.1126/science.295.5560.1634.
- ^ Iborra FJ, Kimura H, Cook PR (2004). „The functional organization of mitochondrial genomes in human cells”. BMC Biol. 2: 9. PMC 425603
 . PMID 15157274. doi:10.1186/1741-7007-2-9.
. PMID 15157274. doi:10.1186/1741-7007-2-9.
- ^ Walsh, Bruce (2001). „Estimating the Time to the Most Recent Common Ancestor for the Y chromosome or Mitochondrial DNA for a Pair of Individuals”. Genetics. 158 (2): 897—912.
- ^ Dahm, R. (2008). „Discovering DNA: Friedrich Miescher and the early years of nucleic acid research”. Hum. Genet. 122 (6): 565—81. PMID 17901982. doi:10.1007/s00439-007-0433-0.
- ^ Ellen, Jones Mary (1953). „Albrecht Kossel, A Biographical Sketch”. Yale Journal of Biology and Medicine. National Center for Biotechnology Information. 26 (1): 80—97. PMC 2599350
 . PMID 13103145.
. PMID 13103145.
- ^ Levene, P. (1919). „The structure of yeast nucleic acid”. J Biol Chem. 40 (2): 415—24.
- ^ Astbury, W. (1947). „Nucleic acid”. Symp. SOC. Exp. Biol. 1 (66).
- ^ Roger Lionel Poulter Adams; Knowler, John T.; Leader, David P. (1992). „The Biochemistry of the Nucleic Acids” (11th изд.). Springer. ISBN 978-0-412-39940-4.
- ^ Soyfer, Valery N. (2001). „The consequences of political dictatorship for Russian science”. Nature Reviews Genetics. 2 (9): 723—729. PMID 11533721. doi:10.1038/35088598.
- ^ Lorenz MG, Wackernagel W (1994). „Bacterial gene transfer by natural genetic transformation in the environment”. Microbiol. Rev. 58 (3): 563—602. PMC 372978
 . PMID 7968924.
. PMID 7968924.
- ^ Avery O, MacLeod C, McCarty M (1944). „Studies on the chemical nature of the substance inducing transformration of pneumococcal tzpes: Induction of transformation by a desoxyribonucleaic acid fraction isolated from pneumococcus type III”. J Exp Med. 79 (2): 137—158. PMC 2135445
 . PMID 19871359. doi:10.1084/jem.79.2.137.
. PMID 19871359. doi:10.1084/jem.79.2.137.
- ^ Hershey A, Chase M (1952). „Independent functions of viral protein and nucleic acid in growth of bacteriophage”. J Gen Physiol. 36 (1): 39—56. PMC 2147348
 . PMID 12981234. doi:10.1085/jgp.36.1.39.
. PMID 12981234. doi:10.1085/jgp.36.1.39.
- ^ The B-DNA X-ray pattern Архивирано на сајту Wayback Machine (10. јул 2009) on the right of this linked image was obtained by Rosalind Franklin and Raymond Gosling in May 1952 at high hydration levels of DNA and it has been labeled as „Photo 51”
- ^ Nature Archives Double Helix of DNA: 50 Years
- ^ „Original X-ray diffraction image”. Osulibrary.oregonstate.edu. Архивирано из оригинала 30. 01. 2009. г. Приступљено 3. 5. 2012.
- ^ The Nobel Prize in Physiology or Medicine 1962 Nobelprize .org Accessed 03 May 2012
- ^ Maddox, Brenda (2003). „The double helix and the 'wronged heroine'” (PDF). Nature. 421 (6921): 407—408. PMID 12540909. doi:10.1038/nature01399. Архивирано из оригинала (PDF) 17. 10. 2016. г. Приступљено 04. 05. 2012.
- ^ Crick, F.H.C. „On degenerate templates and the adaptor hypothesis”. Приступљено 3. 10. 2018. genome.wellcome.ac.uk (Lecture, 1955).}-
- ^ Meselson M, Stahl F (1958). „The replication of DNA in Escherichia coli”. Proc Natl Acad Sci USA. 44 (7): 671—82. Bibcode:1958PNAS...44..671M. PMC 528642
 . PMID 16590258. doi:10.1073/pnas.44.7.671. Архивирано из оригинала 04. 09. 2012. г. Приступљено 04. 05. 2012.
. PMID 16590258. doi:10.1073/pnas.44.7.671. Архивирано из оригинала 04. 09. 2012. г. Приступљено 04. 05. 2012.
- ^ -{The Nobel Prize in Physiology or Medicine 1968 Nobelprize.org Accessed 22 December 06
Литература[уреди | уреди извор]
- Berg, J.; Tymoczko, J.; Stryer, L. (2002). Biochemistry. W. H. Freeman and Company. ISBN 978-0-7167-4955-4.
- Gusfield, Dan (1997). Algorithms on Strings, Trees, and Sequences: Computer Science and Computational Biology. Cambridge University Press. ISBN 978-0-521-58519-4.
- James, William; Berger, Timothy; Elston, Dirk (2005). Andrews' Diseases of the Skin: Clinical Dermatology (10th изд.). Saunders. ISBN 978-0-7216-2921-6.
- Mount, D. M. (2004). Bioinformatics: Sequence and Genome Analysis (2 изд.). Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-712-9. OCLC 55106399.
- Lindsey, K.; Jones, M. G. K. (1989). Plant biotechnology in agriculture. ISBN 978-0-335-15818-8. Архивирано из оригинала 10. 11. 2013. г. Приступљено 01. 05. 2012.
- Chernavskii, A. V. (2001). „Linking coefficient”. Ур.: Hazewinkel, Michiel. Encyclopaedia of Mathematics. Springer. ISBN 978-1-55608-010-4.
- Pingoud A, Alves J, Geiger R (1993). „Chapter 8: Restriction Enzymes”. Ур.: Burrell M. Enzymes of Molecular Biology. Methods of Molecular Biology. 16. Totowa, NJ: Humana Press. стр. 107—200. ISBN 978-0-89603-234-7.
- Joan, Slonczewski; Foster, John Watkins (2010). Microbiology: An Evolving Science (Second изд.). New York: W. W. Norton & Company. ISBN 978-0-393-93447-2.
- Pollard T.D. (2007). Cell Biology. Philadelphia: Saunders. стр. 200—203. ISBN 978-1-4160-2255-8.
- Crick, Francis (1988). „Chapter 8: The genetic code”. What mad pursuit: a personal view of scientific discovery. New York: Basic Books. стр. 89—101. ISBN 978-0-465-09138-6.
- Richard, Deonier; Tavaré, Simon; Waterman, Michael (2005). Computational Genome Analysis: an introduction. Springer-Verlag. ISBN 978-0-387-98785-9.
- Sober, Elliott (2001). „The Two Faces of Fitness”. Ур.: R. Singh; D. Paul; C. Krimbas; J. Beatty. Thinking about Evolution: Historical, Philosophical, and Political Perspectives (PDF). Cambridge University Press. стр. 309—321. Архивирано из оригинала (PDF) 18. 07. 2011. г. Приступљено 22. 04. 2012.
- Carroll SB, Grenier J, Weatherbee SD (2005). From DNA to Diversity: Molecular Genetics and the Evolution of Animal Design (Second изд.). Oxford: Blackwell Publishing. ISBN 978-1-4051-1950-4.
- Dumanović, J, marinković, D, Denić, M: Genetički rečnik, Beograd, 1985.
- Kosanović, M, Diklić, V: Odabrana poglavlja iz humane genetike, Beograd, 1986.
- Lazarević, M: Ogledi iz medicinske genetike, Beograd, 1986.
- Marinković, D, Tucić, N, Kekić, V: Genetika, Naučna knjiga, Beograd
- Matić, Gordana: Osnovi molekularne biologije, Zavet, Beograd, 1997.
- Ridli, M: Genom — autobiografija vrste u 23 poglavlja, Plato, Beograd, 2001.
- Tatić, S, Kostić, G, Tatić, B: Humani genom, ZUNS, Beograd, 2002.
- Tucić, N, Matić, Gordana: O genima i ljudima, Centar za primenjenu psihologiju, Beograd, 2002.
- Šerban, Nada: ćelija — strukture i oblici, ZUNS, Beograd, 2001
- Berry, Andrew; Watson, James D (2003). DNA: the secret of life. New York: Alfred A. Knopf. ISBN 978-0-375-41546-3.
- Calladine, Chris R.; Drew, Horace R.; Luisi, Ben F.; Travers, Andrew A. (2003). Understanding DNA: the molecule & how it works. Amsterdam: Elsevier Academic Press. ISBN 978-0-12-155089-9.
- Dennis, Carina; Clayton, Julie (2003). 50 years of DNA. Basingstoke: Palgrave Macmillan. ISBN 978-1-4039-1479-8.
- Judson, Horace Freeland (1979). The Eighth Day of Creation: Makers of the Revolution in Biology. Touchstone Books. ISBN 978-0-671-22540-7.. : Cold Spring Harbor Laboratory Press, 1996 paperback. (2nd изд.). ISBN 978-0-87969-478-4..
- Micklas, David (2003). DNA Science: A First Course. Cold Spring Harbor Press. ISBN 978-0-87969-636-8..
- Olby, Robert C. (1994). The path to the double helix: the discovery of DNA. New York: Dover Publications. ISBN 978-0-486-68117-7., first published in October 1974 by MacMillan, with foreword by Francis Crick;the definitive DNA textbook, revised in 1994 with a 9 page postscript
- Olby, Robert C. (2009). Francis Crick: A Biography. Plainview, N.Y: Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-798-3.
- Ridley, Matt (2006). Francis Crick: discoverer of the genetic code. Ashland, OH: Eminent Lives, Atlas Books. ISBN 978-0-06-082333-7.
- Rosenfeld, Israel (2010). DNA: A Graphic Guide to the Molecule that Shook the World. Columbia University Press. ISBN 978-0-231-14271-7..
- Schultz, Mark; Cannon, Zander (2009). The Stuff of Life: A Graphic Guide to Genetics and DNA. Hill and Wang. ISBN 978-0-8090-8947-5.
- Russell, Peter (2001). iGenetics. New York: Benjamin Cummings. ISBN 978-0-8053-4553-7.
- Siegmund, Gunther Stent; Watson, James D. (1980). The double helix: a personal account of the discovery of the structure of DNA. New York: Norton. ISBN 978-0-393-95075-5.
- Watson, James D. (2004). DNA: The Secret of Life. Random House. ISBN 978-0-09-945184-6..
- Wilkins, Maurice (2003). The third man of the double helix the autobiography of Maurice Wilkins. Cambridge, Eng: University Press. ISBN 978-0-19-860665-9.
- Brown T.A. (2006). Genomes (3rd изд.). Garland Science. ISBN 978-0-8153-4138-3.
- Wolfram, Saenger (1984). Principles of Nucleic Acid Structure. New York: Springer-Verlag. ISBN 978-0-387-90762-8.
- Butler John M. (2001). Forensic DNA Typing. Elsevier. стр. 14—15. ISBN 978-0-12-147951-0. OCLC 223032110 45406517.
- Farkas, Daniel (1996). DNA simplified: the hitchhiker's guide to DNA. Washington, D.C: AACC Press. ISBN 978-0-915274-84-0.
- Lodish, Harvey; Berk, Arnold; Kaiser, Chris A.; Krieger, Monty; Scott, Matthew P.; Bretscher, Anthony; Ploegh, Hiddle; Matsudaira, Paul (2008). Molecular Cell Biology (6th изд.). New York: W.H. Freeman. ISBN 978-0-7167-7601-7.
- Passarge, Eberhard (2006). Color atlas of genetics (3 Rev Upd изд.). Thieme. ISBN 978-1-58890-336-5.
- Silver, Lee M. (1995). „Karyotypes, Chromosomes, and Translocations”. Mouse Genetics: Concepts and Applications. Oxford: Oxford University Press. стр. 83—92. ISBN 978-0-19-507554-0.
- Youngson, Robert M. (2006). Collins Dictionary of Human Biology. Glasgow: HarperCollins. ISBN 978-0-00-722134-9.
- Neidle; Balasubramanian, ур. (2006). Quadruplex Nucleic Acids. ISBN 978-0-85404-374-3. Архивирано из оригинала 30. 9. 2007. г. Приступљено 19. 4. 2012.
- Craig, JM (2011). Wong, NC, ур. Epigenetics: A Reference Manual. Caister Academic Press. ISBN 978-1-904455-88-2.
- Abbas Hamed K. (2005). Aflatoxin and Food Safety. CRC Press. ISBN 978-0-8247-2303-3.
- Hudler, George (1998). Magical Mushrooms, Mischievous Molds. Princeton, NJ: Princeton University Press. ISBN 978-0-691-07016-2.
- Lewin, Benjamin (1997). Genes (6th изд.). Oxford University Press. ISBN 978-0-19-857779-9.
- Jeffrey, A. (1985). „DNA modification by chemical carcinogens”. Pharmacol Ther. 28 (2): 237—72. PMID 3936066. doi:10.1016/0163-7258(85)90013-0.
Спољашње везе[уреди | уреди извор]
- Наука 50: ДНК (РТС Образовно-научни програм - Званични канал)
- Бионет школа
- ДНК на сајту Curlie
- Предвиђање ДНК места везивања на протеину
- ДНК намотавање да би се формирали хромозоми
- Игра ДНК двоструког хеликса