Селенаста киселина
Изглед
| |

| |
| Називи | |
|---|---|
| IUPAC назив
Selenasta kiselina
| |
| Идентификација | |
3Д модел (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.029.067 |
| КЕГГ[1] | |
| УНИИ | |
| |
| Својства | |
| H2SeO3 | |
| Моларна маса | 128,97 g/mol |
| Агрегатно стање | бели хигроскопни кристали |
| Густина | 3,0 g/cm3 |
| Тачка топљења | razlaže se na 70 °C |
| веома је растворна | |
| Растворљивост | растворна у етанолу |
| Сродна једињења | |
Други ањони
|
селенова киселина селан |
Други катјони
|
натријум селенит |
Сродна једињења
|
сумпораста киселина телураста киселина |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
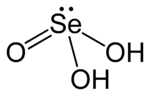
Селенаста киселина је хемијско једињење са формулом H2SeO3. Структурно, она се прецизније описује са (HO)2SeO. Она је главна оксокиселина селена. Друга је селенова киселина.[4][5][6]
Формирање и особине[уреди | уреди извор]
Селенаста киселина је аналогна сумпорастој киселини, мада се она лакше може изоловати. Селенаста киселина се лако формира додатком селен диоксида у воду. Као кристалина материја, ова има пирамидалне молекуле који су међусобно повезани водоничним везама. У раствору она је дипротична киселина:[6]
- H
2SeO
3 ⇌ H+
+ HSeO−
3 (pKa = 2.62) - HSeO−
3 ⇌ H+
+ SeO2−
3 (pKa = 8.32)
Она има благо оксидациону природу, мада су њене реакције кинетички споре. У 1 M H+
:
- H
2SeO
3 + 4 H+
+ 4 -
e ⇌ Se + 3 H
2O (Eo= +0.74 V)
У 1 M OH−
:
- SeO2−
3 + 4 -
e + 3 H
2O ⇌ Se + 6 OH−
(Eo= −0.37 V)
Она се користи у органској синтези за припрему 1,2-дикетона (е.г. глиоксала).[7]
Референце[уреди | уреди извор]
- ^ Јоанне Wиxон; Доуглас Келл (2000). „Wебсите Ревиеw: Тхе Кyото Енцyцлопедиа оф Генес анд Геномес — КЕГГ”. Yеаст. 17 (1): 48—55. дои:10.1002/(СИЦИ)1097-0061(200004)17:1<48::АИД-YЕА2>3.0.ЦО;2-Х.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Еван Е. Болтон; Yанли Wанг; Паул А. Тхиессен; Степхен Х. Брyант (2008). „Цхаптер 12 ПубЦхем: Интегратед Платформ оф Смалл Молецулес анд Биологицал Ацтивитиес”. Аннуал Репортс ин Цомпутатионал Цхемистрy. 4: 217—241. дои:10.1016/С1574-1400(08)00012-1.
- ^ Лиде, Давид Р. (1998). Хандбоок оф Цхемистрy анд Пхyсицс (87 изд.). Боца Ратон, ФЛ: ЦРЦ Пресс. стр. 4—81. ISBN 0-8493-0594-2.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ а б Holleman A. F.; Wiberg E. (2001). Inorganic Chemistry (1st изд.). San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ “Glyoxal Bisulfite”, Organic Syntheses, Collected Volume 3, pp. 438 (1955).
