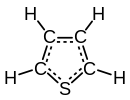
Тиофен
| |||

| |||
| Називи | |||
|---|---|---|---|
| IUPAC назив
Thiophene
| |||
| Други називи
Тиофуран
Тиациклопентадиен | |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.003.392 | ||
| RTECS | XМ7350000 | ||
| УНИИ | |||
| |||
| Својства | |||
| C4H4S | |||
| Моларна маса | 84,14 g/mol | ||
| Агрегатно стање | безбојна течност | ||
| Густина | 1,051 g/mL, tečnost | ||
| Тачка топљења | −38 °C (−36 °F; 235 K) | ||
| Тачка кључања | 84 °C (183 °F; 357 K) | ||
| Индекс рефракције (nD) | 1.5287 | ||
| Вискозност | 0.8712 cP на 0.2 °C 0.6432 cP на 22.4 °C | ||
| Опасности | |||
| Безбедност приликом руковања | Еxтернал МСДС | ||
ЕУ класификација (ДСД)
|
није на листи | ||
| НФПА 704 | |||
| Тачка паљења | −1 °C | ||
| Сродна једињења | |||
Сродне материја: тиоетри
|
Тетрахидротиофен Диетил сулфид | ||
Сродна једињења
|
Фуран Пирол | ||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |||
| Референце инфокутије | |||
Тиофен је хетероциклично једињење са формулом C4H4S. Он садржи ароматичан раван петочлани прстен, и подлеже екстензивним реакцијама супституције. Сродни тиофену су бензотиофен и дибензотиофен, који садрже тиофенски прстен спојен са једним и два бензенска прстена, респективно. Једињења аналогна тиофену су фуран (C4H4O) и пирол (C4H4NH).[3][4]
Изолација, распорстарњеност[уреди | уреди извор]
Тиофен је нађен као контаминант у бензену.[5] Примећено је да исатин формира плаву боју кад се помеша са сумпорном киселином и сировим бензеном. За формирање плавог индофенина се дуго веровало да је реакција бензена. Виктор Мејер је успео да изолује супстанцу одговорну за ову реакцију у бензену. То ново хетероциклично једињење је био тиофен.[6]
Тиофен и његови деривати се јављају у петролеуму, у појединим случајевима у концентрацијама и до 1-3%. Тиофенски садржај петролеума и угља се одстрањује процесом хидродесулфуризације (ХДС). У ХДС, течни или гасни материјал се преводи преко молибден дисулфидног катализатора п притиском H2. Тиофен подлеже хидрогенолизи и формирају се угљоводоници и водоник сулфид. На тај начин, тиофен се конвертује у бутан и H2S. Превалентнији и проблематичнији у петролеуму су бензотиофен и дибензотиофен.
Особине[уреди | уреди извор]
На собној температури, тиофен је безбојна течност са благим пријатним мирисом који подсећа на бензен. Висока реактивност тиофена у реакцији сулфонације је основа за сепарацију тиофена из бензена, што је тешко постићи дестилацијом услед њихових сличних тачака кључања (разликују се за 4 °C на собном притиску). Попут бензена, тиофен формира азеотроп са етанолом.
Молекул је раван; са углом везе на сумпору од око 93 степена, C-C-S угао је око 109, и друга два угљеника имају угао везе од око 114 степени. C-C везе угљеника суседних сумпору су око 1.34А, C-S веза је дуга око 1.70А, и друга C-C веза је око 1.41А.
Реактивност[уреди | уреди извор]
Тиофен се сматра ароматичним, мада теоријске калкулације сугерирају да је његов степен ароматичности мањи од бензена. Електронски парови сумпора су знатно делокализовани у пи електронском систему. Последица његове ароматичности је да тиофен не манифестује особине конвенционалних тиоетара. На пример атом сумпора је отпоран на алкилацију и оксидацију.
Литература[уреди | уреди извор]
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Katritzky A.R.; Pozharskii A.F. (2000). Handbook of Heterocyclic Chemistry (Second изд.). Academic Press. ISBN 0080429882.
- ^ Viktor Meyer (1883). „Ueber den Begleiter des Benzols im Steinkohlenteer”. Berichte der Deutschen chemischen Gesellschaft. 16: 1465—1478. doi:10.1002/cber.188301601324.
- ^ Ward C. Sumpter (1944). „The Chemistry of Isatin”. Chemical Reviews. 34 (3): 393—434. doi:10.1021/cr60109a003.
Spoljašnje veze[уреди | уреди извор]