Johanes Ridberg
| Johanes Ridberg | |
|---|---|
 Johanes Robert Ridberg, švedski fizičar | |
| Lični podaci | |
| Datum rođenja | 8. novembar 1854. |
| Mesto rođenja | Halmstad, Švedska-Norveška |
| Datum smrti | 28. decembar 1919. (65 god.) |
| Mesto smrti | Lund, Švedska |
| Obrazovanje | Univerzitet u Lundu |
| Naučni rad | |
| Polje | Fizika |
| Poznat po | Ridbergovoj formuli |
Johanes Robert Ridberg (šved. Johannes Rydberg; Halmstad, 8. novembar 1854 — Lund, 28. decembar 1919) bio je švedski fizičar.[1] Johanes Ridberg je u fizici poznat po Ridbergovoj formuli koja je 1888. godine korištena za predviđanje talasne dužine fotona emitovane promenom u energetskim nivoima elektrona u atomu. Fizička konstanta poznatija kao Ridbergova konstanta preimenovana je nakon njegove smrti Ridbergova jedinica. Pobuđeni atomi sa visokim osnovnim kvantnim brojem, predstavljen je kao i u Ridbergovoj jednačini, nazvani su Ridbergovim atomima.[2] Jedan krater na Mesecu nosi Ridbergovo ime. Johanes je bio aktivan na Lund Univerzitetu u Švedskoj. Dobio je doktorat iz matematike 1879. godine.[3] Od 1882. do 1919. godine bio je i profesor na Lund Univerzitetu. Još kao student je pronašao vezu između linija na spektrografu i korisne mase atoma vodonika. Preminuo je 28. decembra 1919. godine.[4][5]
Johanes se bavio proučavanjem optičkih spektara. Prvi je uočio da se talasni brojevi atomskih spektara svih hemijskih elemenata mogu prikazati kao umnožak dva faktora, od kojih je jedan promenjiv (varijabilan), a drugi stalan (konstantan). Taj konstantni faktor dobio je naziv Ridbergova konstanta. Borova je teorija, međutim, pokazala, a posle su tačnija merenja to i potvrdila, da se Ridbergova konstanta ponešto razlikuje od hemijskog elementa i da je njena prava vrednost R za dati element:
gde je: m - masa elektrona, M+ - masa jednostruko jonizovanog atoma dotičnog elementa, a R∞ - univerzalna Ridbergova konstanta, to jest:
gde je: e - električni naboj elektrona, c - brzina svetlosti, h - Plankova konstanta.
Bio je član Kraljevskog društva (engl. Royal Society) od 1919. Po njem su nazvani krater na Mesecu (Ridberg (krater)) i planetoid (10506 Ridberg).[6] Pobuđeni atomi, s vrlo visokim kvantnim brojevima, a koje prestavlja broj n u Ridbergovoj formuli, nazivaju se Ridbergovi atomi. Ridbergova predviđanja da će vodonikove spektralne linije, koja se dobiju iz Ridbergove formule, pomoći u teoretskom razumevanju atomske strukture, iskoristio je 1913. N. Bor i stvorio Borov model atoma. U spektroskopiji se koristi konstanta, koja se zasniva na teoretskom atomu beskonačne mase, i naziva se Ridberg (R) u njegovu čast.
Iskustvene činjenice o spektrima
[uredi | uredi izvor]



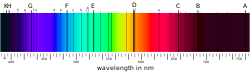





Užarena čvrsta tela emituju svetlost s kontinuirano raspodeljenim talasnim dužinama (toplotno zračenje). Od temperature užarenog tela zavisi koji je deo spektra najjači (najintenzivniji), ali od mesta maksimuma postepeno se gasi svetlost prema manjim i većim talasnim dužinama. Nasuprot tome kontinuiranom spektru čvrstih tela opaža se kod plinova i para nešto drugo. U njihovom se spektru pojavljuju diskretne linije, koje su svojstvene za pojedine hemijske elemente. Čitav spektar se sastoji od niza oštro određenih linija.
Lako je uvideti da linijski spektar potiče od atoma. Takvi se spektri dobijaju pri eksperimentima s katodnim i kanalnim zracima. Električno izbijanje u katodnoj cevi niskog pritiska izaziva uvek veliki broj atoma na emisiju svetlosti. Linijske spektre emituju takođe i plemeniti gasovi, koji se sastoje od čistih atoma, a ne molekula.
Linijski spektri se mogu studirati na emisijskom ili apsorpcionom spektru. Pusti li se bela svetlost kroz neke pare ili plin, opaža se u dobijenom spektru da su neke talasne duljine ugušene. Tamne linije stoje tačno na onim mestima spektra gde bi ležale emisijske linije. Gas dakle apsorbuje svetlost onih talasnih dužina koje bi inače emitovao. Apsorpcijski spektar slaže se potpuno s emisionim. Ova određenost u spektrima hemijskih elemenata jedan je od temeljnih zakona nuklearne fizike.
Iako svakom hemijskom elementu pripadaju posebne, svojstvene spektralne linije, ipak se u njihovim spektrima opažaju neka zajednička svojstva, koja omogućuju da se unese red u golem spektroskopski materijal. Spektralne linije svakog hemijskog elementa daju se srediti u nekoliko serija. Svaka pojedina serija predstavlja niz linija koje su poređane po određenom pravilu. Često se već na prvi pogled vidi da linije jedne serije pripadaju zajedno. Promatraju li se linije od većih talasnih dužina prema manjim, neposredno je uočljivo da se razmak između njih smanjuje. Linije se gomilaju prema određenoj talasnoj dužini, koja je granica te serije.
Prvi je J. J. Balmer 1885. otkrio da se vodonikov spektar može prikazati jednostavnom matematičkom jednačiniom. Njemu su tada bile poznate 4 vidljive vodonikove linije s talasnim dužinama:
- Hα = 656, 199 nm
- Hβ = 486, 152 nm
- Hγ = 434, 067 nm
- Hδ = 410, 194 nm
Običaj je da se vodonikove linije označe početnim slovima grčkog alfabeta, koja dolaze kao indeksi hemijskom simbolu H. Recipročne vrednosti talasnih dužina te četiri linije daje se jednačinom (Ridbergova formula):
gde je: m = 3, 4, 5, 6; a R je takozvana Ridbergova konstanta. Uvrsti li se u Balmerovoj jednačini za м celi brojevi veći od 7 dobijaju se talasne dužine koje leže u ultraljubičastom području spektra. Eksperimentima se zaista našlo još oko 30 linija koje se potpuno slažu s Balmerovom jednačinom. Linije se gomilaju prema talasnoj dužini koja je dana izrazom:
To je granica serije. Balmerova serija je idealni tip spektralnih linija uopšte. Kako se vidi na slici, razmak između susednih linija pravilno se smanjuje, i linije se gomilaju prema određenoj granici.
Iz razloga koji će se kasnije izneti uvedeno je da se spektralne jednačine postavljaju za frekvencije, a ne za talasne dužine. Eksperimentima se, doduše, mere talasne dužine (iz interferentnih, difrakcionih ili disperzionih pojava), ali zakoni spektralne analize postaju pregledniji kad se uzimaju u obzir frekvencije. Pri tom treba misliti na sledeće: frekvencija ν se može izračunati iz talasne duljine λ prema poznatom odnosu:
No brzina svetlosti c nije tako tačno izmerena kako su tačna merenja talasne dužine. Tačnost spektralne analize je nenadmašiva. Iz tog razloga i dalje se u spektralnoj analizi svi iskustveni podaci izražavaju u talasnim dužinama.
Uvodeći frekvenciju, može se Balmerova jednačina pisati u obliku:
gde je m = 3, 4, 5…. Frekvencije spektralnih linija vodonika mogu se dakle prikazati kao razlike (diferencije) između dva člana, od kojih je prvi konstantan, a drugi opada kao 1/9, 1/16, 1/25, 1/36 …. Tu se odmah nameće pitanje: Mora li se uvek uzeti kao konstantan broj 1/4? Moguće je pomisliti, da prvi konstantni član bude bilo koji razlomak 1/n2. Godine 1908. našao je F. Pašen u infracrvenom području spektralne linije vodonika kojima su se talasne dužine tačno slagale s izrazima:
Tu dakle postoje dva člana jedne serije, kojoj je konstantni član R/32. Taj član ujedno određuje i granicu serije. I od te takozvane Pašenove serije nađen je vrlo velik broj linija. Godine 1916. pronašao je Liman na drugoj strani od Balmerove serije, duboko u ultraljubičastom području, nove spektralne linije, koje se mogu prikazati istom Balmerovovom jednačinom, samo što se za konstantni član trebalo uzeti u imeniocu celi broj 1. Vodonikov spektar sastoji se, od ovih serija:
Limanova serija:
gde je: m = 2, 3, 4 ….
gde je: m = 3, 4, 5 ….
Pašenova serija:
gde je: m = 4, 5, 6 ….
Bracetova serija:
gde je: m = 5, 6, 7 ….
Pfundova serija:
gde je: m = 6, 7, 8 ….
Od tog golemog mnoštva linija padaju u vidljivo područje spektra svega prve 4 linije Balmerove serije. Odatle se vidi kako je važno ispitivati čitav spektar da se nađu osnovni zakoni serije.
Frekvencije spektralnih linija vodonika mogu se generalno izraziti jednačinom:
gde su: n i m - celi brojevi.
Frekvencije vodonikovih linija dobiju se, dakle, da se od niza c∙R/n2 učine sve moguće pozitivne razlike (diferencije). Tako objašnjena, Balmerova jednačina vodi nas do opšteg načela kombinacije, što ga je otkrio V. Ric 1908. Po tom načelu može se za svaki hemijski element postaviti niz članova T1, T2, T3, …. tako da su frekvencije njegovog spektra date razlikama (diferencijama):
Ricovo načelo kombinacije potvrđeno je pri ispitivanju svih spektara. Ono je ključ za sređivanje različitih serija. Načelo kombinacije sadrži u sebi osnovni zakon prirode, koji se u punom smislu razotkriva tek u nuklearnoj fizici.[7]
Reference
[uredi | uredi izvor]- ^ „Johannes Robert Rydberg | Swedish physicist”. Encyclopedia Britannica (na jeziku: engleski). Pristupljeno 2021-02-02.
- ^ Šibalić, Nikola; S Adams, Charles (2018). Rydberg Physics (na jeziku: engleski). IOP Publishing. Bibcode:2018ryph.book.....S. ISBN 9780750316354. doi:10.1088/978-0-7503-1635-4.
- ^ Hamilton, Paul Charles (1992). Janne Rydberg: a physicist in 19th-century Sweden. [Cambridge, Massachusetts]. str. 26—30.
- ^ Martinson, I.; Curtis, L.J. (2005). „Janne Rydberg – his life and work” (PDF). Nuclear Instruments and Methods in Physics Research Section B: Beam Interactions with Materials and Atoms (na jeziku: engleski). 235 (1–4): 17—22. Bibcode:2005NIMPB.235...17M. doi:10.1016/j.nimb.2005.03.137.
- ^ Hamilton (1992). Janne Rydberg: a physicist in 19th-century Sweden. str. 47—48.
- ^ Rydberg, Johannes Robert , [1] "Hrvatska enciklopedi-ja", Leksikografski zavod Miroslav Krleža, enciklopedija.hr, 2017.
- ^ Ivan Supek: "Nova fizika", Školska knjiga Zagreb, 1966.
Literatura
[uredi | uredi izvor]- Mike Sutton, “Getting the numbers right – the lonely struggle of Rydberg” Chemistry World, Vol. 1, No. 7, July 2004.
- Martinson Indrek, L.J. Curtis: "Janne Rydberg – his life and work", journal = NIM B, [2] 2005.
- O'Connor, John J.; Robertson, Edmund F., "Johannes Rydberg", MacTutor History of Mathematics archive, University of St Andrews, [3].
- Magie, William Francis (1969). A Source Book in Physics. Cambridge, Massachusetts: Harvard University Press.
- Rydberg, J.R. (1889). „Researches sur la constitution des spectres d'émission des éléments chimiques” [Investigations of the composition of the emission spectra of chemical elements]. Kongliga Svenska Vetenskaps-Akademiens Handlingar [Proceedings of the Royal Swedish Academy of Science]. 2nd series (na jeziku: francuski). 23 (11): 1—177.
- Rydberg, J.R. (1890). „On the structure of the line-spectra of the chemical elements”. Philosophical Magazine. 5th series. 29: 331—337.
- Litzén, Ulf (2015). Fysik i Lund under 300 år (na jeziku: švedski). Lund: Lunds universitetshistoriska sällskap. ISBN 9789175453200.
- Hamilton (1992). Janne Rydberg: a physicist in 19th-century Sweden.
- Martinson, I.; Curtis, L.J. (2005). „Janne Rydberg – his life and work” (PDF). Nuclear Instruments and Methods in Physics Research Section B: Beam Interactions with Materials and Atoms (na jeziku: engleski). 235 (1–4): 17—22. Bibcode:2005NIMPB.235...17M. doi:10.1016/j.nimb.2005.03.137.
Spoljašnje veze
[uredi | uredi izvor]- O'Connor, John J.; Robertson, Edmund F. „Johanes Ridberg”. MacTutor History of Mathematics archive. University of St Andrews.















