Ензимска кинетика

Ензимска кинетика је област која изучава брзине хемијских реакција катализованих ензимима. Проучавање и познавање ензимске кинетике даје увид у механизме по којима се одвијају ове реакције. Између осталог стиче се увид и у њихову улогу у метаболизму, у то како је њихова активност контролисана у ћелијама и како дроге и отрови могу инхибирати њихову активност.
Ензими су молекули који управљају другим молекулима-ензимским супстратима. Супстрати се везују за активно место на ензиму и трансформишу се у производе кроз низ ступњева који чине механизам дате ензимске реакције. Неки ензими могу везивати више супстрата и/или давати више продуката, а пример за то је протеаза која делујући на један протеин даје два полипептидна производа. Са друге стране постоје ензими као што је ДНК полимераза, која везује нуклеотиде у ДНК. Иако се ови механизми углавном састоје од великог броја степени, један карактеристичан степен одређује укупну кинетику процеса и зове се одлучујући степен. Одлучујући степен може бити хемијска реакција или структурна промена ензима или супстрата, која прати ослобађање продукта из ензима.
Познавање структуре ензима има велики значај зато што може наговестити како ће се током катализе везивати супстрат и ензим, које промене ће се догађати током реакције, па чак и која је улога појединачних аминокиселинских остатака у механизму.
Разликују се два типа ензимских механизама, механизме који укључују један супстрат (моносупстратне механизме) и механизме који укључују већи број супстрата (полисупстратне). Изучавања ензимске кинетике са моносупстратним механизмом какву има ензим триозофосфат изомераза, имају за циљ да одреде афинитет везивања супстрата од стране ензима. Уколико ензим везује већи број супстрата нпр. ензим дихидрофолат редуктаза (приказан на слици), ензимска кинетика нам тада може пружити информацију о редоследу везивања супстрата и грађења продуката.
Протеински ензими нису једини биолошки катализатори. У процесима везаним за РНК као што су транслација и посттранскрипциона модификација РНК, учествују рибозими и рибозоми. Главна разлика између протеинских ензима и РНК катализатора је та што РНК катализатори учествују у доста мањем броју реакција, али се њихови реакциони механизми и кинетика, посматрају на исти начин као код протеинских ензима.
Општи принципи
[уреди | уреди извор]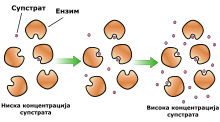
У реакцијама катализованим ензимима учествују исти реактанти и граде се исти продукти као у некатализованим реакцијама. Ензими као и остали катализатори не мењају положај равнотеже између супстрата и продуката.[1]
Међутим, за разлику од обичних хемијских реакција, код ензимски каталисаних реакција долази до засићења ензима и то се назива сатурационе реакције. Брзина ензимски каталисаних реакција ће расти са додатком супстрата зато што већи број активних места постаје заузет. Овај раст се наставља све док ензим у потпуности не постане засићен супстратом, када брзина достиже свој максимум.
Два најзначајнија кинетичка параметра ензимски каталисаних реакција су брзина којом ензим постаје засићен одређеним супстратом и максимална брзина реакције која се може достићи.
Познавање ових параметара је значајно при сагледавању понашања ензима у ћелијском окружењу и реаговања на промене средине.
Поступци за одређивање брзине ензимски каталисаних реакција
[уреди | уреди извор]
Изучавање ензима подразумева експерименте којима се одређују брзине ензимски каталисаних реакција. Како се ензим не троши у реакцији коју катализује, да би се одредила брзина реакције прате се промене концентрације како супстрата тако и продукта.
Постоји већи број метода за одређивање брзине. Спектрофотометријске методе прате промену апсорбанције светлости од стране реактаната односно продуката са временом и оне су врло практичне јер омогућавају континуално мерење брзине. Радиометријске методе прате уграђивање или ослобађање радиоактивности у циљу мерења количине продукта награђене у току времена. Ради се о дисконтинуалним методама јер захтевају издвајање узорка а обично су врло осетљиве и омогућавају мерење веома ниске ензимске активности.[2] Сличан приступ проблему има масена спектрометрија при праћењу уграђивања или ослобађања стабилних изотопа у току преласка реактаната у продукте.
Најосетљивије методе користе микроскоп са ласером, за посматрање промена појединачних молекула ензима у току датих каталитичких реакција.
При овим мерењима се користи и појава промене у флуоресценцији коензима или флуоресцентних боја (додају се на одређено место на протеину) кроз механизам, што омогућава праћење покрета на активном месту протеина.[3] На овај начин стиче се нова представа о кинетици и динамици појединачних молекула за разлику од класичне ензимске кинетике, која посматра понашање великог броја молекула ензима као целине.[4][5]
На графику реакционе криве је приказан уобичајен ток кинетичке криве при настајању продукта, који се користи при изучавању ензима. На почетку реакције продукт се формира линеарном почетном брзином, како реакција тече брзина се смањује због утрошка супстрата или нагомилавања продукта што се на кинетичкој кривој види као одступање од линеарности. Дужина линеарног дела зависи од радних услова, а може се кретати од милисекунде до сата. Обично се услови подешавају тако да област графика где је брзина линеарна траје више од минута чиме се олакшава рад.
Већина изучавања ензимске кинетике користе овај иницијални, линеарни део ензимске реакције. Такође је могуће мерити целокупну реакциону криву, а затим податке фитовати помоћу нелинеарне једначине брзине. Овај метод мерења назива се анализа прогресивне криве[6] и користи се као алтернатива при брзим реакцијама када је и иницијални степен превише брз да би се тачно измерио.
Моносупстратне реакције
[уреди | уреди извор]Ензими реагују са једним супстратом кроз механизме који се зову моносупстратни механизми. Овом типу ензима припадају изомеразе као што су триозофосфат изомераза или бисфосфоглицерат мутаза, интрамолекуларне лиазе као што су аденилат циклазе и РНК лиазе.[7] Међутим, неки од ензима који везују само један супстрат не реагују по овом механизму, нпр каталаза. Иако у рекцији учествује једна врста супстрата, постојање измењеног ензимског интермедијера значи да је механизам каталазе у ствари пинг-понг механизам који је карактеристичан за реакције са више супстрата.
Михаелис-Ментенина кинетика
[уреди | уреди извор]
Како при ензимски каталисаним реакцијама долази до засићења ензима, брзина каталитичке реакције не показује линеарну зависност са повећањем концентрације супстрата.
На кривој засићења видимо да брзина реакције (v), расте са порастом концентрације супстрата [S] у области ниже концентрације супстрата. Како [S] расте ензим постаје засићен супстратом а брзина достиже свој максимум, Vmax.
Михаелис-Ментенина кинетика за моносупстратну реакцију је приказана на слици лево.
Механизам почиње бимолекулском реакцијом између ензима Е и супстрата S при којој се гради комплекс ензим-супстрат, ES.
Иако механизам мономолекулске реакције може бити доста сложен, обично постоји један одлучујући степен за брзину који дозвољава да се механизам посматра као један кинетички степен са константом брзине k2.

- (Једначина 1).
k2 зове се још и kcat или турновер број (број понављања), представља максималан број ензимских реакција катализованих у секунди.
При нижим концентрацијама супстрата [S] у равнотежи постоје два облика ензима, ензим у слободном облику Е и у облику комплекса ензим-супстрат, ES. Повећањем [S] такође расте и [ЕС] на рачун утрошка [Е] што равнотежу помера надесно. Како брзина реакције зависи од концентрације ES она ће бити осетљива на мале промене концентрације супстрата, тако да ће при веома високим вредностима [S] ензим у потпуности бити засићен супстратом и постојаће само у облику комплекса ES.
Под овим условима брзина (v≈k2[E]tot=Vmax) је неосетљива на мале промене [S], где је [E]tot укупна концентрација ензима:
што је приближно једнако концентрацији ES при сатурацији.
Михаелис-Ментенина једначина[8] описује зависност брзине реакције од положаја равнотеже при везивању супстрата за ензим и константе брзине k2. Леонор Михаелис и Мод Ментен су показали да се у случају да је k2 много мање од k-1 може извести следећа једначина:
- (Једначина 2)
Михаелис-Ментенина једначина је основна кинетичка једначина за моносупстратне ензимске реакције.
Михаелисова константа, Km је дефинисана као концентрација супстрата при којој је брзина реакције једнака половини Vmax. Ово можемо проверити заменом [S] = Km у Михаелис-Ментенину једначину.
Уколико је брзина одлучујућег ступња мала у поређењу са дисоцијацијом супстрата (k2 << k-1), Михаелисова константа је приближно једнака константи дисоцијације комплекса ES, мада је овај случај релативно редак.
Уобичајен случај је онај у коме је k2 > k-1 познат као Бригс-Халданова кинетика.[9] Михаелис-Ментенина једначина и даље важи под овим уопштенијим условима, као што се може извести из апроксимације стационарног стања. У току иницијалног периода можемо сматрати да је брзина реакције константна, а самим тим и да је [ES] скоро константно (види једначину 1):
где је Михаелисова константа дата као:
([Е] је концентрација слободног ензима). Ако све ово узмемо у обзир, општа формула за брзину реакције v, биће поново дата Михаелис-Ментенином једначином:
Каталитичка ефикасност -{ је мера ефикасности при превођењу супстрата у продукт. Користећи дефиницију Михаелисове константе, -{, Михаелис-Ментенина једначина може бити написана у следећем облику:
где је [Е] концентрација слободног ензима. Стога, специфична константа је у ствари константа брзине за бимолекуларну реакцију слободног ензима и слободног супстрата када настаје продукт. Специфична константа зависи од учесталости реакција ензима и супстрата у раствору а вредности јој се крећу око 1010 M−1 s−1 на температури од 25 °C. Значајно је да овај максимум не зависи од величине ни супстрата ни ензима. Однос специфичних константи два различита супстрата, одговара квантитативном поређењу ефикасности којима ензим трансформише одговарајуће супстрате. Специфична константа се може очитати као нагиб Михаелис-Ментенине праве при ниским вредностима концентрације супстрата [S] (када је [S] << Km).
Линеарна зависност Михаелис-Ментен једначине
[уреди | уреди извор]
График зависности 1/v од 1/[S] је линеаран. Иако је на почетку, при ниским концентрацијама супстрата линеаран, при високим вредностима [S] када долази до сатурације права линија постаје крива. Нелинеарност је представљала проблем при одређивању Km и Vmax пре него што је почела употреба нелинеарног фитовања кривих. Због тога је неколико научника развило линеаризацију Михаелис-Ментенине једначине путем Лајнвивер-Бурковог графика, Еди-Хофстеовог дијаграма и Ханес-Вулфовог графика.
Лајнвивер-Бурков график или двоструко реципрочан график је уобичајен начин приказивања кинетичких података и користи реципрочне вредности брзине реакције и концентрације супстрата. Као што се може уочити, график зависности
има линеаран облик, где је одсечак на y оси, 1/Vmax, а одсечак на x оси, -1/Km. Како експерименталне вредности не могу бити негативне, најнижа гранична вредност 1/[S] = 0 (пресек са у осом) одговара бесконачној концентрацији супстрата када је 1/v=1/Vmax што се види на графику. Стога, пресек са x осом је екстраполација експерименталних података добијених за позитивне концентрације. Недостатак Лајнвивер-Буркове методе је у томе што се фокусира на мерења при ниским концентрацијама супстрата и на тај начин уноси грешку при одређивању Vmax и Km.[10] Тачнија метода за добијање линеарног графика је Еди-Хофстеова метода мада су у савременијем раду помоћу рачунара све ове линеаризације замењене прецизнијим нелинеарним регресионим методама. Подаци које дају ове нормализације омогућавају смањење количине експерименталног рада и повећање поузданости резултата а могу се користити и за графичке и за нумеричке методе.[11]
Практични значај кинетичких константи
[уреди | уреди извор]Испитивање кинетике ензимских реакција је важно из два разлога. Прво, омогућава нам да објаснимо на који начин ензими делују, и друго, омогућава нам да предвидимо како се ензими понашају у живим организмима. Наиме, заједничко деловање ензима на метаболичке процесе се описује кинетичким константама које су означене као Km и Vmax.
Ова предвиђања нису једноставна, чак и у случају простих система. На пример, оксалоацетат се ствара помоћу малат-дехидрогеназе у митохондријама. Оксалоацетат може да изреагује са цитрат синтазом, фосфоенолпируват карбоксикиназом или аспартат аминотрансферазом улазећи у циклус лимунске киселине, глуконеогенезу или биосинтезу аспарагинске киселине. Да би се предвидео у који циклус оксалоацетат улази мора се знати концетрација оксалоацетата као и концентрацију и кинетику сваког од ових ензима.[12][13]
Полисупстратне реакције
[уреди | уреди извор]Полисупстратне реакције се одвијају преко више реакционих ступњева који описују како се супстрати везују и којим редоследом. Анализа ових реакција је много једноставнија ако се концентрација супстрата A одржава константном а супстрата B мења. Под овим условима, ензим се понаша као моносупстратни ензим, а график зависности брзине реакције од концентрације супстрата даје вредности константи Km и Vmax за супстрат. Уколико се ова мерења врше при различитим концентрацијама супстрата A, добијени подаци се могу искористити за утврђивање механизма реакције. За ензиме који реагују са два супстрата A и B и тиме их преводе у два продукта P и Q, постоје два типа механизма: механизам терцијарног комплекса и пинг-понг механизам.
Механизам тернарног комплекса
[уреди | уреди извор]Код ових реакција, оба супстрата се истовремено везују за ензим стварајући EAB комплекс. Везивање супстрата за ензим може бити насумично односно произвољно или се супстрати могу везивати одређеним распоредом. Када се функционална зависност брзине реакције од концентрације супстрата (стална концентрација A и променљива концентрација B, и обратно) прикаже графички, преко Лајнвивер-Бурковог графика, добијене линије ће се пресецати.
Ензими који делују по овом механизму су глутатион S-трансферазе,[14] дехидрофолат редуктазе[15] и ДНК полимеразе.[16]
Пинг-понг механизам
[уреди | уреди извор]
Ензими са пинг-понг механизмом могу постојати у два облика, Е и хемијски модификован облик ензима Е* (интермедијер). У овом механизму, супстрат А се везује за ензим преводећи га у модификовани облик Е* путем, на пример, преноса хемијске групе до активног места а затим бива отпуштен. Тек након отпуштања првог супстрата, може се везати супстрат B који тада реагује са модификованим ензимом, враћајући га тиме у немодификовани облик Е.
Када се функционална зависност брзине реакције од концентрације супстрата (стална концентрација А и променљива концентрација B, и обратно) прикаже графички, преко Лајнвивер-Бурковог графика, добијене линије биће међусобно паралелне.
У ензиме са пинг-понг механизмом спадају неке оксидоредуктазе као што је тиоредоксин пероксидаза,[17] трансферазе као што је ацилнеураминат цитидилилтрансфераза[18] и серин протеазе као што је трипсин и хемотрипсин.[19] Серин протеазе су разноврсна група ензима и ту спадају, на пример, ензими који учествују у варењу, неколико ензима који учествују у згрушавању крви и многи други. У овим серин-протеазама енергетски активиран интермедијер је врста ацил-ензима, који је формиран дејством активног места бочног низа серина на пептидну везу у протеинском супстрату.
Кинетика која не подлеже Михаелис-Ментен механизму
[уреди | уреди извор]
Код неких ензимских реакција, графичка зависност брзине реакције од концентрације супстрата има сигмоидалан облик, који најчешће указује на кооперативно везивање супстрата за активно место. То значи да везивање једног молекула супстрата утиче на везивање наредних молекула. Овакво понашање је карактеристично за ензиме који имају по неколико интерагујућих активних места.[20] Типичан пример оваквих ензима је хемоглобин код кога везивање супстрата за једно активно место мења афинитет осталих активних места да везују супстрат.
Позитивна кооперативност се јавља када везивање првог молекула супстрата повећава афинитет других активних места. Негативна кооперативност се јавља када везивање првог супстрата смањује афинитет ензима ка везивању других супстратних молекула.
У алостерне ензиме који показују негативну кооперативност[21] улазе тирозил тРНК-синтазе сисара, док позитивну кооперативност показују бактеријске аспартат транскарбамилазе[22] и фосфофруктокинезе[23].
Кооперативност је уобичајена појава и помаже у регулацији одговора ензима на промене у концентрацији њихових супстрата. Позитивна кооперативност чини ензиме много више осетљивим на промене концентрације супстрата и њихове активности могу показивати велике промене у уском опсегу концентрације супстрата. Обрнуто, негативна кооперативност чини ензиме неосетљивим на мале промене концентрације супстрата.
За квантитативно одређивање степена кооперативности најчешће се користи Хилова једначина.[24] На основу вредности Хиловог коефицијента n можемо закључити на који начин везивање супстрата за једно активно место утиче на везивање осталих супстрата. Наиме, уколико је n<1 имамо негативну кооперативност, док уколико је n>1 имамо позитивну кооперативност.
Предстационарно кинетичко стање
[уреди | уреди извор]
У првом тренутку реакције ензима са супстратом, ниједан продукт није створен и не јављају се интермедијерне врсте. Овакво стање система се назива предстационарно стање. Предстационарно стање према томе учествује у формирању и трошењу ензим-супстрат интермедијера (као што су ES и Е*) све до успостављања њихових неравнотежних стационарних концентрација.
Овакав прилаз је прво био примењен на реакције хидролизе каталисане хемотрипсином. Веома често, откриће неке интермедијерне врсте је пресудно у испитивању механизма ензимске реакције. На пример, у случају хемотрипсина[25], везивањем супстрата за нуклеофилни серин који је део активног места ствара се ацил-ензим интермедијер.
Са графика зависности количине створених продуката од времена видимо да се у првих пар секунди реакције интермедијер Е*[26] ствара веома брзо, а затим се брзина смањује све до успостављања стационарног стања система. Ова брза кратка фаза реакције мери један каталитички циклус. Према томе, количина продуката ослобођена у овој фази и на графику приказана као пресек са y осом такође даје количину употребљивог ензима.[27]
Хемијски механизам
[уреди | уреди извор]Један од важнијих циљева мерења кинетике ензимских процеса је одређивање хемијског механизма неке ензимске реакције тј. редослед хемијских ступњева који трансформишу супстрат у производ. Кинетички процеси који су дати као пример у даљем тексту разматрају још и којом се брзином интермедијери стварају али не могу тачно дефинисати шта су ти интермедијери.
Мерења кинетике датих реакција спроведена под различитим условима или са незнатно модификованим ензимима или супстратима могу често дати увид у хемијски механизам, зато што одређују најспорији степен или интермедијере у реакцији. На пример, раскидање ковалентне везе између водониковог атома и остатка молекула је често одлучујући степен реакције. Заменом једног по једног водониковог атома деутеријумима и праћењем брзине реакције замене може се одредити који тачно водоников атом учествује у најспоријем ступњу. Брзина ће се променити када водоник који учествује у одлучујућем ступњу буде замењен, због примарних кинетичких изотопских ефеката који се дешавају зато што је везе са деутеријумом много теже раскинути него везе са водоником.[28] Такође је могуће мерити сличне ефекте код других изотопских супституција, као што су 13C/12C и 18O/16O, али ови ефекти су много мање изражени.[29]
Изотопски ефекти још могу бити искоришћени да објасне различите етапе прелаза молекула супстрата у финалне производе. На пример, понекад је веома тешко утврдити порекло атома кисеоника у финалном производу; будући да могу потицати из воде или из дела супстрата. То може бити одређено систематском заменом стабилног изотопа кисеоника 18O неким од молекула који учествују у реакцији, а затим се проверава присутност изотопа у производу.[30] Хемијски механизам такође може бити разјашњен испитивањем кинетичких и изотопских ефеката под различитим pH условима[31], заменом металних јона или других везаних коензима[32], просторно одређеном мутагенезом очуваних остатака аминокиселине или испитивањем понашања ензима у присуству аналога супстрата.[33]
Инхибиција ензима
[уреди | уреди извор]
Инхибитори ензима су молекули који смањују или доводе до губитка активности ензима. Могу бити реверзибилни (њиховим уклањањем ензими поново стичу првобитну активност) или иреверзибилни (њихово дејство доводи до трајне неактивности ензима).
Реверзибилни инхибитори
[уреди | уреди извор]Врсте реверзибилних инхибиција су: компетитивне, некомпетитивне, без инхибиције и мешовите, што зависи од дејства инхибитора на Km и Vmax.
Ови различити ефекти су последица везивања инхибитора за ензим Е, за комплекс ензим-супстрат ES, или за оба. Испитивањем кинетике ензима у функцији концентрације инхибитора можемо закључити о ком се типу инхибитора ради. Наиме, уколико ову зависност прикажемо путем Лајнвивер-Бурковог и Еди-Хофстеовог графика[10], можемо видети да се у случају сва четири типа инхибиције промена кинетике ензима врши на себи својствен начин. Једноставности ради, у употреби су два симбола:
- и
где су Ki и K'i константе дисоцијације процеса везивања инхибитора за ензим и за комплекс ензим-супстрат. У присутству реверзибилног инхибитора, привидне константе Km и Vmax постају (α/α')Km и (1/α')Vmax, као што је показано у табели за појединачне случајеве:
| Тип инхибиције | Km привидно | Vmax привидно | ||
| Ki | () | компетитивна | ||
| Ki' | () | некомпетитивна | ||
| Ki = Ki' | () | без инхибиције | ||
| Ki ≠ Ki' | () | мешовита |
Нелинеарни регресиони фит података за ензимску кинетику према једначини[34] брзине реакције може водити тачној процени константи дисоцијација Ki и K'i.
Иреверзибилни инхибитори
[уреди | уреди извор]Дејство инхибитора може бити и иреверзибилно. Наиме, они могу изазвати трајну неактивност ензима и то обично преко промене ковалентних веза на активном месту. Ове реакције имају експоненцијално опадајући ток и обично су сатурационе. Пре сатурације, оне су реакције првог реда у односу на инхибитор.
Механизми катализе
[уреди | уреди извор]
Најчешће коришћен модел за интеракцију ензима и супстрата је индуковани фит модел.[35] По овом моделу почетна интеракција између ензима и супстрата је релативно слаба, али ова слаба интеракција брзо изазива конформационе промене ензима које омогућавају јаче везивање супстрата. Ове промене такође доводе каталитичке остатке на активна места у близини хемијске везе у супстрату, које ће бити промењене у реакцији.[36] Пошто се заврши везивање, један или више механизма катализе снижавају енергију прелазног стања, омогућавајући алтернативни пут реакције. Механизми катализе подразумевају катализу путем: деформације везе, приближавања и оријентације, путем протон-донора или протон-акцептора активних места, ковалентном катализом и квантним тунеловањем.[26][37]
Ензимска кинетика не може да покаже који је мод катализе коришћен од стране ензима. Ипак, неки кинетички подаци могу да предвиде могућности које могу бити испитиване другим техникама. На пример, пинг-понг механизам указује да би ковалентна катализа могла бити важна за ензимски механизам. Такође, уочен јак ефекат pH на Vmax али не на Km може да указује на то да остатак на активном месту мора да буде у одређеном јонизационом стању да би се каталитички процес одиграо.
Види још
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ Ebbing 1993
- ^ Danson 2002.
- ^ Xie, X. S.; Lu, H. P. (1999-06-04). „Single-molecule enzymology”. The Journal of Biological Chemistry. 274 (23): 15967—70. PMID 10347141. doi:10.1074/jbc.274.23.15967
 .
.
- ^ Lu, H. (2004). „Single-molecule spectroscopy studies of conformational change dynamics in enzymatic reactions”. Current Pharmaceutical Biotechnology. 5 (3): 261—9. PMID 15180547. doi:10.2174/1389201043376887.
- ^ Schnell J, Dyson H, Wright P (2004). „Structure, dynamics, and catalytic function of dihydrofolate reductase”. Annual Review of Biophysics and Biomolecular Structure. 33: 119—40. PMID 15139807. doi:10.1146/annurev.biophys.33.110502.133613.
- ^ (језик: енглески)Duggleby, R.G. Analysis of enzyme progress curves by non-linear regression. Methods in Enzymology, . 249 61-90.
- ^ Murray, J. B.; Dunham, C. M.; Scott, W. G. (2002-08-02). „A pH-dependent conformational change, rather than the chemical step, appears to be rate-limiting in the hammerhead ribozyme cleavage reaction”. Journal of Molecular Biology. 3 (8): 690—700. PMID 11779233. S2CID 18102624. doi:10.1006/jmbi.2001.5145.
- ^ (језик: енглески)Michaelis L. and Menten M.L. . „Kinetik der Invertinwirkung”. Biochem Z. 49: 333—369. 1913. Accessed 6 April 2007
- ^ Briggs, G. E.; Haldane, J. B. (1925). „A Note on the Kinetics of Enzyme Action”. The Biochemical Journal. 19 (2): 338—9. PMC 1259181
 . PMID 16743508. doi:10.1042/bj0190338.
. PMID 16743508. doi:10.1042/bj0190338.
- ^ а б Tseng, S. J.; Hsu, J. P. (1990-08-23). „A comparison of the parameter estimating procedures for the Michaelis-Menten model”. Journal of Theoretical Biology. 145 (4): 457—64. Bibcode:1990JThBi.145..457T. PMID 2246896. doi:10.1016/s0022-5193(05)80481-3.
- ^ Bravo, I. G.; Busto, F.; De Arriaga, D.; Ferrero, M. A.; Rodríguez-Aparicio, L. B.; Martínez-Blanco, H.; Reglero, A. (2001). „A normalized plot as a novel and time-saving tool in complex enzyme kinetic analysis”. The Biochemical Journal. 358 (Pt 3): 573—583. PMC 1222113
 . PMID 11577687. doi:10.1042/bj3580573.
. PMID 11577687. doi:10.1042/bj3580573.
- ^ Almaas, E.; Kovács, B.; Vicsek, T.; Oltvai, Z. N.; Barabási, A. L. (2004-02-26). „Global organization of metabolic fluxes in the bacterium Escherichia coli”. Nature. 427 (6977): 839—43. Bibcode:2004Natur.427..839A. PMID 14985762. S2CID 715721. arXiv:q-bio/0403001
 . doi:10.1038/nature02289.
. doi:10.1038/nature02289.
- ^ Reed, J. L.; Vo, T. D.; Schilling, C. H.; Palsson, B. O. (2003). „An expanded genome-scale model of Escherichia coli K-12 (IJR904 GSM/GPR)”. Genome Biology. 4 (9): R54. PMC 193654
 . PMID 12952533. doi:10.1186/gb-2003-4-9-r54.
. PMID 12952533. doi:10.1186/gb-2003-4-9-r54.
- ^ Dirr, H.; Reinemer, P.; Huber, R. (1994-03-15). „X-ray crystal structures of cytosolic glutathione S-transferases. Implications for protein architecture, substrate recognition and catalytic function”. European Journal of Biochemistry. 220 (3): 645—61. PMID 8143720. doi:10.1111/j.1432-1033.1994.tb18666.x.
- ^ Stone, S. R.; Morrison, J. F. (1988-07-26). „Dihydrofolate reductase from Escherichia coli: The kinetic mechanism with NADPH and reduced acetylpyridine adenine dinucleotide phosphate as substrates”. Biochemistry. 27 (15): 5493—9. PMID 3052577. doi:10.1021/bi00415a016.
- ^ Fisher, P. A. (1994). „Enzymologic mechanism of replicative DNA polymerases in higher eukaryotes”. Progress in Nucleic Acid Research and Molecular Biology. 47: 371—397. ISBN 9780125400473. PMID 8016325. doi:10.1016/s0079-6603(08)60257-3.
- ^ Akerman, S. E.; Müller, S. (2003-08-31). „2-Cys peroxiredoxin PFTRX-Px1 is involved in the antioxidant defence of Plasmodium falciparum”. Molecular and Biochemical Parasitology. 130 (2): 75—81. PMID 12946843. doi:10.1016/s0166-6851(03)00161-0.
- ^ (језик: енглески)Bravo, I.G., Barrallo, S., Ferrero, M. A., Rodríguez-Aparicio, L. B., Martínez-Blanco H., Reglero, A. "Kinetic properties of the Acylneuraminate Cytidylytransferase from Pasteurella haemolytica A2". Biochem. J. (2001) 358, 585-598.
- ^ Kraut, J. (1977). „Serine proteases: Structure and mechanism of catalysis”. Annual Review of Biochemistry. 46: 331—358. PMID 332063. doi:10.1146/annurev.bi.46.070177.001555.
- ^ Ricard, J.; Cornish-Bowden, A. (1987-07-15). „Co-operative and allosteric enzymes: 20 years on”. European Journal of Biochemistry. 166 (2): 255—72. PMID 3301336. doi:10.1111/j.1432-1033.1987.tb13510.x.
- ^ Ward, W. H.; Fersht, A. R. (1988-07-26). „Tyrosyl-tRNA synthetase acts as an asymmetric dimer in charging tRNA. A rationale for half-of-the-sites activity”. Biochemistry. 27 (15): 5525—30. PMID 3179266. doi:10.1021/bi00415a021.
- ^ Helmstaedt, K.; Krappmann, S.; Braus, G. H. (2001). „Allosteric regulation of catalytic activity: Escherichia coli aspartate transcarbamoylase versus yeast chorismate mutase”. Microbiology and Molecular Biology Reviews : MMBR. 65 (3): 404—21, table of contents. PMC 99034
 . PMID 11528003. doi:10.1128/MMBR.65.3.404-421.2001.
. PMID 11528003. doi:10.1128/MMBR.65.3.404-421.2001.
- ^ Schirmer, T.; Evans, P. R. (1990-01-11). „Structural basis of the allosteric behaviour of phosphofructokinase”. Nature. 343 (6254): 140—5. Bibcode:1990Natur.343..140S. PMID 2136935. S2CID 4272821. doi:10.1038/343140a0.
- ^ (језик: енглески)Hill, A. V. The possible effects of the aggregation of the molecules of haemoglobin on its dissociation curves. J. Physiol. (Lond.), 1910 40, iv-vii.
- ^ HARTLEY, B. S.; KILBY BA (фебруар 1954). „The reaction of p-nitrophenyl esters with chymotrypsin and insulin”. The Biochemical Journal. 56 (2): 288—97. PMC 1269615
 . PMID 13140189. doi:10.1042/bj0560288.
. PMID 13140189. doi:10.1042/bj0560288.
- ^ а б Fersht 1998
- ^ Bender, M. L.; Begué-Cantón, M. L.; Blakeley, R. L.; Brubacher, L. J.; Feder, J.; Gunter, C. R.; Kézdy, F. J.; Killheffer Jr, J. V.; Marshall, T. H.; Miller, C. G.; Roeske, R. W.; Stoops, J. K. (1966-12-20). „The determination of the concentration of hydrolytic enzyme solutions: Alpha-chymotrypsin, trypsin, papain, elastase, subtilisin, and acetylcholinesterase”. Journal of the American Chemical Society. 88 (24): 5890—913. PMID 5980876. doi:10.1021/ja00976a034.
- ^ Cleland, W. W. (2005-01-01). „The use of isotope effects to determine enzyme mechanisms”. Archives of Biochemistry and Biophysics. 433 (1): 2—12. PMID 15581561. doi:10.1016/j.abb.2004.08.027.
- ^ Northrop, D. (1981). „The expression of isotope effects on enzyme-catalyzed reactions”. Annu. Rev. Biochem. 50: 103—31. PMID 7023356. doi:10.1146/annurev.bi.50.070181.000535.
- ^ Baillie T, Rettenmeier A (1986). „Drug biotransformation: mechanistic studies with stable isotopes”. Journal of Clinical Pharmacology. 26 (6): 448—51. PMID 3734135. S2CID 39193680. doi:10.1002/j.1552-4604.1986.tb03556.x.
- ^ Cleland, W. W. (1982). „Use of isotope effects to elucidate enzyme mechanisms”. CRC Critical Reviews in Biochemistry. 13 (4): 385—428. PMID 6759038. doi:10.3109/10409238209108715.
- ^ Christianson, D. W.; Cox, J. D. (1999). „Catalysis by metal-activated hydroxide in zinc and manganese metalloenzymes”. Annual Review of Biochemistry. 68: 33—57. PMID 10872443. doi:10.1146/annurev.biochem.68.1.33.
- ^ Kraut D, Carroll K, Herschlag D (2003). „Challenges in enzyme mechanism and energetics”. Annu. Rev. Biochem. 72: 517—71. PMID 12704087. doi:10.1146/annurev.biochem.72.121801.161617.
- ^ Leatherbarrow, R. J. (децембар 1990). „Using linear and non-linear regression to fit biochemical data”. Trends in Biochemical Sciences. 15 (12): 455—8. PMID 2077683. doi:10.1016/0968-0004(90)90295-m.
- ^ Koshland, D. E. (1958). „Application of a Theory of Enzyme Specificity to Protein Synthesis”. Proceedings of the National Academy of Sciences of the United States of America. 44 (2): 98—104. Bibcode:1958PNAS...44...98K. PMC 335371
 . PMID 16590179. doi:10.1073/pnas.44.2.98
. PMID 16590179. doi:10.1073/pnas.44.2.98  .
.
- ^ Hammes, G. (2002). „Multiple conformational changes in enzyme catalysis”. Biochemistry. 41 (26): 8221—8. PMID 12081470. doi:10.1021/bi0260839.
- ^ Sutcliffe M, Scrutton N (2002). „A new conceptual framework for enzyme catalysis. Hydrogen tunnelling coupled to enzyme dynamics in flavoprotein and quinoprotein enzymes”. Eur. J. Biochem. 269 (13): 3096—102. PMID 12084049. doi:10.1046/j.1432-1033.2002.03020.x. Архивирано из оригинала 08. 11. 2006. г. Приступљено 30. 05. 2007.
Литература
[уреди | уреди извор]- Danson, Eisenthal R. M.J. (Eds) (2002). Enzyme Assays: A Practical Approach. Oxford University Press. ISBN 978-0-19-963820-8.
- Ebbing, D. D. (1993). General chemistry (4th изд.). Houghton Mifflin Co. ISBN 978-0-395-63696-1.
- Fersht, Alan (1998). Structure and Mechanism in Protein Science: A Guide to Enzyme Catalysis and Protein Folding. W. H. Freeman. ISBN 978-0-7167-3268-6.
- Athel Cornish-Bowden (2004). Fundamentals of Enzyme Kinetics (3rd изд.). Portland Press.
- Segel, Irwin H. (1993). Enzyme Kinetics: Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems. Wiley-Interscience; New Ed edition.
- Maini, P. K.; Schnell, S. (2003). „A Century of Enzyme Kinetics: Reliability of the K M and v max Estimates”. Comments on Theoretical Biology. 8 (2–3): 169—187. doi:10.1080/08948550302453.
- Bugg, Tim (2004). An Introduction to Enzyme and Coenzyme Chemistry. Blackwell Publishing. ISBN 978-1-4051-1452-3.
- Price, Nicholas; Stevens, Lewis (1999). Fundamentals of Enzymology. Oxford University Press. ISBN 978-0-19-850229-6.
- Walsh, Chris (1979). Enzymatic Reaction Mechanisms. W. H. Freeman and Company.
Спољашње везе
[уреди | уреди извор]
- Animation of an enzyme assay Shows effects of manipulating assay conditions.
- MACiE A database of enzyme reaction mechanisms.
- ENZYME Expasy enzyme nomenclature database.
- ExCatDB A database of enzyme catalytic mechanisms.
- BRENDA Архивирано на сајту Wayback Machine (11. децембар 2008) Comprehensive enzyme database, giving substrates, inhibitors and reaction diagrams.
- SABIO-RK A database of reaction kinetics.
- Joseph Kraut's Research Group, University of California San Diego. Superb animations of several enzyme reaction mechanisms.
- Symbolism and Terminology in Enzyme Kinetics, A comprehensive explanation of concepts and terminology in enzyme kinetics.
- An introduction to enzyme kinetics An accessible set of on-line tutorials on enzyme kinetics.


![{\displaystyle {\begin{matrix}v=k_{2}[{\mbox{ES}}]\end{matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/befe56463761168b47df5be5bfa796c6d3f6a7dd)
![{\displaystyle [{\mbox{E}}]_{tot}\ {\stackrel {\mathrm {def} }{=}}\ [{\mbox{E}}]+[{\mbox{ES}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e723eb321d042825c947f9b8e0f744fda6c74f73)
![{\displaystyle v={\frac {V_{max}[{\mbox{S}}]}{K_{m}+[{\mbox{S}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5c10f2bf1084df37a7d7da00198c23d8095e9f9a)
![{\displaystyle {\frac {d}{dt}}[{\mbox{ES}}]=k_{1}[{\mbox{E}}][{\mbox{S}}]-k_{2}[{\mbox{ES}}]-k_{-1}[{\mbox{ES}}]\approx 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ebef645de7f075d9999fba79d30e40568a63a5c7)
![{\displaystyle [{\mbox{ES}}]\approx {\frac {[{\mbox{E}}]_{tot}[{\mbox{S}}]}{[{\mbox{S}}]+K_{m}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a9425177562bf79b3e086de1277d92f7491fe0d9)
![{\displaystyle K_{m}\ {\stackrel {\mathrm {def} }{=}}\ {\frac {k_{2}+k_{-1}}{k_{1}}}\approx {\frac {[{\mbox{E}}][{\mbox{S}}]}{[{\mbox{ES}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/428e7c1efa5baf314c725f64da8b0ef44c0034c3)
![{\displaystyle v=k_{2}[\mathrm {ES} ]={\frac {k_{2}[{\mbox{E}}]_{tot}[{\mbox{S}}]}{[{\mbox{S}}]+K_{m}}}={\frac {V_{max}[{\mbox{S}}]}{[{\mbox{S}}]+K_{m}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a9684acdfe5ef1343e2bf7dea6cbd0a81cf8f774)


![{\displaystyle v=k_{2}[\mathrm {ES} ]={\frac {k_{2}}{K_{m}}}[{\mbox{E}}][{\mbox{S}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ce445b17dc8f27b81e07db99d3532af0be5c53ee)
![{\displaystyle {\frac {1}{v}}={\frac {K_{m}}{V_{max}[{\mbox{S}}]}}+{\frac {1}{V_{max}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7271b5f19abb33ea11c518ab87f98a1d3a0ab10)
![{\displaystyle \alpha =1+{\frac {[{\mbox{I}}]}{K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7d05bffbc19ef9047581c87887ae0eea5c11e7fe)
![{\displaystyle \alpha ^{\prime }=1+{\frac {[{\mbox{I}}]}{K_{i}^{\prime }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e8b2033b5725a8b85d7425d409192cf11885c199)









