Džon Dalton
| Džon Dalton | |
|---|---|
 Džon Dalton | |
| Lični podaci | |
| Datum rođenja | 6. septembar 1766. |
| Mesto rođenja | Iglsfild, Velika Britanija |
| Datum smrti | 27. jul 1844. (77 god.) |
| Mesto smrti | Mančester, Ujedinjeno Kraljevstvo |
| Naučni rad | |
| Polje | fizika |
| Potpis | |




Džon Dalton (6. septembar 1766 — Mančester, 27. jul 1844) je bio engleski fizičar i hemičar. Rodio se u Iglsfildu 1766. godine, a umro u Mančesteru 1844. Zbog doprinosa razvoju atomske teorije smatra se jednim od utemeljitelja savremenoga prirodoslovlja. U knjizi Novi sistem hemijske filozofije (engl. New System of Chemical Philosophy, I, 1808., II, 1810.}-) pretpostavio je da se hemijski elementi sastoje od malih neuništivih čestica, atoma. Time je utemeljio atomsku teoriju građe materije, utvrdivši da se svaki hemijski element sastoji od atoma iste vrste, dok se hemijska jedinjenja sastoje od različitih atoma. Uveo je posebne simbole za hemijske elemente i jedinjenja i dao pregled relativnih atomskih masa. Proučavajući zakonitosti hemijskog spajanja, 1802. godine je otkrio zakon umnoženih masenih odnosa, a 1807. i zakon parcijalnih pritisaka (Daltonov zakon).
Dalton je počeo kao učitelj, a postao je istaknut naučnik: kao meteorolog zabeležio je oko 20.000 stručnih zapažanja; kao fizičar izmerio je pritisak vodene pare pri raznim temperaturama; kao hemičar je odredio težinske odnose u kojima pojedine materije stupaju u jedinjenja i tako doprineo stvaranju osnove učenja o atomima. Ali, njegovo ime ostalo je vezano i za jednu manu vida od koje je i sam patio: on nije razlikovao izvesne boje (crvenu i zelenu), koje su se njemu činile kao jedna ista boja. To slepilo za boje po njemu je dobilo ime daltonizam i prilično je rašireno. Stoga je, na primer, neophodno da svetla na semaforima budu svugde u istom rasporedu, te da se po položaju mogu raspoznati, a ne samo po boji.
Kako je bio slep za boje, proučavao je tu anomaliju, koja je po njemu nazvana daltonizam. Premda su se neki Daltonovi zaključci pokazali pogrešnim (na primer predodžba o nedeljivosti atoma, koja je pobijena otkrićem radioaktivnoga raspada), njegova atomska teorija i predodžba o atomskim masama elemenata imaju ogromno značenje za razvoj fizike i hemije.[1]
Životopis[uredi | uredi izvor]
Dalton je u školi bio marljiv i uporan učenik, vešt u računanju. Kad je smrću učitelja škola zatvorena, Dalton je sa 18 godina otvorio svoju školu u napuštenom seniku, a zatim u Domu kvekera. Prvo se bavio meteorologijom, a zatim hemijom. Učio je i podučavao, osim matematike i fizike, englesku gramatiku, grčki, latinski i francuski jezik. S 22 godine razmišljao je o studiranju prava ili medicine, ali zbog odsustva podrške porodice, te zbog činjenice da je neistomišljenicima studiranje ili predavanje na engleskim fakultetima bilo zabranjeno ipak nije, te je 1793. prihavatio poziciju na mančesterskom Novom koledžu, disidentskoj akademiji (direktnom prethodnik, nakon niza promena mesta, Haris mančesterskog koledža, Oksford). Tamo je ostao 34. godine, kada ga je sve lošija finansijska situacija na fakultetu dovela do toga da podnese ostavku i započne novu karijeru kao privatni učitelj matematike i prirodne filozofije.
Godine 1803, on je predložio svoje principe atomske teorije (uveo je pojam atomske težine, tačnije, relativne atomske mase, uzevši kao standard atom vodonika (H), jer je najlakši i pripisao mu je atomsku masu 1[2], sugerirajući da su svi elementi sastavljeni od sitnih, neuništivih čestica, zvanih atomi, koji su svi jednaki i imaju istu masu. Atomi nekog elementa mogu pri hemijskoj reakciji ući u sastav hemijskog jedinjenja ili izaći iz njega, međutim njihova ukupna masa u sitemu ostaje nepromenjena. Dalton je pretpostavio da je vodonik najlakši element te je uveo pojam relativne atomske mase (Ar) kao odnos mase atoma elementa i mase atoma vodonika. Takođe je proučavao slepoću na boje (daltonizam).[3]
Doprinosi[uredi | uredi izvor]
Atomska teorija[uredi | uredi izvor]
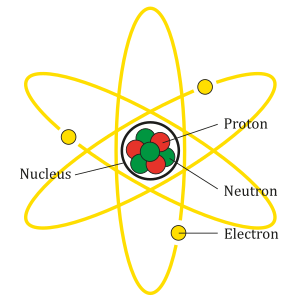
U atomskoj teoriji materije, atom se sastoji od atomskog jezgra oko kojeg kruže elektroni. Danas je generalno priznato mišljenje da se atomska jezgra svih hemijskih elemenata sastoje od pozitivno naelektrisanih protona i neutrona koji nemaju električni naboj. Čestice koje se nalaze u atomskom jezgru, to jest protoni i neutroni, zovu se zajedničkim imenom nukleoni (lat. nucleus: jezgro). Neutron ima masu gotovo jednaku masi protona. Proton je jezgro vodonikovog atoma, te mu je masa jednaka masi atoma vodonika. Broj protona u atomskom jezgru koji se zove atomski broj, jednak je njegovom električnom naboju i uvek odgovara rednom broju hemijskog elementa u periodnom sistemu. Atomskim brojem je određena vrsta hemijskog elementa.
U neutralnom atomu broj elektrona koji kruže oko jezgra jednak je broju protona u jezgru. Pozitivan naboj jednog protona jednako je velik kao negativan naboj elektrona. 1869. ruski hemičar D. I. Mendeljejev otkrio je zakonitost ponavljanja hemijskih svojstva elemenata kod povećanja njihove atomske mase. On je tada sve poznate elemente poređao po rastućim atomskim masama jedan iznad drugoga i sastavio periodičnu tablicu. Mendeljejev je dokazao da svaki hemijski element ima određen sastav atoma koji označava atomska masa i mesto u periodnom sistemu elemenata.
Broj protona P i neutrona N u jezgru određuju atomsku masu A datog elementa, t.j.:
i zove se maseni broj atoma. Na primer jezgro helijuma sastoji se od dva protona i dva neutrona. Prema tome je električni naboj jezgra i redni broj helijuma 2, a relativna atomska masa 4. Oko atomskog jezgra kruže negativno nabijeni elektroni, a broj elektrona jednak je broju protona u jezgru.
Za dati broj protona u jezgru mogu postojati različite količine neutrona. Dva atoma koji imaju isti broj protona, a različiti broj neutrona, imaju skoro ista hemijska svojstva i isti redni broj, ali različite atomske mase. Takvi se elementi koji imaju isti redni broj, a različitu atomsku masu, zovu izotopi. Tako na primer postoji hlor koji ima redni broj 17, to jest njegovo jezgro sadrži 17 protona, dok mu je atomska masa 35, što znači da jezgro njegovog atoma sadrži 18 neutrona (17 + 18 = 35). Međutim, postoji i hlor s atomskom masom 37, to jest jezgro njegovog atoma sadrži 20 neutrona (17 + 20 = 37). Običan hlor koji se nalazi u jedinjenjima u prirodi ima atomsku masu 35,46, što znači da je on smeša ta dva izotopa koji su u njemu zastupani u odnosu 3 : 1, to jest:
Prvi izotop hlora se simbolički piše 17Cl35, a drugi 17Cl37. Gornji broj uz hemijski simbol elementa znači relativnu atomsku masu tog elementa, a donji - broj protona u jezgru tog elementa, odnosno njegov redni broj. Vodonik takođe ima svoje izotope: 1H1 obični vodonik, 1H2 teški vodonik ili deuterijum i 1H3 tricijum.
Ovakvi izotopi nađeni su gotovo kod svih hemijskih elemenata. Tako uranijum, koji je najvažniji u dobijanju nuklearne energije, ima 5 izotopa. Uranijum ima redni broj 92, a njegovi izotopi imaju atomske mase 234, 235, 237, 238 i 239. U prirodnom uranijumu najjače je zastupljen izotop s atomskom masom 238. Njega ima 137 puta više nego izotopa s atomskom masom 235. Ostalih njegovih izotopa ima još i manje. Izotopi se danas veoma mnogo primenjuju u medicini, tehnici i privredi, a naročito su veoma važni u proizvodnji nuklearne energije. Odeljivanje izotopa vrši se centrifugiranjem, destilacijom, difuzijom i tako dalje.
Da se jezgro atoma koja se sastoji od pozitivno nelektrisanih protona ne bi raspalo, jer se istoimeni električni naboji međusobno odbijaju, deluju privlačne sile koje vladaju između protona i neutrona. To su takozvane sile jezgra ili osnovne sile koje, iako su vrlo velike, deluju samo na vrlo male daljine, to jest u dimenzijama atomskpg jezgra. Tumačenje tih sila spada danas u glavne probleme atomske fizike.[4]
Relativna atomska masa[uredi | uredi izvor]
Relativna atomska masa (oznaka Ar) je svojstvena veličina svakog hemijskog elementa (stariji naziv: atomska težina). To je broj koji pokazuje koliko je puta prosečna masa atoma nekog elementa veća od 1/12 mase atoma ugljenikova izotopa 12C, to jest to je odnos između prosečne mase atoma nekog hemijskog elementa i unifikovane atomske jedinice mase. Izražavanje atomskih masa relativnim jedinicama uveo je 1803. Džon Dalton, koji je za mernu jedinicu uzeo vodonikov atom kao najlakši od svih atoma i dodelio mu vrednost 1 (kasnije je kao jedinica služila i 1/16 mase atoma kiseonikovog izotopa 16O). Takvo je izražavanje uvedeno iz praktičnih razloga, jer su mase atoma izvanredno male (na primer masa vodonikovog atoma je 1,673 · 10−27 kg). Kako se većina hemijskih elemenata u prirodi pojavljuje u obliku smeše svojih izotopa, relativne atomske mase odgovaraju srednjoj vrednosti relativnih masa atoma prisutnih izotopa, te zato redovno nisu celi brojevi. Merna jedinica relativne atomske mase je broj jedan (1).[5]
Daltonov zakon[uredi | uredi izvor]
Daltonov zakon govori o pritiscima pojedinih vrsta gasova u smeši gasova, a glasi:
Pritisak smeše gasova jednak je zbiru parcijalnih pritisaka gasova koji čine smešu
Parcijalni pritisak određenog gasa u smeši, je onaj pritisak koji bi taj gas imao kada bi sam zauzimao zapreminu, koji zauzima smeša. Daltonov zakon omogućava odredivanje parcijalnih pritisaka gasova prisutnih u atmosferi, poznavanjem njihovih udela u atmosferskom vazduhu. Tako, ako je kiseonik prisutan u vazduhu sa udelom od 21%, tada je njegov parcijalni pritisak 21% od ukupnog pritiska vazduha.
Matematički, Daltonov zakon se može pisati:
- ili
Gde p1, p2, ...., pn – prestavlja parcijalne pritiske pojedinih sastojaka smeše gasova. Pretpostavlja se da gasovi međusobno hemijski ne reaguju:
gde je pi – parcijalni pritisak pojedinog gasa, yi – udeo pojedinog gasa u smeši.
Daltonov zakon ne opisuje u potpunosti realne gasove. Razlike su pogotovo velike kod visokih pritisaka, kada su molekuli vrlo blizu jedni drugima, te dolaze do izražaja međumolekularne sile, i menjaju vrednost pritiska.
Daltonizam[uredi | uredi izvor]
Daltonizam je slepoća za boje, potpuna ili delimična nemogućnost raspoznavanja boja. U mrežnjači postoje tri vrste receptora (osetnih ćelija) za boje (za crvenu, zelenu i plavu boju, a ostale boje nastaju mešanjem tih osnovnih), od kojih svaka sadrži pigment osetljiv na određenu talasnu dužinu svetlosti. Osoba s normalnim raspoznavanjem boje (trikromat) ima sva tri pigmenta u pravilnim odnosima, dihromati razlikuju samo dve temeljne boje (obično zamjenjuju crvenu boju zelenom), a monokromati uopšte ne razlikuju boje. Daltonizam je najčešće urođen (8% muškaraca i 1% žena) i nedostupan je lečenju.
Reference[uredi | uredi izvor]
- ^ Dalton, John, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2018.
- ^ Filipović, Lipanović: "Opća i anorganska kemija", 9. izd., Školska knjiga, Zagreb, 1995., ISBN 953-0-30907-4, str.36.
- ^ Claus Bernet: John Dalton (1766. - 1844), Biographisches-bibliographisches Kirchenlexikon, 31, 2010., 309.-332.
- ^ Velimir Kruz: "Tehnička fizika za tehničke škole", "Školska knjiga" Zagreb, 1969.
- ^ Relativna atomska masa, [2] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2018.
Literatura[uredi | uredi izvor]
- Greenaway, Frank (1966). John Dalton and the Atom. Ithaca, New York: Cornell University Press.
- Henry, William C. (1854). Memoirs of the Life and Scientific Researches of John Dalton. London: Cavendish Society. Pristupljeno 21. 7. 2018.
- Hunt, D. M.; Dulai, K. S.; Bowmaker, J. K.; Mollon, J. D. (1995). „The Chemistry of John Dalton's Color Blindness”. Science. 267 (5200): 984—988. Bibcode:1995Sci...267..984H. PMID 7863342. S2CID 6764146. doi:10.1126/science.7863342.
- Lonsdale, Henry (1874). The Worthies of Cumberland: John Dalton. George Routledge and Sons: George. Pristupljeno 24. 12. 2007.
- Millington, John Price (1906). John Dalton. London: J. M. Dent & Company. Pristupljeno 21. 7. 2018.
- Patterson, Elizabeth C. (1970). John Dalton and the Atomic Theory. Garden City, New York: Anchor.
- Rocke, Alan J. (2005). „In Search of El Dorado: John Dalton and the Origins of the Atomic Theory”. Social Research. 72 (1): 125—158. JSTOR 40972005.
- Roscoe, Henry E. (1895). John Dalton and the Rise of Modern Chemistry. London: Macmillan. Pristupljeno 24. 12. 2007.
- Roscoe, Henry E.; Harden, Arthur (1896). A New View of the Origin of Dalton's Atomic Theory. London: Macmillan. ISBN 978-1-4369-2630-0. Pristupljeno 24. 12. 2007.
- Smith, R. Angus (1856). Memoir of John Dalton and History of the Atomic Theory. London: H. Bailliere. ISBN 978-1-4021-6437-8. Pristupljeno 24. 12. 2007.
- Smyth, A. L. (1998). John Dalton, 1766–1844: A Bibliography of Works by and About Him, With an Annotated List of His Surviving Apparatus and Personal Effects. ISBN 978-1-85928-438-4.- Original edition published by Manchester University Press in 1966
- Thackray, Arnold (1972). John Dalton: Critical Assessments of His Life and Science
 . Harvard University Press. ISBN 978-0-674-47525-0.
. Harvard University Press. ISBN 978-0-674-47525-0.
Spoljašnje veze[uredi | uredi izvor]
 Stephen, Leslie, ur. (1888). „Dalton, John (1766-1844)”. Rečnik nacionalne biografije. 13. London: Smith, Elder & Co.
Stephen, Leslie, ur. (1888). „Dalton, John (1766-1844)”. Rečnik nacionalne biografije. 13. London: Smith, Elder & Co.





