Периодни систем

| Део серије чланака о |
| периодном систему |
|---|
Периодни систем је табеларни приказ хемијских елемената, распоређених на основу њиховог атомског броја (број протона), електронске конфигурације и понављајућих хемијских особина. Овакав распоред показује периодичне законе, а пример су елементи са сличним карактеристикама смештени у истој колони. Такође се разликују и четири правоугаона блока са одређеним, приближно сличним хемијским особинама. У принципу, унутар једног реда (периоде) елемената метали су на левој, а неметали на десној страни.
Редови периодног система називају се периоде, а колоне се називају групе. Шест група има своја имена, као и бројеве; на пример: елементи 17. групе су халогени, док су елементи 18. групе племенити гасови. Периодни систем може да се користи за извођење односа између својстава различитих елемената, те предвиђање својстава нових елемената који се откривају или синтетишу. Периодни систем пружа користан оквир за анализирање хемијских карактеристика материје и широко се користи у хемији, физици и другим наукама.
Руски хемичар Дмитриј Мендељејев је 1869. године објавио први општепризнат периодни систем. Свој систем развио је да би илустровао периодичне законе и својства тада познатих елемената. Мендељејев је такође предвидио нека својства тада непознатих елемената, за које се очекивало да ће да попуне празнине у овом систему. Већина његових предвиђања се показала тачним када су поменути елементи касније откривени. Мендељејевљев периодни систем од тада је знатно проширен и прерађен откривањем или синтетисањем додатних нових елемената, као и развојем нових теоретских модела за објашњавање хемијских принципа.
Сви елементи од атомског броја 1 (водоник) до 118 (оганесон) откривени су или синтетисани, а последње проширење периодног система (нихонијум, московијум, тенесин и оганесон; именовани 28. новембра 2016) Међународна унија за чисту и примењену хемију (IUPAC) потврдила је 30. децембра 2015. године; првих седам редова периодног система је комплетирано.[1][2] Прва 94 елемента постоје природно, иако се неки могу пронаћи само у траговима и били су синтетисани у лабораторијама пре него што су пронађени у природи.[н. 1] Елементи са атомским бројем из интервала 95—118 једино су синтетисани у лабораторијама или нуклеарним реакторима.[3] Синтеза елемената који имају веће атомске бројеве је оно чему хемичари тренутно теже. Бројни синтетички радиоизотопи елемената који се природно појављују такође су произведени у лабораторијама.
Преглед[уреди | уреди извор]
| Група | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Алкални метали | Земноалкални метали | Пниктогени | Халкогени | Халогени | Племенити гасови | ||||||||||||||
| Периода |
|||||||||||||||||||
| 2 | |||||||||||||||||||
| 3 | |||||||||||||||||||
| 4 | |||||||||||||||||||
| 5 | |||||||||||||||||||
| 6 | |||||||||||||||||||
| 7 | |||||||||||||||||||
1 (црвена) = гасовито 3 (црна) = чврсто 80 (зелена) = течно 109 (сива) = непознато Боја атомског броја показује агрегатно стање (на 0 °C и 1 atm)
- Ca: 40,078 — формална кратка вредност, заокружено (нема несигурности)[5]
- Po: [209] — масени број најстабилнијег изотопа
Боја позадине показује поткатегорију у метално-металоидно-неметалном тренду:
| Метал | Металоид | Неметал | Непозната хемијска својства | |||||||
| Алкални метал | Земноалкални метал | Лантаноид | Актиноид | Прелазни метал | Постпрелазни метал | Полиатомски неметал | Диатомски неметал | Племенити гас | ||
Сваки хемијски елемент има јединствен атомски број (Z), који представља број протона у његовом језгру.[н. 2] Већина елемената има различит број неутрона у различитим атомима, а ове варијанте се називају изотопима. На пример, угљеник има три изотопа која се природно појављују: сви његови атоми имају шест протона и већина има шест неутрона такође, али око један проценат има седам неутрона (постоји и веома мали број са осам неутрона). Изотопи се никада не издвајају у периодном систему; они се увек групишу заједно с појединим елементом. Елементи који немају стабилних изотопа имају атомске масе својих најстабилнијих изотопа, а уколико су такве масе приказане — исте се налазе у заградама.[6]
У стандардном периодном систему, елементи се ређају растуће према свом атомском броју (број протона у језгру атома). Нови ред (периода) започиње се када нова електронска љуска добије свој први електрон. Колоне (групе) одређене су електронском конфигурацијом атома; елементи са истим бројем електрона у појединој подљусци сврставају се у исте колоне (нпр. кисеоник и селен су истој колони јер оба имају по четири електрона у својој спољашњој, p-подљусци). Елементи са сличним хемијским својствима генерално се сврставају у исте групе периодног система, с тим да у f-блоку и одређеним деловима d-блока елементи и у истој периоди такође теже поседовању сличних својстава. Према томе, релативно је лако предвидети хемијска својства елемента ако су позната својства елемената који га окружују.[7]
Периодни систем је на крају 2016. године имао 118 потврђених елемената; елемент број 1 је водоник, а елемент број 118 је оганесон. Елементе 113, 115, 117 и 118 званично је потврдила Међународна унија за чисту и примењену хемију (скр. IUPAC) децембра 2015. године.[1] Предложена имена за ове елементе — нихонијум (Nh), московијум (Mc), тенесин (Ts) и оганесон (Og) — IUPAC је објавио јуна 2016. године;[8] формално их је потврдио по истеку петомесечног јавног рока за расправу, новембра 2016. године.[9] До тада, ови елементи морали су да се формално идентификују својим атомским бројем (нпр. „елемент 113”) или својим привременим систематским именом (нпр. „унунтријум”, симбол „Uut”).[10]
Прва 94 елемента се појављују у природи; остала 24 елемента, од америцијума до оганесона (95—118), добијају се само синтетисањем у лабораторијама. Од 94 елемента која се налазе природно, 83 су примордијална док осталих 11 може да се пронађе само у ланцима распадања примордијалних елемената.[3] Ниједан елемент тежи од ајнштајнијума (елемент 99) никада није посматран у макроскопским количинама у својој чистој форми, а исти је случај и са астатом (елемент 85); францијум (елемент 87) био је једино фотографисан у облику светла емитованог у микроскопским количинама (300.000 атома).[11]
Методи груписања[уреди | уреди извор]
Групе[уреди | уреди извор]
Група или породица је вертикална колона у периодном систему. Групе обично имају значајније периодичне законе од периода и блокова, што је објашњено испод. Модерне теорије квантне механике за атомску структуру објашњавају групне законе предлажући да елементи у истој групи генерално имају исту електронску конфигурацију у својој валентној љусци.[12] Следствено томе, елементи у истој групи теже поседовању сличних хемијских особина и огледају исте законе у својствима како се атомски број повећава.[13] Међутим, у неким деловима периодног система — као што је d-блок и f-блок — хоризонталне сличности могу да буду важне исто као или више наглашене него вертикалне сличности.[14][15][16]
Према међународним конвенцијама за именовање, групе се нумерички означавају бројевима од 1 до 18 почев од крајње леве колоне (алкални метали) према крајњој десној колони (племенити гасови).[17] Пре овог начина означавања, користили су се римски бројеви. У Америци, римски бројеви су били попраћени словом A ако је група била у s-блоку или p-блоку, односно словом B ако је група била у d-блоку. Римски бројеви користили су одговарајућу варијанту за последњу цифру из данашњег начина означавања (нпр. елементи 4. групе били су група IV B, док су елементи 14. групе били група IV A). У Европи, означавање словима било је готово исто, изузев правила да се користи A ако је група пре 10. групе, односно B ако је група 10. или нека после ње. Поред овога, групе 8, 9 и 10 су се сматрале једном групом троструке величине, колективно познатом на оба континента као група VIII. Нови систем именовања IUPAC је увео у употребу 1988. године, када стара имена за групе постају превазиђена.[18]
Одређене групе добиле су тривијална (несистематска) имена, што се може видети у табели испод, с тим да се нека ретко користе. Групе 3—10 немају тривијалних имена и о истима се говори једноставно помињући бројеве њихових чланова или само име првог члана (пример је алтернативни назив „скандијумова група” за 3. групу), и то зато што огледају мање сличности и/или вертикалних законитости.[17]
Елементи у истој групи показују одређене узорке у погледу атомског радијуса, енергије јонизације и електронегативности. Идући од врха ка дну групе, атомски радијус елемената се повећава. Пошто постоји више попуњених енергетских нивоа, валентни електрони се проналазе даље од језгра. Од врха, сваки узастопни елемент има нижу енергију јонизације зато што је лакше уклонити електрон (јер су атоми слабије везани). Слично томе, у групи се примећује смањење електронегативности идући с врха према дну због повећавања растојања између валентних електрона и језгра.[19] Међутим, постоје и изузеци од ових законитости; пример оваквог одступања је 11. група, где се електронегативност повећава идући ка дну групе.[20]
| IUPAC | 1 | 2 | 3a | a | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Мендељејев (I—VIII) | I | II | III | IV | V | VI | VII | VIII | I | II | III | IV | V | VI | VII | b | ||||
| CAS (САД, A–B–A) | IA | IIA | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | ||||
| Заст. IUPAC (Европа, A–B) | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIII | IB | IIB | IIIB | IVB | VB | VIB | VIIB | 0 | ||||
| Тривијално име |
Алкални метали | Земноалкални металиr | Ковни метали | Тријели | Тетрели | Пниктогениr | Халкогениr | Халогениr | Племенити гасовиr | |||||||||||
| Име по елементуr | Литијумова група | Берилијумова група | Скандијумова група | Титанијумова група | Ванадијумова група | Хромова група | Манганова група | Гвожђева група | Кобалтова група | Никлова група | Бакрова група | Цинкова група | Борова група | Угљеникова група | Азотова група | Кисеоникова група | Флуорова група | Хелијумова или неонова група | ||
| 1. периода | Hh | He | ||||||||||||||||||
| 2. периода | Li | Be | B | C | N | O | F | Ne | ||||||||||||
| 3. периода | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||
| 4. периода | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||
| 5. периода | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||
| 6. периода | Cs | Ba | La | Ce—Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7. периода | Fr | Ra | Ac | Th—Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
b Група 18, племенити гасови, није била откривена у време Мендељејевљевог оригиналног система. Касније (1902), Мендељејев је прихватио доказ за њихово постојање; могу се ставити у нову „0. групу”.
r Име групе по препоруци IUPAC-а.
h Водоник (H), иако се налази у 1. колони, не сматра се делом групе алкалних метала.
Периоде[уреди | уреди извор]
Периода је хоризонтални ред у периодном систему. Иако групе генерално имају значајније периодичне законе, постоје региони где су хоризонталне законитости битније од оних који се вежу за групе; пример је f-блок, где лантаноиди и актиноиди формирају два значајна хоризонтална низа елемената.[22]
Елементи у истој периоди показују узорке у погледу атомског радијуса, енергије јонизације, електронског афинитета и електронегативности. Идући слева надесно кроз периоде, атомски радијус обично опада. Ово се дешава зато што сваки узастопни елемент има протон и електрон више, што узрокује веће привлачење и приближавање електрона језгру.[23] Ово смањење у величини атомског радијуса такође узрокује повећање у енергији јонизације идући слева надесно кроз периоде. Што је елемент јаче везан, већа енергија је потребна да би се уклонио електрон. Електронегативност се повећава на исти начин као и енергија јонизације због привлачне силе која делује на електроне из језгра.[19] Електронски афинитет такође показује приметан тренд када се пролази периодама; метали (лева страна периода) обично имају нижи електронски афинитет од неметала (десна страна периода), са изузетком племенитих гасова.[24]
Блокови[уреди | уреди извор]

Одређени региони периодног система могу да се назову блоковима, а одређују се према редоследу по ком се попуњавају електронске љуске елемената. Сваки блок је име добио према подљусци у којој „последњи” електрон појмовно обитава.[25][н. 3] s-блок обухвата прве две групе (алкални и земноалкални метали), те водоник и хелијум. p-блок обухвата последњих шест група, а то су групе 13—18 у IUPAC-овом систему означавања (3A—8A у америчком систему означавања); поред осталих елемената, у овом блоку су смештени сви металоиди. d-блок обухвата групе 3—12 (или 3B—2B према америчкој конвенцији) и садржи све прелазне метале. f-блок, углавном приказан испод главног дела периодног система, нема чланова група и обухвата лантаноиде и актиноиде.[26]
Метали, металоиди и неметали[уреди | уреди извор]

Према физичким и хемијским особинама које деле, елементи се могу сврстати у три велике категорије: метали, металоиди и неметали. Метали су углавном сјајне, добро проводљиве чврсте твари које једна с другом формирају легуре и с неметалима јонска једињења налик соли (осим племенитих гасова). Већина неметала су обојени или безбојни непроводљиви гасови; неметали који формирају једињења с другим неметалима стварају ковалентне везе. Између метала и неметала налазе се металоиди, који имају просечна или измешана својства.[27]
Метали и неметали могу да се додатно класификују у поткатегорије које показују градацију од својстава метала до својстава неметала, идући редовима слева надесно. Метали су додатно подељени у високо реактивне алкалне метале, преко мање реактивних земноалкалних метала, лантаноида и актиноида те архетипских прелазних метала, све до физички и хемијски слабих постпрелазних метала. Неметали су једноставно подељени на полиатомске неметале (који, како су најближи металоидима, показују неке почетне карактеристике метала), диатомске неметале (који су суштински неметали) и моноатомске племените гасове (који су потпуно неметали и готово скроз инертни). Специјализована груписања као што су рефракторни метали и племенити метали, која су ниже јединице (у овом примеру) прелазних метала, такође су препозната[28] и повремено у употреби.[29]
Разврставање елемената у категорије и поткатегорије на основу својстава која деле је несавршено. Постоји спектар својстава унутар сваке од категорија и није тешко пронаћи преклапања на границама, као што је то случај и с већином класификационих шема.[30] Берилијум, на пример, сврстан је у земноалкалне метале иако су његова амфотеричка хемија и тенденција ка формирању ковалентних једињења атрибути хемијски слабих или постпрелазних метала. Радон је сврстан у групу неметала, а племенити гас и упркос томе има многа својства катјонске хемије која је карактеристичнија за метале. Друге шеме за класификацију такође су могуће, а пример је подела елемената у категорије минералошких учесталости или кристалних структура. Категоризација елемената на начине сличне овима датира најмање до 1869. године, када је Хинрихс[31] написао да једноставне граничне линије могу да се нацртају на периодном систему како би се означили елементи са сличним својствима, као што су метали и неметали или елементи у гасовитом стању.
Периодични трендови и обрасци[уреди | уреди извор]
Периодични закони или закони периодичности (енгл. periodic trends) представљају законитости које произилазе из упоредбе својстава хемијских елемената у погледу понављајућих (периодичних) карактеристика. Ту се убрајају валентни електрони, атомски радијуси, енергија јонизације, електронегативност, електронски афинитет те метална и неметална својства. Повећање или смањење својстава која су одређена овим законитостима може да се примети при проласку кроз редове и колоне периодног система, а саме законитости одређене су теоријама структуре атома.
Електронска конфигурација[уреди | уреди извор]

Електронска конфигурација или организација електрона који круже око неутралних атома показује понављајуће узорке или периодичност. Електрони попуњавају низове електронских љуски (нумерисаних као 1. љуска, 2. љуска итд.). Свака љуска се састоји из једне или више подљуски (именованих словима s, p, d, f и g). Како се атомски број повећава, електрони прогресивно попуњавају ове љуске и подљуске мање-више пратећи Маделунгово правило или правило о енергетском редоследу, као што је приказано на дијаграму. Електронска конфигурација за неон, на пример, записује се као 1s2 2s2 2p6. Са атомским бројем 10, неон има 2 електрона у својој првој љусци те 8 електрона у својој другој љусци (2 у њеној s-подљусци и 6 у њеној p-подљусци). Повезујући ово с периодним системом, може се рећи да када електрон по први пут попуни нову љуску — почиње нова периода; ове позиције заузимају водоник и алкални метали.[32][33]

Пошто својства елемента у већем делу одређује његова електронска конфигурација, својства елемената тако показују понављајуће узорке или периодично понашање, а неки од примера приказани су у дијаграмима испод за атомске радијусе, енергију јонизације и електронски афинитет. Управо је ова периодичност својстава, чије су манифестације биле и често примећиване пре него што је њихова фундаментална теорија развијена, довела до успостављања периодичног закона (чињенице да се елементи понављају у различитим интервалима) и формирања првих периодних система.[32][33]
Атомски радијуси[уреди | уреди извор]
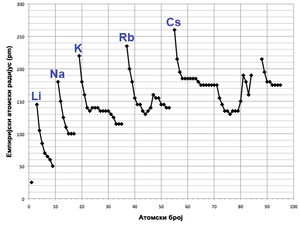
Атомски радијуси варирају на предвидљив и објашњив начин крећући се периодним системом. На пример, радијуси се генерално смањују дуж сваке од 7 периода система, од алкалних метала до племенитих гасова; радијуси се повећавају идући низ сваку од 18 група. Радијуси се повећавају нагло између племенитих гасова и краја сваке од периода те алкалних метала и почетка следеће периоде. Овакви узорци у величини за атомске радијусе (и у разним другим хемијским и физичким својствима елемената) могу да се објасне теоријом електронске љуске атома; овиме су пружени важни докази за развијање и потврђивање квантне теорије.[34]
Електрони у 4f-подљусци, која се прогресивно пуни идући од церијума (елемент 58) до итербијума (елемент 70), нису нарочито ефективни у очувању пораста нуклеарног набоја пружајући отпор другим спољашњим подљускама. Елементи који следе одмах након лантаноида имају атомске радијусе који су мањи него што се то очекује и који су готово једнаки атомским радијусима елемената смештених одмах изнад.[35] Тако хафнијум има виртуелно исти атомски радијус (и хемију) као и цирконијум, тантал има атомски радијус готово једнак оном ниобијума итд. Ово је познато као лантаноидна контракција. Ефекат лантаноидне контракције може да се примети све до платине (елемент 78), после чега бива замаскиран релативистичким ефектом познатим као ефекат инертног пара.[36] Контракција d-блока, која представља сличан ефекат између d-блока и p-блока, мање је наглашена него лантаноидна контракција али се јавља услед сличног узрока.[35]
Енергија јонизације[уреди | уреди извор]

Прва енергија јонизације је енергија потребна да се уклони један електрон из атома, друга енергија јонизације је енергија потребна да се уклони други електрон из атома итд. За дати атом, узастопне енергије јонизације повећавају се степеном јонизације. За магнезијум, на пример, прва енергија јонизације је 738 kJ/mol, а друга је 1450 kJ/mol. Електрони у ближим орбиталама привлаче се већим силама електростатичког деловања; према томе, њихово уклањање из атома захтева више енергије јер су смештени на вишим енергетским нивоима. Енергија јонизације се повећава идући нагоре и надесно у периодном систему.[36]
Велики скокови у узастопним моларним енергијама јонизације јављају се при уклањању електрона из конфигурације племенитог гаса (комплетна електронска љуска). За магнезијум, поново, прве две моларне енергије јонизације дате изнад одговарају изузимању два 3s-електрона, док је трећа енергија јонизације много већа (7730 kJ/mol) и потребна је да се изузме 2p-електрон из веома стабилне конфигурације коју има Mg2+ и која је налик оној неона. Сличан скок у енергијама јонизације јавља се и код других атома 3. реда.[36]
Електронегативност[уреди | уреди извор]

Електронегативност је тенденција атома да привлачи електроне.[37] Електронегативност атома одређује и његов атомски број и растојање између валентних електрона и језгра. Што је електронегативност већа, елемент више привлачи електроне. Овај принцип је 1932. године први предложио Лајнус Полинг.[38] Уопштено говорећи, електронегативност се повећава идући слева надесно дуж периода, а смањује спуштајући се низ групе. Стога, флуор је најелектронегативнији од свих елемената,[н. 5] док је цезијум најмање електронегативан елемент (барем од оних за које су признати експериментални резултати доступни).[20]
Постоји неколико изузетака од овог општег правила. Галијум и германијум имају веће електронегативности од алуминијума и силицијума (редом) због присутности ефекта контракције d-блока. Елементи 4. периоде одмах испод првог реда прелазних метала имају необично мале атомске радијусе зато што 3d-електрони нису ефективни у очувању повећаног нуклеарног набоја, а мања атомска величина повезује се с већом електронегативношћу.[20] Неуобичајено висока електронегативност олова, поготово при упоредби с талијумом и бизмутом, верује се да је артефакт одабира података (и њихове доступности) — методи рачунања који се разликују од Полинговог метода показују нормалне периодичне законе за ове елементе.[39]
Електронски афинитет[уреди | уреди извор]

Електронски афинитет атома или афинитет према електрону је количина енергије која се отпусти када се електрон дода на неутралан атом да би се створио негативни јон (анјон). Иако електронски афинитет увелико варира, појављују се и одређени узорци. Генерално говорећи, неметали имају позитивније вредности електронског афинитета него метали. Хлор најјаче привлачи додатни електрон. Електронски афинитети племенитих гасова нису измерени с поузданим вредностима, тако да можда имају а можда и немају вредности које залазе на леву страну бројевне линије.[42]
Електронски афинитет се обично повећава идући дуж периоде. Ово је узроковано попуњавањем валентних љуски атома; при примању електрона атом 17. групе отпушта више енергије него атом 1. групе јер поседује попуњену валентну љуску и према томе је стабилнији.[42]
Тренд опадања афинитета према електрону како се иде низ групе очекивана је појава. Додатни електрон ће да попуни орбиталу која је даље од језгра. Тако ће тај електрон да се слабије привлачи према језгру и ослобођена енергија при његовом додавању ће да буде мања. Међутим, идући ка дну групе, око једна трећина елемената показује аномалију: тежи елементи имају веће електронске афинитете од својих суседних лакших сродника. Ово је увелико због слабог пружања отпора од стране d и f електрона. Једнообразан пад у електронском афинитету једино се може уочити код атома 1. групе.[43]
Метални карактер[уреди | уреди извор]
Што су вредности енергије јонизације, електронегативности и електронског афинитета мање, елемент има више металног карактера. Вреди и обратно: неметаличност се повећава порастом три претходно поменута фактора.[44] Узимајући у обзир периодичне законе који управљају овим факторима, метални карактер се смањује идући дуж периода (или редова) и с неколико неправилности — (углавном) због лошег скрининга језгра од стране d и f електрона те релативистичких ефеката[45] — тежи повећавању идући низ групе (или колоне/породице). Према томе, елементи с највише металних својстава (као што су цезијум и францијум) смештени су у доњем левом углу традиционалних периодних система, док су елементи с највише неметалних својстава (као што су кисеоник, флуор и хлор) смештени у горњем десном углу. Комбинација хоризонталних и вертикалних законитости у металном карактеру објашњава степенасто обликовану граничну линију између метала и неметала која може да се уочи на неким периодним системима, као и неретко категорисање неколико елемената који леже на тој линији или елемената који су суседни претходно поменутима (као што су металоиди).[46][47]
Повезујуће или групе премоснице[уреди | уреди извор]
| Периодни систем са 32 колоне са приказаним, слева надесно, локацијама: 3. групе, лутецијума и лоренцијума, 11. и 12. групе, те племенитих гасова |
Идући слева надесно преко четири блока дугог периодног система (или система у формату са 32 колоне), налазе се серије ’повезујућих’ или ’премошћавајућих’ група елемената, смештених отприлике између сваког блока.[48] Ове групе, као и металоиди, имају својства између или као и групе са страна. Хемијски гледано, елементи 3. групе (скандијум, итријум, лантан и актинијум) понашају се баш као земноалкални метали[49] или — уопштеније разматрајући — као метали s-блока[50][51] али са нешто физичких својстава прелазних метала d-блока.[52] Лутецијум и лоренцијум, на крају f-блока, могу да чине другу везујућу или групу премосницу. Лутецијум се хемијски понаша као лантаноид али поседује мешавину физичких својстава лантаноида и прелазних метала.[53][54] Лоренцијум, као аналоган лутецијуму, по свој прилици одражава сличне карактеристике.[н. 6] Ковни метали у 11. групи (бакар, сребро и злато) хемијски су у стању да се понашају или као прелазни метали или као метали главне групе.[57] Испарљиви метали 12. групе (цинк, кадмијум и жива) понекад се сматрају премосницом од d-блока до p-блока. Номинално ово су елементи d-блока, али имају нешто својстава прелазних метала и понашају се више као своји суседи из p-блока у 13. групи.[58][48] Релативно инертни племенити гасови, у 18. групи, премошћавају најреактивније групе елемената у периодном систему — халогене у 17. групи и алкалне метале у 1. групи.[48]
Историја[уреди | уреди извор]
Први покушаји систематизације[уреди | уреди извор]

Антоан Лавоазје је 1789. године објавио списак 33 хемијска елемента, групишући их у гасове, метале, неметале и земље (енгл. earths).[59] Хемичари цео следећи век проводе трагајући за прецизнијом класификационом шемом... Јохан Волфганг Деберајнер је 1829. године уочио да многи елементи могу да се групишу у тројства (енгл. triads), и то на основу њихових хемијских својстава. Литијум, натријум и калијум, на пример, заједно су груписани у тројство као меки реактивни метали. Деберајнер је такође уочио да је — при распоређивању према атомској тежини — други члан сваког тројства грубо просек првог и трећег;[60] ово је постало познато као Закон тројстава (енгл. Law of triads).[61] Немачки хемичар Леополд Гмелин радио је користећи овај принцип, а до 1843. године идентификовао је десет тројстава, три групе од четири елемента те једну групу од пет елемената. Жан-Батист Дима објавио је 1857. године рад у ком је описао односе између различитих група метала. Иако су многи хемичари били у стању да идентификују односе између малих група елемената, и даље је било неопходно створити једну шему која ће да обухвати све елементе.[60]
Немачки хемичар Аугуст Кекуле, посматрајући угљеник је схватио да овај елемент најчешће има четири друга атома везана за себе. Метан, примера ради, има један атом угљеника и четири атома водоника.[62] Овај концепт је на крају постао познат као валентност или валенц(иј)а; различити елементи вежу се с различитим бројем атома.[63]
Александар-Емил Бегејер де Шанкуртоа, француски геолог, 1862. године је објавио један од првих облика периодног система; назвао га је телурни хеликс/вијак (франц. hélix/vis tellurique, енгл. telluric helix/screw). Де Шанкуртоа је био прва особа која је уочила периодичност елемената. Размештајући елементе спирално на цилиндар, растуће према атомској тежини, он је показао да се елементи са сличним својствима углавном појављују у правилним интервалима. Његов дијаграм је садржавао и неке јоне и једињења поред елемената. У раду је користио више геолошке него хемијске термине и у исти није укључио дијаграм; као резултат, није задобијено много интересовања све док Дмитриј Мендељејев није објавио свој рад.[64]
Јулијус Лотар Мејер, немачки хемичар, 1864. године је објавио периодни систем с 44 елемента распоређена према валентности. У табели се видело да елементи са сличним својствима најчешће имају исту валентност.[65] Вилијам Одлинг, енглески хемичар, упоредо с Мејером је објавио свој систем с 57 елемената распоређених према њиховим атомским тежинама. Уз неколико неправилности и пропуста, он је међу елементима уочио нешто налик на периодичност атомских тежина те да је ово усклађено с „њиховим углавном стеченим груписањима”.[66] Одлинг је био надомак открића периодичног закона, али истраживање није успео да спроведе до краја.[67] Накнадно, 1870. године, предложио је класификацију елемената на основу њихове валентности.[68]

Џон Њуландс, енглески хемичар, направио је низ пројеката у периоду 1863—1866. године; открио је да при распоређивању елемената према растућој вредности њихових атомских тежина — слична физичка и хемијска својства почињу да се понављају у интервалу броја осам. Ову периодичност он је упоредио са октавама у музици.[69][70] Овај таконазвани Закон октава, међутим, исмејала је велика већина Њуландсових савременика и Хемијско друштво је тако одбило да објави његов рад.[71] Њуландс је упркос овоме успео да направи систем елемената и искористи га за предвиђање постојања елемената који су недостајали, као што је то случај с германијумом.[72] Хемијско друштво је одало признање важности његових открића тек пет година након што су заслуге припале Мендељејеву.[73]
Густавус Хинрихс, академски хемичар данског порекла који је живео у Америци, 1867. године је објавио спирални периодни систем заснован на атомским спектрима и тежинама те хемијским сличностима. Његов рад је окарактерисан као „идиосинкратичан, остентативан и лавиринтан”, што је негативно допринело препознавању и прихватању истог.[74][75]
Мендељејевљев систем[уреди | уреди извор]

Руски професор хемије Дмитриј Мендељејев и немачки хемичар Јулијус Лотар Мејер независно су објавили своје периодне системе 1869. и 1870. године, редом.[76] Мендељејевљев систем је била његова прва објављена верзија; Мејеров је био проширена верзија његовог (Мејеровог) система из 1864. године.[77] Обојица су своје системе конструисали размештајући елементе у редове или колоне према атомској тежини и почињући нови ред или колону када се карактеристична својства елемената почну понављати (периодичност).[78]
Најзначајнији српски хемичар који је међу првима у свету прихватио Мендељејевљев систем био је Сима Лозанић (1847—1935).[79] Препознавање и прихватање које је задобио Мендељејевљев систем у свету је произашло из двеју одлика које је он направио. Прва је било остављање простора у систему када се могло увидети да одговарајући елемент још увек није откривен.[80] Мендељејев није био први хемичар који је поступио овако, али је био први препознат по коришћењу законитости у свом периодном систему за предвиђање својстава оних елемената који су били неоткривени (као што је то галијум или германијум).[81] Друга одлука је било повремено игнорисање редоследа који је произилазио из атомских тежина и замењивање места неким суседним елементима (као што је телур и јод), да би се исти боље класификовали у хемијске породице. Енглески физичар Хенри Мозли је нешто касније, 1913. године, одредио експерименталне вредности нуклеарног набоја односно атомски број појединог елемента, те је показао да Мендељејевљев размештај заиста одговара растућем распоређивању према атомским бројевима.[82]
Значај атомских бројева за организацију периодног система није био толико примећен све док постојање и својства протона и неутрона нису била схваћена. Мендељејевљев периодни систем је користио атомску тежину уместо атомског броја за распоређивање елемената, што је била информација до које се могло доћи поприлично тачно у то време. Атомска тежина је послужила како треба у већини случајева да би се (како је истакнуто) добила представа о предвиђању својстава неоткривених елемената тачније него било којим другим тада познатим методом. Замена атомских бројева, када је постала разумљива, за елементе је дала дефинитивни низ заснован на целим бројевима. Мозли је 1913. године (погрешно) предвидео да су једини елементи који недостају између алуминијума (13) и злата (79) елементи 43, 61, 72 и 75; како год, ови елементи су до данас ипак сви откривени. Низ атомских бројева се користи и дан-данас када се нови, синтетички елементи „вештачки” праве и потом проучавају у лабораторијама.[83]
Друга верзија и даљи развој[уреди | уреди извор]


Мендељејев је 1871. године објавио свој периодни систем у новом облику, с групама сличних елемената распоређеним у колоне а не редове; те колоне биле су означене римским бројевима (од I до VIII), што је одговарало стању оксидације појединог елемента. Такође је изнео детаљна предвиђања што се тиче својстава елемената за које је раније истакао да су неоткривени али да би требало да постоје.[84] Ове празнине су накнадно попуњаване јер су хемичари откривали додатне елементе који се могу наћи у природи.[85] Општеприхваћено је да је последњи елемент који се може наћи у природи био францијум (Мендељејев га је називао ека-цезијум), откривен 1939. године.[86] Међутим, плутонијум који је синтетички произведен годину после, 1971. године је идентификован у траговима као елемент који може да се пронађе у природи.[87]
Популарни[25] изглед периодног система, такође познат и као уобичајена или стандардна форма (приказана у многим деловима овог чланка), може да се припише Хорасу Гроувсу Демингу. Наиме, амерички хемичар Деминг је 1923. године објавио два периодна система: један у кратком (Мендељејевљев стил) и један у средњем (18 колона) облику.[88][н. 7] Merck and Company израдио је брошурну форму Деминговог средњег система са 18 колона 1928. године, а ова верзија користила се веома много у америчким школама. До тридесетих година 20. века Демингов систем се нашао у многим приручницима и енциклопедијама из хемије. Такође је дистрибуисан дужи период од стране компаније Sargent-Welch Scientific.[89][90][91]
Развијањем модерних теорија квантне механике за електронске конфигурације унутар атома, постало је очигледно да свака периода (ред) у периодном систему одговара попуњености квантне љуске електронима. Већи атоми имају више електронских подљуски, тако да су касније настали системи захтевали прогресивно дуже периоде.[92]

Глен Сиборг, амерички научник, 1945. године је дао предлог да се актиноидски елементи (као што су лантаноиди) сматрају поднивоом блока f. Пре овога, актиноиди су чинили четврти ред d-блока. Сиборгове колеге су га саветовале да не објављује тако радикалан предлог јер би му то веома лако могло да упропасти каријеру. Пошто је Сиборг сматрао да тада и није имао каријеру која би могла да се уништи, он је одлучио супротно; предлог се показао исправним и 1951. године Сиборг за свој рад на синтетисању актиноидских елемената осваја Нобелову награду за хемију.[93][94][н. 8]
Иако се неколицина одређених трансуранијумских елемената налази у природи,[3] сви ови елементи су прво откривени у лабораторијама. Њихова производња проширила је периодни систем у значајној мери, а први елемент који је додат као синтетички био је нептунијум (1939. године).[95] Пошто су многи трансуранијумски елементи веома нестабилни и распадају се доста брзо, детектовање односно одређивање својстава истих након производње представља прави изазов. Постојале су бројне контроверзе што се тиче прихватања назива одређених елемената који су се откривали у кратким временским размацима, а тада је било неопходно дати независно мишљење које име има приоритет те приписати откриће правој особи или тиму. Претпоследњи елементи који су прихваћени и именовани су били флеровијум (елемент 114) и ливерморијум (елемент 116), а оба су своје име добила 31. маја 2012. године.[96] Удруженим снагама руско-америчких научника из Дубне (Московска област, Русија), синтетисано је шест атома тенесина; ово је најновије откриће хемијских елемената који су се уврстили у периодни систем под именима које је одредио и као последње прихваћене и именоване елементе 28. новембра 2016. године званично потврдио/именовао IUPAC: нихонијум (елемент 113), московијум (елемент 115), тенесин (елемент 117) и оганесон (елемент 118).[97][98]
Елементи 113, 115, 117 и 118 су формално препознати 30. децембра 2015. године од стране IUPAC-а, чиме је комплетиран седми ред периодног система.[1][99] Званична имена и симболи за сваки од ових елемената, који су заменити привремене ознаке као што су унунпентијум (Uup) у случају елемента 115, били су објављени у току 2016. године. IUPAC је 8. јуна 2016. године објавио предложена имена за сваки од елемената. Нихонијум (симбол Nh) било је предложено име за елемент 113 јер је откривен у RIKEN-у у Јапану. Ово је први елемент који је добио име по локацији у источној Азији. Елемент 115 је имао предложено име московијум (симбол Mc) по локацији Обједињеног института за нуклеарна истраживања у Москви (Русија). Елемент 117 имао је предложено име тенесин (симбол Ts), што се односи на државу Тенеси у САД која је дом Националне лабораторије Оук Риџ. На крају, елемент 118 имао је предложено име оганесон (симбол Og), у част руског нуклеарног физичара Јурија Оганесјана који је предводио тим који је синтетисао овај елемент.[100][101]
Различити периодни системи[уреди | уреди извор]
Дуги или систем са 32 колоне[уреди | уреди извор]

Модерни периодни систем се некад проширује у дуги односно формат с 32 колоне, умећући елементе f-блока из фусноте на њихову ’природну’ позицију између s и d блока. За разлику од формата са 18 колона, овакав размештај резултује спречавањем „[сваког] прекидања у низу растућих атомских бројева”.[102] Однос између f-блока и осталих блокова периодног система такође постаје јасније видљив.[103]
Џенсен заговара формат система с 32 колоне, истичући важност чињенице да лантаноиди и актиноиди у осталим случајевима у главама ученика или студената испадају досадни, неважни елементи који се могу негде одложити и игнорисати.[104]
Упркос овим предностима, формат с 32 колоне углавном се избегава на рачун неуобичајеног правоугаоног омјера (при упоредби са омјером странице у књизи и сл.),[105] али и чињенице да су хемичари навикнути много више на модерни формат (који је увео Сиборг).[106]
Системи с различитим структурама[уреди | уреди извор]
У току стогодишњег периода након настанка Мендељејевљевог система 1869. године, процењено је да је објављено око 700 различитих верзија периодног система.[107] Поред најбројнијих правоугаоних варијација, обликовани су и периодни системи у неким другим форматима; најзначајнији примери укључују[н. 9] кружне, коцкасте, цилиндричне, квадарске, спиралне, лемнискатне,[108] осмоуганопризмне, пирамидалне, сферичне, троугаоне и друге верзије. Овакви алтернативни системи се најчешће развијају да би се назначила или истакла хемијска или физичка својства елемената која се у традиционалним периодним системима не могу лако уочити.[107]

Популарни[109] алтернативни формат је систем Теодора Бенфија (1960). Елементи су размештени по непрекинутој спирали, водоник је у центру, а прелазни метали, лантаноиди и актиноиди на ’полуострвима’.[110]
Велика већина периодних система је дводимензионална;[3] међутим, тродимензионални системи су познати још најмање од 1862. године (пре настанка Мендељејевљевог дводимензионалног система 1869. године). Новији примери укључују Куртинову „Периодну класификацију” (енгл. Courtines' "Periodic Classification") из 1925. године,[111] Ринглијев „Ламина систем” (енгл. Wringley's "Lamina System") из 1949. године,[112] Жигеров „Периодни хеликс” (енгл. Giguère's "Periodic helix") из 1965. године[113] и Дуфорово „Периодно стабло” (енгл. Dufour's "Periodic Tree") из 1996. године.[114] Усудивши се отићи корак даље, Тимоти Стоу је 1989. године осмислио „Периодни систем физичара” (енгл. Stowe's "Physicist's Periodic Table")[115] који наводно представља четвородимензионални периодни систем (има три просторне димензије и боју као димензију више, мада већина система данас изгледа баш овако).[116]
Различити облици периодног система могу да се сматрају плодом хемијско-физичког континуума.[117] Приближавајући се хемијском крају континуума, могуће је пронаћи — примера ради — Рејнер-Канамов ’непослушни’[118] „Периодни систем неорганског хемичара” (енгл. Rayner-Canham's 'unruly' "Inorganic Chemist's Periodic Table") из 2002. године,[119] у ком је нагласак на законитостима и узорцима те необичним хемијским односима и својствима. Близу физичког краја континуума је Жанеов „Левостепенасти периодни систем” (енгл. Janet's "Left-Step Periodic Table") из 1928. године; овај систем има структуру која показује блискију везу с редоследом попуњавања електронских љуски и тиме квантном механиком.[120] Донекле сличан приступ имао је и Алпер,[121] с тим да је његов дизајн искритиковао Скери оптужујући га за занемаривање потребе да се прикаже хемијска и физичка периодичност.[122] Негде у средини континуума је свеприсутни уобичајени или стандардни облик периодног система, у ком је циљ боље представити емпиријске законитости у погледу физичког стања, електричне и топлотне проводљивости те оксидационе бројеве, као и друга својства лако изводљива традиционалним техникама у хемијској лабораторији.[123] Његова популарност је, како се верује, резултат чињенице да овај формат има добар баланс одлика у погледу лакоће израде и величине, те представљања атомског реда и законитости периодичности.[124][125]
| f1 | f2 | f3 | f4 | f5 | f6 | f7 | f8 | f9 | f10 | f11 | f12 | f13 | f14 | d1 | d2 | d3 | d4 | d5 | d6 | d7 | d8 | d9 | d10 | p1 | p2 | p3 | p4 | p5 | p6 | s1 | s2 | |
| 1s | H | He | ||||||||||||||||||||||||||||||
| 2s | Li | Be | ||||||||||||||||||||||||||||||
| 2p 3s | B | C | N | O | F | Ne | Na | Mg | ||||||||||||||||||||||||
| 3p 4s | Al | Si | P | S | Cl | Ar | K | Ca | ||||||||||||||||||||||||
| 3d 4p 5s | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | Rb | Sr | ||||||||||||||
| 4d 5p 6s | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | Cs | Ba | ||||||||||||||
| 4f 5d 6p 7s | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | Fr | Ra |
| 5f 6d 7p 8s | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | 119 | 120 |
| f-блок | d-блок | p-блок | s-блок | |||||||||||||||||||||||||||||
У стварности, попуњавање електронских љуски карактерише низ неправилности.
Отворена питања и контроверзе[уреди | уреди извор]
Позиција водоника и хелијума[уреди | уреди извор]
Једноставно пратећи електронске конфигурације, водоник (1s1) и хелијум (1s2) требало би да се налазе у 1. и 2. групи, изнад литијума ([He] 2s1) и берилијума ([He] 2s2).[25] Међутим, такво распоређивање ова два елемента се ретко користи ван контекста електронских конфигурација. Када су племенити гасови (тада под називом „инертни гасови”) први пут откривени око 1900. године, били су познати као „0. група” јер нису одражавали никакву хемијску реактивност оних елемената који су били познати у то време, а хелијум је био смештен на врху те групе зато што је делио огромну хемијску инертност која се могла видети и код других елемената ове групе. Како је група променила свој формални број, многи аутори су наставили да стављају хелијум директно изнад неона, дакле у 18. групу; један од примера таквог распоређивања је и тренутни периодни систем који користи IUPAC.[126]
Хемијска својства водоника нису веома блиска онима алкалних метала који заузимају 1. групу, а на основу тога водоник се понекад ставља на неку другу позицију: једна од најчешћих алтернатива је 17. група;[122] један од фактора који на ово утичу је стриктно унивалентна, преовлађујуће неметална хемија водоника, док је она флуора (елемент који се налази на врху 17. групе) стриктно унивалентна и неметална такође. Каткада, да би се показало како водоник има особине које одговарају онима и алкалних метала и халогена, овај елемент може да се нађе приказан у две колоне истовремено.[127] Други предлог је позиција изнад угљеника у 14. групи: распоређен на овај начин, водоник се добро уклапа у тренд растућих потенцијалних вредности јонизације и вредности електронског афинитета те не одудара много ни од законитости електронегативности (мада водоник не може да покаже тетравалентне карактеристике тежих елемената 14. групе).[128] У коначници, водоник може да се смести засебно од свих група; овакав принцип заснива се на чињеници да се опште особине водоника разликују од особина елемената из свих група: за разлику од водоника, остали елементи 1. групе показују веома јако изражена метална својства; елементи 17. групе углавном стварају соли (одакле и долази термин халоген); елементи преосталих група показују мултивалентнију хемију. Други елемент 1. периоде, хелијум, такође се некада издваја из свих група и ставља на засебну позицију.[129] Својство које разликује хелијум од остатка племенитих гасова (иако је невероватна инертност хелијума веома близу оној неона и аргона)[130] представља чињеница да у својој затвореној електронској љусци хелијум има два електрона у спољашњој електронској орбитали, док остатак племенитих гасова у овој љусци има осам електрона.
Група 3 и њени елементи у 6. и 7. периоди[уреди | уреди извор]
Иако су скандијум и итријум увек прва два елемента 3. групе, идентитет следећа два елемента није у потпуности јединствено прихваћен. Најчешће су то лантан и актинијум, а ређе лутецијум и лоренцијум. Две варијанте воде порекло из историјских тешкоћа да се лантаноиди сместе у периодни систем, те аргумената о томе где елементи f-блока почињу а где завршавају.[106][н. 10][н. 11] Тврдило се да су овакви аргументи доказ да је „грешка растављати [периодни] систем у оштро разграничене блокове”.[132] Трећа варијанта је приказ двеју позиција испод итријума са ознаком за лантаноиде и актиноиде.
Постоје изнесени физички и хемијски аргументи који иду више у корист лутецијума и лоренцијума,[106][133] али далеко од тога да се сви аутори слажу са овим одабиром.[134] Већина хемичара који активно раде и није свесна да постоји икаква контроверза.[135] IUPAC је децембра 2015. године покренуо један пројекат с циљем изналаска оптималног решења по питању овог проблема, како би могла да се изда и званична препорука.[136]
Лантан и актинијум[уреди | уреди извор]
Лантан и актинијум се најчешће приказују као последња два члана 3. групе.[137][138][н. 12] Истиче се чињеница да је овакав одабир направљен још четрдесетих година 20. века те да се изглед периодних система ослања на електронске конфигурације елемената и појам диференцијације електрона. Конфигурације цезијума, баријума и лантана су (редом) [Xe] 6s1, [Xe] 6s2 и [Xe] 5d1 6s2. Лантан тако има 5d-диференцирајући електрон и ово га смешта у „3. групу на место првог члана d-блока за 6. периоду”.[139] Доследан низ електронских конфигурација тада може да се примети у 3. групи и чине га скандијум ([Ar] 3d1 4s2), итријум ([Kr] 4d1 5s2) и лантан ([Xe] 5d1 6s2). Како год, у 6. периоди итербијум има електронску конфигурацију [Xe] 4f13 5d1 6s2, а лутецијум [Xe] 4f14 5d1 6s2; резултат је „добијање 4f-диференцирајућег електрона за лутецијум и основано распоређивање истог на место последњег члана f-блока за 6. периоду”.[139] Каснијим спектроскопским испитивањем откривено је да је електронска конфигурација итербијума заправо [Xe] 4f14 6s2. Ово је значило да и итербијум и лутецијум (лутецијум који има конфигурацију [Xe] 4f14 5d1 6s2) имају 14 f-електрона; резултат је „добијање d-диференцирајућег а не f-диференцирајућег електрона” за лутецијум, што га за позицију у 3. групи испод итријума чини „једнако валидним кандидатом” као што је и лантан ([Xe] 5d1 6s2).[139] Како год, лантан има предност да буде на овом положају јер се 5d1-електрон појављује први пут у његовој структури, док се тек трећи пут по реду јавља код лутецијума (кратко друго јављање је било код гадолинијума).[140]
Што се тиче хемијског понашања[141] и трендова низ 3. групу за својства као што су тачка топљења, електронегативност и јонски радијус,[142][143] скандијум, итријум, лантан и актинијум су налик својим панданима из 1—2. групе. У овој варијанти, број f-електрона код најчешћих (тривалентних) јона елемената f-блока доследно се поклапа с њиховим позицијама у f-блоку.[144] На пример, број f-електрона за тривалентне јоне првих трију елемената f-блока износи 1 (Ce), 2 (Pr) и 3 (Nd).[145]
Лутецијум и лоренцијум[уреди | уреди извор]
У осталим системима, лутецијум и лоренцијум се приказују као последња два члана 3. групе.[146][н. 13] Прве технике за хемијско издвајање скандијума, итријума и лутецијума ослањају се на чињеницу да су се ови елементи појављивали заједно у такозваној „итријумовој групи”, док су се лантан и актинијум појављивали заједно у „церијумовој групи”.[139] Узимајући ово у обзир, многи хемичари су се двадесетих и тридесетих година 20. века одлучивали за лутецијум наспрам лантана као један од елемената 3. групе.[н. 14] Неколико физичара се педесетих и шездесетих година 20. века определило за лутецијум, у светлу успоређивања неколико физичких својстава овог елемента с физичким својствима која карактеришу лантан.[139] Такав размештај у ком је лантан први члан f-блока оспоравало је неколико аутора јер лантан нема ниједан f-електрон. Међутим, заговарала се и идеја да ово није валидан противаргумент јер постоје и друге аналогне аномалије периодног система; најбољи пример је торијум, зато што овај елемент нема ниједан f-електрон а опет се налази у поменутом f-блоку.[147] Што се тиче лоренцијума, његова гасовита атомска електронска конфигурација потврђена је тек 2015. године и гласи [Rn] 5f14 7s2 7p1. Оваква конфигурација представља још једну аномалију периодног система, независно од тога да ли је лоренцијум смештен у f-блоку или d-блоку, а разлог је постојање једне потенцијално применљиве позиције у p-блоку која је већ била резервисана за нихонијум с предвиђеном конфигурацијом [Rn] 5f14 6d10 7s2 7p1.[148][н. 15]
Хемијски гледано, скандијум, итријум и лутецијум (и по свој прилици лоренцијум) понашају се као тривалентне верзије метала 1—2. групе.[150] С друге стране, трендови низ групу за својства као што је тачка топљења, електронегативност и јонски радијус, слични су онима која се могу наћи код њихових пандана из 4—8. групе.[139] У овој варијанти, број f-електрона код гасовитих облика атома f-блока обично се поклапа с њиховим позицијама у f-блоку. На пример, број f-електрона за првих пет елемената f-блока износи 0 (La), 1 (Ce), 3 (Pr), 4 (Nd) и 5 (Pm).[139]
Лантаноиди и актиноиди[уреди | уреди извор]
Неколицина аутора смешта свих тридесет лантаноида и актиноида на две позиције испод итријума (обично користећи фуснотне ознаке). У овој варијанти наглашавају се сличности у хемији 15 лантаноидних елемената (La—Lu), можда на рачун двосмислености око питања који елементи заузимају две позиције испод итријума у 3. групи те 15 колона широког f-блока (иако само 14 елемената може да буде у било ком од редова f-блока).[н. 16]
Групе укључене у прелазне метале[уреди | уреди извор]
Дефиниција прелазног метала коју даје IUPAC је да је то сваки елемент чији атом има некомплетну d-подљуску или који може да се доведе у стање катјона с некомплетном d-подљуском.[151] Према овој дефиницији, сви елементи у групама 3—11 су прелазни метали. IUPAC-ова дефиниција из категорије прелазних метала искључује, дакле, елементе 12. групе, што обухвата цинк, кадмијум и живу.
Неки хемичари користе категорије „елемената d-блока” и „прелазних метала” као синониме, тиме директно укључујући елементе група 3—12 међу прелазне метале. У овом случају, елементи 12. групе се третирају као посебан случај прелазних метала код којих d-електрони обично немају способност стварања хемијске везе. Извештај из 2007. године о жива(IV)-флуориду (HgF4), једињењу у којем жива хипотетички користи своје d-електроне за везивање, навело је неке научнике на излагање предлога о томе да и жива може да се третира као прелазни метал.[152] Остали научници, као на пример Џенсен,[153] истицали су чињеницу да до формације једињења као што је HgF4 може да дође само под високо абнормалним условима; штавише, постојање истог је тренутно оспорено. Према томе, жива не може да се сматра прелазним металом ни према једној разумној интерпретацији уобичајеног значења овог термина.[153]
С друге стране, неки хемичари искључују елементе 3. групе из дефиниције прелазног метала. То чине на основу тога што елементи 3. групе не формирају ниједан јон с нарочито заузетом d-љуском и тако не одражавају нити једну од карактеристика хемије прелазних метала.[154] У овом случају, само елементи група 4—11 убрајају се у прелазне метале. Како год, иако елементи 3. групе показују мало карактеристичних хемијских својстава прелазних метала — исти показују значајан број карактеристичних физичких својстава (на рачун постојања у сваком атому појединог d-електрона).[52]
Елементи с непознатим хемијским особинама[уреди | уреди извор]
Иако су сви до оганесона до сада откривени, од елемената после хасијума (елемент 108) само коперницијум (елемент 112), нихонијум (елемент 113) и флеровијум (елемент 114) имају познате хемијске особине односно својства; само за коперницијум тренутно постоји довољно доказа за коначну категоризацију. Остали елементи се можда понашају другачије у односу на оно што екстраполација предвиђа, и то због релативистичких ефеката; на пример, за флеровијум се предвиђало да ће највероватније да се одликује неким својствима која су карактеристична за племените гасове, а тренутно се исти налази смештен у угљеникову групу.[155] Новији експерименти показали су, међутим, да се флеровијум хемијски понаша попут олова, што се и очекује гледајући позицију овог елемента у периодном систему.[156]
Додатна проширења периодног система[уреди | уреди извор]
| Систем у 8 редова, до елемента 172[157] |
Није познато да ли ће новооткривени елементи да прате узорак тренутног периодног система као 8. периода или ће додатна прилагођавања и корекције да буду неопходне. Сиборг је очекивао да ће 8. периода да прати претходно успостављени узорак у потпуности, и то тако што ће да постане део двоелементног s-блока за елементе 119 и 120, новог g-блока за следећих 18 елемената, те 30 додатних елемената који би били наставак на преостала три тренутна блока (f, d и p блок) — завршавајући се елементом 168 као следећим племенитим гасом.[158] Недавно су физичари попут Пеке Пикеа износили теорије да ови додатни елементи можда неће следити Маделунгово правило, које предвиђа како се електронске љуске попуњавају и тиме увелико утиче на изглед тренутног периодног система. Тренутно постоји неколико конкурентних теоријских модела за одређивање положаја елемената са атомским бројем мањим од или једнаким 172.[159]
Елемент с највећим могућим атомским бројем[уреди | уреди извор]
Број могућих елемената није познат. Веома рано мишљење које је 1911. године изнео Елиот Адамс и које је засновано на размештају елемената у сваком од хоризонталних редова периодног система било је да елементи са атомском тежином већом од 256± (што би данас било једнако елементу са атомским бројем између 99 и 100) не могу да постоје.[160] Нешто скорија процена је да би периодни систем могао да се заврши недуго након преласка ’острва стабилности’,[161] за што се верује да ће се десити око елемента 126, зато што је проширивање периодних и нуклидних система ограничено протонским и неутронским линијама капи (енгл. drip lines).[162] Други значајни предлози везано за крај периодног система укључују прекид на елементу 128 који је предложио Џон Емсли,[3] прекид на елементу 137 који је предложио Ричард Фајнман[163] те прекид на елементу 155 који је предложио Алберт Казан.[3][н. 17]
- Боров модел
Боров модел атома ставља одређене тешкоће пред атоме са атомским бројевима већим од 137 зато што би било који елемент с већим атомским бројем захтевао да 1s-електрони путују брже од величине c тј. брзине светлости.[164] Према томе, нерелативистички Боров модел показује се нетачним када се примени на елементе са овим или већим атомским бројем.
- Релативистичка Диракова једначина
Релативистичка Диракова једначина такође испољава проблеме када се примени на елементе с више од 137 протона. За такве елементе, таласна функција Дираковог основног стања је осцилаторна уместо ограничене, те не постоји празнине између позитивних и негативних енергетских спектара (као у Клајновом парадоксу).[165] Тачнији прорачуни, узимајући у обзир ефекте ограничене величине језгра, указују на то да енергија везивања прво прелази лимит за елементе с више од 173 протона. За теже елементе, ако унутрашња орбитала (1s) није попуњена, електрично поље језгра вукло би електроне из вакуума, што би даље резултовало у спонтаној емисији позитрона;[166] међутим, ово се не дешава ако се унутрашња орбитала попуни, тако да елемент 173 не мора нужно да представља крај периодног система.[163]
Оптимални облик[уреди | уреди извор]
Неколико различитих облика периодног система навело је на постављање питања да ли постоји оптимални или дефинитивни облик периодног система. Сматра се да одговор на ово питање зависи од тога да ли је хемијска периодичност уочена као појава међу елементима заправо стопостотно истинита, ефективно уткана у универзум, или је пак ова периодичност само производ субјективне људске интерпретације, условљене околностима, веровањима и склоностима људских посматрача. Објективни фундамент хемијске периодичности дао би одговоре и на питања позиције за водоник и хелијум, као и састав 3. групе. Таква темељна истина, уколико постоји, верује се да још увек није откривена. Све док се ово откриће не догоди, многи различити облици периодног система могу да се сматрају варијацијама схватања хемијске периодичности, при чему ће заговарачи сваке да истражују и стављају нагласак на различите аспекте, својства, перспективе и односе елемената.[н. 18]
Модерна верзија[уреди | уреди извор]
Испод је дат пример савременог ажурираног периодног система, урађеног у SVG формату. За разлику од система датих у уводу, овај садржи пуно више корисних информација уграђених у саме ћелије (1. енергија јонизације, електронегативност, оксидациона стања, електронска конфигурација итд.).
Види још[уреди | уреди извор]
Напомене[уреди | уреди извор]
- ^ Елементи који су откривени прво синтетисањем а потом проналаском у природи су технецијум (43), прометијум (61), астат (85), нептунијум (93) и плутонијум (94).
- ^ Нулти елемент (тј. супстанција изграђена само од неутрона), уврштен је у неколико алтернативних изведби; на пример, у Хемијској галаксији (енгл. Chemical Galaxy).
- ^ Постоји недоследност и неке неправилности у овој конвенцији. Тако је хелијум приказан у p-блоку иако је заправо елемент s-блока, а (примера ради) d-подљуска у d-блоку заправо се попуни до доласка до 11. уместо 12. групе.
- ^ Племенити гасови, астат, францијум и сви елементи тежи од америцијума изостављени су из приказаног графика зависности двеју наведених величина јер за исте не постоје доступни и употребљиви подаци.
- ^ Док је флуор најелектронегативнији од елемената по Полинговој скали, неон је најелектронегативнији елемент по другим скалама (као што је Аленова скала, на пример).
- ^ Док се за Lr сматра да има p а не d електрон у својој електронској конфигурацији основног стања, па би се стога очекивало да буде волатилни метал у стању да формира +1 катјон у једињењу, није било могуће доћи до доказа ни за једно од ових својстава упркос бројним експерименталним покушајима да се то уради.[55] Првобитно се очекивало да има d-електрон у својој електронској конфигурацији[55] што је и даље могуће за метални лоренцијум, док се за гасовити атомски лоренцијум сматра да веома вероватно има p-електрон.[56]
- ^ Претеча Деминговог система са 18 колона може да се види у Адамсовом периодном систему с 16 колона из 1911. године. Адамс је из главног тела свог система изоставио ретке земље и радиоактивне елементе (актиноиде); уместо тога их је приказао као „усечене само да би се сачувао простор” (енгл. careted in only to save space) — ретке земље између Ba и ека-Yt, радиоактивни елементи између ека-Te и ека-I. Погледајте:
- Q. A., Elliot (1911). „A modification of the periodic table”. Journal of the American Chemical Society. 33 (5): 684—688 [687].
- ^ Други, екстрадуги ред периодног система постулиран је чак 1892. године, како би се сместили познати и неоткривени елементи са атомском тежином већом од оне бизмута (нпр. торијум, протактинијум и уранијум). Већина научника је, међутим, сматрала да су ови елементи аналогни варијетети прелазних елемената трећег низа: хафнијум, тантал и волфрам. Постојање другог, унутрашњег низа прелазних елемената (у форми актиноида) није прихваћено све док сличности са електронским структурама лантаноида нису успостављене. Погледајте:
- Van Spronsen, J. W. (1969). The periodic system of chemical elements. Amsterdam: Elsevier. стр. 315—316. ISBN 978-0-444-40776-4.
- ^ Погледајте Интернетску базу података за периодне системе, где се могу пронаћи разне варијанте периодног система што се тиче формата (облика).
- ^ За постојање лантаноида састав 3. групе не би био извор од икаквог посебног значаја, пошто скандијум, итријум, лантан и актинијум показују исту постепену промену у својствима као и калцијум, стронцијум, баријум и радијум у 2. групи.[131]
- ^ Одвајање лантаноида од главног тела периодног система се приписује чешком хемичару Бохуславу Браунеру, који је 1902. године све ове елементе (почев од церијума) сместио на једну позицију у 4. групи (испод циркона). Овакав размештај се називао „астероидском хипотезом” (енгл. asteroid hypothesis), пратећи аналогију попуњавања једне орбите у Соларном систему. Пре овога, лантаноиди су најчешће (и неуспешно) постављани кроза групе I—VIII старијег облика периодног система са 8 колона. Иако се размештаји које су правили Браунерови претходници (слични његовом систему из 1902. године) бележе још од 1895. године, он је познат по томе што је 1881. године — у писму Мендељејеву — оваквом принципу дао назив „хемија астероида” (енгл. chemistry of asteroids). Други аутори су смештали све лантаноиде или у 3. групу, или у 3. и 4. групу, или у 2, 3. и 4. групу. Нилс Бор је 1922. године наставио процес одвајања смештајући лантаноиде између s и d блока. Глен Т. Сиборг је 1949. године поново увео верзију периодног система који је данас најпознатији (лантаноиди и актиноиди се приказују као фусноте). Сиборг је прво објавио свој систем у поверљивом извештају из 1944. године. После тога је поново објавио систем 1945. године, у Хемијским и инжењерским вестима (енгл. Chemical and Engineering News), а у годинама до 1949. неколико аутора је прокоментарисало овај нови систем и генерално се сложило са Сиборговим предлозима за измене. Исте године он истиче да је најбољи метод за представљање актиноида смештање истих испод главног тела система, узимајући у обзир аналогију с лантаноидима. Погледајте:
- Thyssen & Binnemans (2011). „Accommodation of the Rare Earths in the Periodic Table: A Historical Analysis”. Handbook on the Physics and Chemistry of the Rare Earths [Gschneider Jr.]. Amsterdam: Elsevier. 41. стр. 1—94.
- Seaborg (1994). „Origin of the Actinide Concept”. Handbook on the Physics and Chemistry of the Rare Earths [Gschneider Jr.]. Amsterdam: Elsevier. 18. стр. 1—27.
- ^ За још извора са овом верзијом система (Sc-Y-La-Ac), погледајте:
- Atkins et al. (2006). Shriver & Atkins Inorganic Chemistry. Oxford: Oxford University Press. изд. IV.
- Myers et al. (2004). Holt Chemistry. Orlando: Holt, Rinehart & Winston.
- Chang (2000). Essential Chemistry. Boston: McGraw-Hill. изд. II.
- ^ За још извора са овом верзијом система (Sc-Y-La-Ac), погледајте:
- Rayner-Canham, G.; Overton, T. (2013). Descriptive Inorganic Chemistry. New York: W. H. Freeman and Company. изд. VI.
- Moore et al. (1978). Chemistry. Tokyo: McGraw-Hill Kogakusha.
- ^ Феномен различитих група издвајања је изазван порастом базичности с порастом радијуса и не представља фундаментални разлог који би био довољан да се лутецијум (а не лантан) смести испод итријума. Према томе, међу 2. групом земноалкалних метала, магнезијум (мање базичан) припада „растворљивој групи”, док се калцијум, стронцијум и баријум (више базични) појављују као чланови „амонијум карбонатне групе”. Без обзира на ову чињеницу, магнезијум, калцијум, стронцијум и баријум одувек се сврставају у 2. групу периодног система без поговора. Погледајте:
- Moeller (1989). Chemistry with Inorganic Qualitative Analysis. SanDiego: Harcourt Brace Jovanovich. изд. III. стр. 955—956, 958.
- ^ Чак и ако метални лоренцијум има p-електрон, једноставне студије моделовања сугеришу да ће се понашати као лантаноид[149] (као и остатак познатих актиноида).[145]
- ^ За још извора са овом верзијом система (Sc-Y-Ln-An), погледајте:
- Housecroft & Sharpe (2008). Inorganic Chemistry. Harlow: Pearson Education. изд. III.
- Halliday (2005). Fundamentals of Physics. Hoboken, NewJersey: John Wiley & Sons. изд. VII.
- Nebergall (1980). General Chemistry. Lexington: D. C. Heath and Company. изд. VI.
- ^ „Karol (2002, стр. 63)” каже да би гравитациони ефекти постали значајни када би атомски бројеви постали астрономски велики, тиме превазилазећи друге феномене нестабилности супермасивних језгара, те да неутронске звезде (са атомским бројевима реда 1021) могу аргументовано да се сматрају најтежим познатим елементима у универзуму. Погледајте:
- Karol (2002). „The Mendeleev–Seaborg periodic table: Through Z = 1138 and beyond”. Journal of Chemical Education. 79 (1): 60—63.
- ^ Скери, један од најистакнутијих овлашћених за дословно ’писање историје’ периодног система,[167] фаворизовао је концепт оптималног облика периодног система, али недавно је променио своје мишљење и сада подржава вредност плуралитета периодних система.[168]
Референце[уреди | уреди извор]
- ^ а б в „Discovery and Assignment of Elements with Atomic Numbers 113, 115, 117 and 118”. IUPAC. 30. 12. 2015. Архивирано из оригинала 7. 2. 2016. г. Приступљено 12. 6. 2016.
- ^ „Chemistry: Four elements added to periodic table”. BBC News. 4. 1. 2016. Приступљено 19. 4. 2016.
- ^ а б в г д ђ Emsley, J. (2011). Nature's Building Blocks: An A–Z Guide to the Elements (New изд.). New York, NY: Oxford University Press. ISBN 978-0-19-960563-7.
- ^ Meija, J.; et al. (2016). „Atomic weights of the elements 2013 (IUPAC Technical Report)”. Pure and Applied Chemistry. 88 (3): 265—291. doi:10.1515/pac-2015-0305.
- ^ IUPAC 2016, Табела 2, 3 комбиновано; несигурност уклоњена.
- ^ Greenwood & Earnshaw 1984, стр. 24–27
- ^ Gray 2009, стр. 6.
- ^ Strickland, Ashley (8. 6. 2016). „New elements on the periodic table are named”. CNN. Архивирано из оригинала 9. 6. 2016. г. Приступљено 12. 6. 2016.
- ^ Gonzales, Richard (9. 6. 2016). „Hello, nihonium. Scientists Name 4 New Elements On The Periodic Table”. NPR.org. Архивирано из оригинала 12. 6. 2016. г. Приступљено 12. 6. 2016.
- ^ Koppenol, W. H. (2002). „Naming of New Elements (IUPAC Recommendations 2002)” (PDF). Pure and Applied Chemistry. 74 (5): 787—791. S2CID 95859397. doi:10.1351/pac200274050787. Архивирано из оригинала (PDF) 8. 3. 2016. г. Приступљено 19. 4. 2016.
- ^ Silva, Robert J. (2006). „Fermium, Mendelevium, Nobelium and Lawrencium”. Ур.: Morss, L. R.; Edelstein, N. M.; Fuger, J. The Chemistry of the Actinide and Transactinide Elements (III изд.). Dordrecht, The Netherlands: Springer Science+Business Media. ISBN 978-1-4020-3555-5.
- ^ Scerri 2007, стр. 24.
- ^ Messler 2010, стр. 32
- ^ Bagnall 1967, стр. 1–12
- ^ Day & Selbin 1969, стр. 103
- ^ Holman & Hill 2000, стр. 40
- ^ а б Leigh, G. J. (1990). Nomenclature of Inorganic Chemistry: Recommendations 1990. Blackwell Science. ISBN 978-0-632-02494-0.
- ^ Fluck, E. (1988). „New Notations in the Periodic Table” (PDF). Pure Appl. Chem. IUPAC. 60 (3): 431—436. doi:10.1351/pac198860030431. Архивирано из оригинала (PDF) 25. 11. 2013. г. Приступљено 19. 4. 2016.
- ^ а б Moore 2003, стр. 111
- ^ а б в Greenwood & Earnshaw 1984, стр. 30
- ^ „The constitution of group 3 of the periodic table; project № 2015-039-2-200, division № 200” [Састав 3. групе периодног система; пројекат № 2015-039-2-200, дивизија № 200]. IUPAC. 18. 12. 2015. Приступљено 28. 6. 2017.
- ^ Stoker 2007, стр. 68
- ^ Mascetta 2003, стр. 50
- ^ Kotz, Treichel & Townsend 2009, стр. 324
- ^ а б в Gray 2009, стр. 12
- ^ Jones 2002, стр. 2
- ^ Silberberg 2006, стр. 536
- ^ Manson & Halford 2006, стр. 376
- ^ Bullinger 2009, стр. 8
- ^ Jones, B. W. (2010). Pluto: Sentinel of the outer solar system. Cambridge: Cambridge University Press. стр. 169—71. ISBN 978-0-521-19436-5.
- ^ Hinrichs, G. D. (1869). „On the classification and the atomic weights of the so-called chemical elements, with particular reference to Stas's determinations”. Proceedings of the American Association for the Advancement of Science. 18 (5): 112—124. Приступљено 19. 4. 2016.
- ^ а б Myers, R. (2003). The basics of chemistry. Westport, CT: Greenwood Publishing Group. стр. 61—67. ISBN 978-0-313-31664-7.
- ^ а б Chang 2002, стр. 289–310, 340–42
- ^ Greenwood & Earnshaw 1984, стр. 27
- ^ а б Jolly, W. L. (1991). Modern Inorganic Chemistry (II изд.). McGraw-Hill. стр. 22. ISBN 978-0-07-112651-9.
- ^ а б в Greenwood & Earnshaw 1984, стр. 28
- ^ IUPAC (1997). „Electronegativity”. Compendium of Chemical Terminology. изд. II [Gold Book]. Онлајн исправљена верзија (2006—). Приступљено 7. 4. 2016.
- ^ Pauling, L. (1932). „The Nature of the Chemical Bond [IV. The Energy of Single Bonds and the Relative Electronegativity of Atoms]”. Journal of the American Chemical Society. 54 (9): 3570—3582. Bibcode:1932JAChS..54.2610C. doi:10.1021/ja01348a011.
- ^ Allred, A. L. (1960). „Electronegativity values from thermochemical data”. Journal of Inorganic and Nuclear Chemistry. Northwestern University. 17 (3/4): 215—221. doi:10.1016/0022-1902(61)80142-5. Архивирано из оригинала 02. 02. 2013. г. Приступљено 19. 4. 2016.
- ^ Huheey, Keiter & Keiter 1997, стр. 42.
- ^ Siekierski, S.; Burgess, J. (2002). Concise chemistry of the elements. Chichester: Horwood Publishing. стр. 35—36. ISBN 978-1-898563-71-6.
- ^ а б Chang 2002, стр. 307–309
- ^ Huheey, Keiter & Keiter 1997, стр. 42, 880–881
- ^ Yoder, C. H.; Suydam, F. H.; Snavely, F. A. (1975). Chemistry (II изд.). Harcourt Brace Jovanovich. стр. 58. ISBN 978-0-15-506465-2.
- ^ Huheey, Keiter & Keiter 1997, стр. 880–885
- ^ Sacks, O. (2009). Uncle Tungsten: Memories of a chemical boyhood. New York: Alfred A. Knopf. стр. 191, 194. ISBN 978-0-375-70404-8.
- ^ Gray 2009, стр. 9.
- ^ а б в MacKay, K. M.; MacKay, R. A.; Henderson, W. (2002). Introduction to Modern Inorganic Chemistry (VI изд.). Cheltenham: Nelson Thornes. стр. 194—196, 385. ISBN 978-0-7487-6420-4.
- ^ Remy, H. (1956). Kleinberg, J., ур. Treatise on Inorganic Chemistry. 2. Amsterdam: Elsevier. стр. 30.
- ^ Phillips, C. S. G.; Williams, R. J. P. (1966). Inorganic Chemistry. Oxford: Clarendon Press. стр. 4—5.
- ^ King, R. B. (1995). Inorganic chemistry of main group elements. New York: Wiley-VCH. стр. 289.
- ^ а б Greenwood & Earnshaw 1984, стр. 947
- ^ Spedding, F. H.; Beadry, B. J. (1968). „Lutetium”. Ур.: Hampel, C. A. The Encyclopedia of the Chemical Elements. Reinhold Book Corporation. стр. 374—378.
- ^ Settouti, N.; Aourag, H. (2014). „A Study of the Physical and Mechanical Properties of Lutetium Compared with Those of Transition Metals: A Data Mining Approach”. JOM. 67 (1): 87—93. Bibcode:2015JOM....67a..87S. doi:10.1007/s11837-014-1247-x.
- ^ а б Silva, Robert J. (2011). „Chapter 13. Fermium, Mendelevium, Nobelium, and Lawrencium”. Ур.: Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean. The Chemistry of the Actinide and Transactinide Elements. Netherlands: Springer. ISBN 978-94-007-0210-3. doi:10.1007/978-94-007-0211-0_13.
- ^ Sato, T. K.; Asai, M.; Borschevsky, A.; Stora, T.; Sato, N.; Kaneya, Y.; Tsukada, K.; Düllman, Ch. E.; Eberhardt, K.; Eliav, E.; Ichikawa, S.; Kaldor, U.; Kratz, J. V.; Miyashita, S.; Nagame, Y.; Ooe, K.; Osa, A.; Renisch, D.; Runke, J.; Schädel, M.; Thörle-Pospiech, P.; Toyoshima, A.; Trautmann, N. (9. 4. 2015). „Measurement of the first ionization potential of lawrencium, element 103” (PDF). Nature. 520: 209—211. Bibcode:2015Natur.520..209S. doi:10.1038/nature14342. Приступљено 26. 10. 2017.
- ^ Steele, D. The Chemistry of the Metallic Elements. Oxford: Pergamon Press. стр. 67.
- ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements (II изд.). Oxford: Elsevier Science Ltd. стр. 1206. ISBN 978-0-7506-3365-9.
- ^ Siegfried, R. (2002). From elements to atoms a history of chemical composition. Philadelphia, Pennsylvania: Library of Congress Cataloging-in-Publication Data. стр. 92. ISBN 978-0-87169-924-4.
- ^ а б Ball 2002, стр. 100
- ^ Horvitz, L. (2002). Eureka! – Scientific Breakthroughs That Changed The World. New York: John Wiley. стр. 43. ISBN 978-0-471-23341-1. OCLC 50766822.
- ^ Kekulé, August (1857). „Über die s. g. gepaarten Verbindungen und die Theorie der mehratomigen Radicale”. Annalen der Chemie und Pharmacie. 104 (2): 129—150. doi:10.1002/jlac.18571040202.
- ^ van Spronsen, J. W. (1969). The periodic system of chemical elements. Amsterdam: Elsevier. стр. 19. ISBN 978-0-444-40776-4.
- ^ „Alexandre-Emile Bélguier de Chancourtois (1820–1886)”. Annales des Mines history page. Архивирано из оригинала 19. 03. 2016. г. Приступљено 19. 4. 2016.
- ^ Venable 1896, стр. 85–86, 97
- ^ Odling, W. (2002). „On the proportional numbers of the elements”. Quarterly Journal of Science. 1: 642—648 [643]. „their usually received groupings”
- ^ Scerri 2011
- ^ Kaji, M. (2004). „Discovery of the periodic law: Mendeleev and other researchers on element classification in the 1860s”. Ур.: Rouvray, D. H.; King, R. Bruce. The periodic table: Into the 21st Century. Research Studies Press. стр. 91—122 [95]. ISBN 978-0-86380-292-8.
- ^ Newlands, J. A. R. (20. 8. 1864). „On Relations Among the Equivalents”. Chemical News. 10: 94—95. Архивирано из оригинала 4. 3. 2016. г. Приступљено 19. 4. 2016.
- ^ Newlands, J. A. R. (18. 8. 1865). „On the Law of Octaves”. Chemical News. 12: 83. Архивирано из оригинала 4. 3. 2016. г. Приступљено 19. 4. 2016.
- ^ Bryson, B. (2004). A Short History of Nearly Everything. Black Swan. стр. 141—142. ISBN 978-0-552-15174-0.
- ^ Scerri 2007, стр. 306.
- ^ Brock, W. H.; Knight, D. M. (1965). „The Atomic Debates: 'Memorable and Interesting Evenings in the Life of the Chemical Society'”. Isis. The University of Chicago Press. 56 (1): 5—25. doi:10.1086/349922.
- ^ Scerri 2007, стр. 87, 92.
- ^ Kauffman, G. B. (март 1969). „American forerunners of the periodic law”. Journal of Chemical Education. 46 (3): 128—135 [132]. Bibcode:1969JChEd..46..128K. doi:10.1021/ed046p128. „idiosyncratic, ostentatious and labyrinthine”
- ^ Mendelejew, D. (1869). „Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente”. Zeitschrift für Chemie: 405—406.
- ^ Venable 1896, стр. 96–97, 100–102
- ^ Ball 2002, стр. 100–102
- ^ „Periodni sistem elemenata” (PDF). Hemija 024. стр. 1. Архивирано из оригинала (PDF) 15. 04. 2016. г. Приступљено 19. 4. 2016.
- ^ Pullman, B. (1998). The Atom in the History of Human Thought [Axel Reisinger]. Oxford University Press. стр. 227. ISBN 978-0-19-515040-7.
- ^ Ball 2002, стр. 105.
- ^ Atkins, P. W. (1995). The Periodic Kingdom. HarperCollins Publishers, Inc. стр. 87. ISBN 978-0-465-07265-1.
- ^ Samanta, C.; Chowdhury, P. R.; Basu, D. N. (2007). „Predictions of alpha decay half lives of heavy and superheavy elements”. Nucl. Phys. A. 789: 142—154. Bibcode:2007NuPhA.789..142S. arXiv:nucl-th/0703086
 . doi:10.1016/j.nuclphysa.2007.04.001.
. doi:10.1016/j.nuclphysa.2007.04.001.
- ^ Scerri 2007, стр. 112.
- ^ Kaji, M. (2002). „D. I. Mendeleev's Concept of Chemical Elements and the Principle of Chemistry” (PDF). Bull. Hist. Chem. Tokyo Institute of Technology. 27 (1): 4—16. Архивирано из оригинала (PDF) 03. 03. 2016. г. Приступљено 19. 4. 2016.
- ^ Adloff, J-P.; Kaufman, G. B. (25. 9. 2005). „Francium (Atomic Number 87), the Last Discovered Natural Element”. The Chemical Educator. Архивирано из оригинала 25. 9. 2013. г. Приступљено 26. 3. 2007.
- ^ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. (1971). „Detection of Plutonium-244 in Nature”. Nature. 234 (5325): 132—134. Bibcode:1971Natur.234..132H. doi:10.1038/234132a0. Архивирано из оригинала 3. 3. 2016. г. Приступљено 19. 4. 2016.
- ^ Deming, H. G. (1923). General chemistry: An elementary survey. New York: J. Wiley & Sons. стр. 160, 165.
- ^ Abraham, M.; Coshow, D.; Fix, W. Periodicity: A source book module, version 1.0 (PDF). New York: Chemsource, Inc. стр. 3. Архивирано из оригинала (PDF) 26. 6. 2015. г. Приступљено 19. 4. 2016.
- ^ Emsley, J. (7. 3. 1985). „Mendeleyev's dream table”. New Scientist: 32—36 [36].
- ^ Fluck, E. (1988). „New notations in the period table”. Pure & Applied Chemistry. 60 (3): 431—436 [432]. doi:10.1351/pac198860030431.
- ^ Ball 2002, стр. 111.
- ^ Scerri 2007, стр. 270–271
- ^ Masterton, W. L.; Hurley, C. N.; Neth, E. J. Chemistry: Principles and reactions (VII изд.). Belmont, CA: Brooks/Cole Cengage Learning. стр. 173. ISBN 978-1-111-42710-8.
- ^ Ball 2002, стр. 123.
- ^ Barber, R. C.; Karol, P. J.; Nakahara, H.; Vardaci, E.; Vogt, E. W. (2011). „Discovery of the elements with atomic numbers greater than or equal to 113 (IUPAC Technical Report)”. Pure Appl. Chem. 83 (7): 1485. doi:10.1351/PAC-REP-10-05-01.
- ^ „Эксперимент по синтезу 117-го элемента получает продолжение”. JINR. 2012. Архивирано из оригинала 01. 08. 2013. г.
- ^ St. Fleur, Nicholas (1. 12. 2016). „Four New Names Officially Added to the Periodic Table of Elements”. The New York Times. Архивирано из оригинала 14. 8. 2017. г. Приступљено 3. 12. 2016.
- ^ „Periodic table's seventh row finally filled as four new elements are added”. The Guardian. 3. 1. 2016. Архивирано из оригинала 2. 4. 2016. г. Приступљено 19. 4. 2016.
- ^ Gunther, Matthew (8. 6. 2016). „IUPAC Announces Proposed New Element Names”. Chemistry World. Архивирано из оригинала 9. 6. 2016. г. Приступљено 9. 6. 2016.
- ^ „IUPAC is naming the four new elements nihonium, moscovium, tennessine, and oganesson”. IUPAC. 8. 6. 2016. Архивирано из оригинала 9. 6. 2016. г. Приступљено 9. 6. 2016.
- ^ Scerri, Eric (2013). „Element 61—Promethium”. A Tale of 7 Elements. New York: Oxford University Press (USA). стр. 175—194 (190). ISBN 978-0-19-539131-2. Приступљено 27. 8. 2016. „... [no] interruptions in the sequence of increasing atomic numbers...”
- ^ Newell, S. B. (1980). Chemistry: An introduction. Boston: Little, Brown and Company. стр. 196. ISBN 978-0-316-60455-0. Приступљено 27. 8. 2016.
- ^ Jensen, W. B. (1982). „Classification, Symmetry and the Periodic Table”. Computers & Mathematics with Applications. 12B (1/2): 487—510 [498]. doi:10.1016/0898-1221(86)90167-7.
- ^ Leach, M. R. „Concerning electronegativity as a basic elemental property and why the periodic table is usually represented in its medium form”. Foundations of Chemistry. 15 (1): 13—29. doi:10.1007/s10698-012-9151-3.
- ^ а б в Thyssen, P.; Binnemans, K. (2011). „I Accommodation of the Rare Earths in the Periodic Table: A Historical Analysis”. Ур.: Gschneidner Jr., K. A.; Bünzli, J-C. G.; Vecharsky, B. Handbook on the Physics and Chemistry of Rare Earths. Handbook on the Physics and Chemistry of Rare Earths. 41. Amsterdam: Elsevier. стр. 1—94 [76, 80—81]. ISBN 978-0-444-53590-0.
- ^ а б Scerri 2007, стр. 20
- ^ „Weird Words of Science: Lemniscate Elemental Landscapes”. fieldofscience.com. Fields of Science. 22. 3. 2009. Архивирано из оригинала 14. 3. 2016. г. Приступљено 19. 4. 2016.
- ^ Emsely, J.; Sharp, R. (21. 6. 2010). „The periodic table: Top of the charts”. The Independent. Архивирано из оригинала 5. 3. 2016. г. Приступљено 19. 4. 2016.
- ^ Seaborg, G. (1964). „Plutonium: The Ornery Element”. Chemistry. 37 (6): 14.
- ^ Leach, Mark R. „1925 Courtines' Periodic Classification”. Архивирано из оригинала 16. 05. 2016. г. Приступљено 19. 4. 2016.
- ^ Leach, Mark R. „1949 Wringley's Lamina System”. Архивирано из оригинала 03. 12. 2011. г. Приступљено 19. 4. 2016.
- ^ Mazurs, E. G. (1974). Graphical Representations of the Periodic System During One Hundred Years. Alabama: University of Alabama Press. стр. 111. ISBN 978-0-8173-3200-6.
- ^ Leach, Mark R. „1996 Dufour's Periodic Tree”. Архивирано из оригинала 18. 04. 2010. г. Приступљено 19. 4. 2016.
- ^ Leach, Mark R. „1989 Physicist's Periodic Table by Timothy Stowe”. Архивирано из оригинала 05. 06. 2012. г. Приступљено 16. 10. 2012.
- ^ Bradley, D. (20. 7. 2011). „At last, a definitive periodic table”. ChemViews Magazine. doi:10.1002/chemv.201000107. Архивирано из оригинала 01. 05. 2013. г. Приступљено 19. 4. 2016.
- ^ Scerri 2007, стр. 285–286
- ^ Scerri 2007, стр. 285 »unruly«
- ^ Leach, Mark R. „2002 Inorganic Chemist's Periodic Table”. Архивирано из оригинала 6. 3. 2016. г. Приступљено 19. 4. 2016.
- ^ Scerri, E. (2008). „The role of triads in the evolution of the periodic table: Past and present”. Journal of Chemical Education. 85 (4): 585—589 [589]. Bibcode:2008JChEd..85..585S. doi:10.1021/ed085p585.
- ^ Alper, R. (2010). „The simplified periodic table: Elements ordered by their subshells”. The Journal of Biological Physics and Chemistry. 10 (2): 74—80. doi:10.4024/43AL09F.jbpc.10.02.
- ^ а б Scerri, E. (2012). „Some comments on the recently proposed periodic table featuring elements ordered by their subshells”. Journal of Biological Physics and Chemistry. 12 (2): 69—70.
- ^ Bent, H. A.; Weinhold, F. (2007). „Supporting information: News from the periodic table – An introduction to 'Periodicity symbols, tables, and models for higher-order valency and donor–acceptor kinships'”. Journal of Chemical Education. 84 (7): 3—4. doi:10.1021/ed084p1145.
- ^ Scerri 2011.
- ^ Francl, M. (мај 2009). „Table manners” (PDF). Nature Chemistry. 1 (2): 97—98. Bibcode:2009NatCh...1...97F. PMID 21378810. doi:10.1038/nchem.183. Архивирано из оригинала (PDF) 25. 10. 2012. г. Приступљено 19. 4. 2016.
- ^ „IUPAC Periodic Table of the Elements” (PDF). iupac.org. IUPAC. 1. 5. 2013. Архивирано из оригинала (PDF) 22. 8. 2015. г. Приступљено 19. 4. 2016.
- ^ Seaborg, G. (1945). „The chemical and radioactive properties of the heavy elements”. Chemical English Newspaper. 23 (23): 2190—2193.
- ^ Cronyn, M. W. (август 2003). „The Proper Place for Hydrogen in the Periodic Table”. Journal of Chemical Education. 80 (8): 947—951. Bibcode:2003JChEd..80..947C. doi:10.1021/ed080p947.
- ^ Greenwood & Earnshaw 1984.
- ^ Lewars, Errol G. (5. 12. 2008). Modeling Marvels: Computational Anticipation of Novel Molecules. Springer Science & Business Media. стр. 69—71. ISBN 978-1-4020-6973-4. Приступљено 19. 4. 2016.
- ^ Hevesy, G. (1929). Redkie zemeli s tochki zreniya stroeniya atoma [Rare earths from the point of view of structure of atom] (цитирано у: Trifonov (1970). стр. 188). Leningrad: NKhTI.
- ^ Stewart, P. J. (2008). „The Flyleaf Table: An Alternative”. Journal of Chemical Education. 85 (11): 1490. Bibcode:2008JChEd..85.1490S. doi:10.1021/ed085p1490. „it is a mistake to break the [periodic] system into sharply delimited blocks”
- ^ Keeler, J.; Wothers, P. (2014). Chemical Structure and Reactivity: An Integrated Approach. Oxford: Oxford University. стр. 259. ISBN 978-0-19-960413-5.
- ^ Scerri, E. (2012). „Mendeleev's Periodic Table Is Finally Completed and What To Do about Group 3”. Chemistry International. 34 (4). Архивирано из оригинала 15. 9. 2015. г. Приступљено 19. 4. 2016.
- ^ Castelvecchi, D. (8. 4. 2015). „Exotic atom struggles to find its place in the periodic table”. Nature News. Архивирано из оригинала 5. 10. 2015. г. Приступљено 19. 4. 2016.
- ^ „The constitution of group 3 of the periodic table”. IUPAC. 2015. Приступљено 19. 4. 2016.
- ^ Emsley, J. (2011). Nature's Building Blocks. Oxford: Oxford University. стр. 651. ISBN 978-0-19-960563-7.
- ^ Staff. „Periodic Table”. Royal Society of Chemistry. Архивирано из оригинала 10. 4. 2016. г. Приступљено 19. 4. 2016.
- ^ а б в г д ђ е Jensen, William B. (1982). „The Positions of Lanthanum (Actinium) and Lutetium (Lawrencium) in the Periodic Table”. J. Chem. Educ. 59 (8). Bibcode:1982JChEd..59..634J. doi:10.1021/ed059p634. „... it in group 3 as the first member of the d-block for period 6.« • »... resulting in a 4f differentiating electron for lutetium and firmly establishing it as the last member of the f-block for period 6.« • »... "resulting in a d rather than an f differentiating electron" for lutetium and making it an "equally valid candidate"...”
- ^ Trifonov, D. N. (1970). Rare-earth elements and their position in the periodic system (преведено с руског). New Delhi: Indian National Scientific Documentation Centre. стр. 201—202.
- ^ Greenwood, N. N.; Harrington, T. J. (1973). The chemistry of the transition elements. Oxford: Clarendon Press. стр. 50. ISBN 978-0-19-855435-6.
- ^ Aylward, G.; Findlay, T. (2008). SI chemical data (VI изд.). Milton, Queensland: John Wiley & Sons. ISBN 978-0-470-81638-7.
- ^ Wiberg, N. (2001). Inorganic Chemistry. San Diego: Academic Press. стр. 119. ISBN 978-0-12-352651-9.
- ^ Wulfsberg, G. (2006). „Periodic table: Trends in the properties of the elements”. Encyclopedia of Inorganic Chemistry. New York: John Wiley & Sons. стр. 3. ISBN 978-0-470-86210-0.
- ^ а б Cotton, S. (2007). Lanthanide and Actinide Chemistry. Chichester: John Wiley & Sons. стр. 150. ISBN 978-0-470-01006-8.
- ^ Brown, T. L.; LeMay Jr., H. E.; Bursten, B. E.; Murphy, C. J. (2009). Chemistry: The Central Science (XI изд.). Upper Saddle River, New Jersey: Pearson Education. ISBN 978-0-13-235848-4.
- ^ Scerri, E. (2015). „Five ideas in chemical education that must die – part five”. Educationinchemistryblog. Royal Society of Chemistry. Архивирано из оригинала 04. 03. 2016. г. Приступљено 19. 4. 2016. „It is high time that the idea of group 3 consisting of Sc, Y, La and Ac is abandoned.”
- ^ Jensen, W. B. (2015). „Some Comments on the Position of Lawrencium in the Periodic Table” (PDF). Архивирано из оригинала (PDF) 23. 12. 2015. г. Приступљено 19. 4. 2016.
- ^ Xu, W-H.; Pyykkö, P. (2016). „Is the chemistry of lawrencium peculiar”. Physical Chemistry Chemical Physics. 18 (26): 17351—17355. Bibcode:2016PCCP...1817351X. doi:10.1039/C6CP02706G.
- ^ King, R. B. (1995). Inorganic Chemistry of Main Group Elements. New York: Wiley-VCH. стр. 289. ISBN 978-1-56081-679-9.
- ^ IUPAC (1997). „Transition element”. Compendium of Chemical Terminology. изд. II [Gold Book]. Онлајн исправљена верзија (2006—). Приступљено 7. 4. 2016.
- ^ Xuefang, W.; Andrews, L.; Riedel, S.; Kaupp, M. (2007). „Mercury Is a Transition Metal: The First Experimental Evidence for HgF4”. Angew. Chem. Int. Ed. 46 (44): 8371—8375. PMID 17899620. doi:10.1002/anie.200703710.
- ^ а б Jensen, W. B. (2008). „Is Mercury Now a Transition Element”. J. Chem. Educ. 85 (9): 1182—1183. Bibcode:2008JChEd..85.1182J. doi:10.1021/ed085p1182.
- ^ Rayner-Canham, G.; Overton, T (2006). Descriptive inorganic chemistry (IV изд.). New York: W. H. Freeman. стр. 484—485. ISBN 978-0-7167-8963-5.
- ^ Schändel, M. (2003). The Chemistry of Superheavy Elements. Dordrecht: Kluwer Academic Publishers. стр. 277. ISBN 978-1-4020-1250-1.
- ^ Scerri 2011, стр. 142–143
- ^ Fricke, B.; Greiner, W.; Waber, J. T. (1971). „The continuation of the periodic table up to Z = 172 [The chemistry of superheavy elements]”. Theoretica chimica acta. Springer-Verlag. 21 (3): 235—260. doi:10.1007/BF01172015. Архивирано из оригинала 03. 02. 2013. г. Приступљено 19. 4. 2016.
- ^ Frazier, K. (1978). „Superheavy Elements”. Science News. 113 (15): 236—238. JSTOR 3963006. doi:10.2307/3963006.
- ^ Pyykkö, P. (2011). „A suggested periodic table up to Z ≤ 172, based on Dirac–Fock calculations on atoms and ions”. Physical Chemistry Chemical Physics. 13 (1): 161—168. Bibcode:2011PCCP...13..161P. PMID 20967377. doi:10.1039/c0cp01575j.
- ^ Elliot, Q. A. (1911). „A modification of the periodic table”. Journal of the American Chemical Society. 33 (5): 684—688 [688]. doi:10.1021/ja02218a004.
- ^ Seaborg, G. (cca 2006). „Transuranium element (chemical element)”. Encyclopædia Britannica. Архивирано из оригинала 2. 4. 2016. г. Приступљено 19. 4. 2016.
- ^ Cwiok, S.; Heenen, P-H.; Nazarewicz, W. (2005). „Shape coexistence and triaxiality in the superheavy nuclei”. Nature. 433 (7027): 705—709. Bibcode:2005Natur.433..705C. PMID 15716943. doi:10.1038/nature03336.
- ^ а б Ball, P. (2010). „Column: The crucible | Would Element 137 Really Spell the End of the Periodic Table – Philip Ball Examines the Evidence [Chemistry World]”. Chemistry World. Royal Society of Chemistry. Архивирано из оригинала 1. 10. 2015. г.
- ^ Eisberg, R.; Resnick, R. (1985). Quantum Physics of Atoms, Molecules, Solids, Nuclei and Particles. Wiley.
- ^ Bjorken, J. D.; Drell, S. D. (1964). Relativistic Quantum Mechanics. McGraw-Hill.
- ^ Погледајте и референце у следећем извору поред самог примарног извора:
- Greiner, W.; Schramm, S. (2008). „American Journal of Physics”. 76: 509.
- ^ Sella, Andrea (7. 8. 2013). „An elementary history lesson”. New Scientist (2929 [51]). Архивирано из оригинала 3. 7. 2016. г. Приступљено 17. 6. 2017.
- ^ Scerri, Eric (9. 8. 2013). „Is there an optimal periodic table and other bigger questions in the philosophy of science”. ericscerri23.blogspot.com.au. Eric Scerri. Архивирано из оригинала 13. 06. 2017. г. Приступљено 17. 6. 2017.
Цитирана библиографија[уреди | уреди извор]
- Ball, P. (2002). The Ingredients: A Guided Tour of the Elements. Oxford: Oxford University Press. ISBN 978-0-19-284100-1. Приступљено 19. 4. 2016.
- Chang, R. (2002). Chemistry (VII изд.). New York: McGraw-Hill Higher Education. ISBN 978-0-19-284100-1. Приступљено 19. 4. 2016.
- Gray, T. (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe. New York: Black Dog & Leventhal Publishers. ISBN 978-1-57912-814-2. Приступљено 19. 4. 2016.
- Greenwood, N. N.; Earnshaw, A. (1984). Chemistry of the Elements. Oxford: Pergamon Press. ISBN 978-0-08-022057-4. Приступљено 19. 4. 2016.
- Huheey, J. E.; Keiter, E. A.; Keiter, R. L. (1997). Principles of structure and reactivity (IV изд.). New York: Harper Collins College Publishers. ISBN 978-0-06-042995-9. Приступљено 19. 4. 2016.
- Moore, J. (2003). Chemistry For Dummies (I изд.). New York: Wiley Publications. ISBN 978-0-7645-5430-8. Приступљено 19. 4. 2016.
- Scerri, E. (2007). The periodic table: Its story and its significance. Oxford: Oxford University Press. ISBN 978-0-19-530573-9. Приступљено 19. 4. 2016.
- Scerri, E. (2011). The periodic table: A very short introduction. Oxford: Oxford University Press. ISBN 978-0-19-958249-5. Приступљено 19. 4. 2016.
- Venable, F. P. (1896). The Development of the Periodic Law. Easton, Pennsylvania: Chemical Publishing Company. Приступљено 19. 4. 2016.
Литература[уреди | уреди извор]
- Bullinger, Hans-Jörg (2009). Technology guide: Principles, applications, trends. Berlin: Springer-Verlag. стр. 8. ISBN 978-3-540-88545-0.
- Manson, S. S.; Halford, G. R. (2006). Fatigue and durability of structural materials. Materials Park, Ohio: ASM International. стр. 376. ISBN 978-0-87170-825-0.
- Silberberg, M. S. (2006). Chemistry: The molecular nature of matter and change (IV изд.). New York: McGraw-Hill. стр. 536. ISBN 978-0-07-111658-9.
- Jones, C. (2002). d- and f-block chemistry. New York: J. Wiley & Sons. стр. 2. ISBN 978-0-471-22476-1. OCLC 300468713.
- Kotz, J.; Treichel, P.; Townsend, John (2009). Chemistry and Chemical Reactivity, Volume 2 (VII изд.). Belmont: Thomson Brooks [Cole]. стр. 324. ISBN 978-0-495-38712-1. OCLC 220756597.
- Mascetta, J. (2003). Chemistry The Easy Way (IV изд.). New York: Hauppauge. стр. 50. ISBN 978-0-7641-1978-1. OCLC 52047235.
- Stoker, S. H. (2007). General, organic, and biological chemistry. New York: Houghton Mifflin. стр. 68. ISBN 978-0-618-73063-6. OCLC 52445586.
- Leigh, G. J. (1990). Nomenclature of Inorganic Chemistry: Recommendations 1990. Blackwell Science. ISBN 978-0-632-02494-0.
- Holman, J.; Hill, G. C. (2000). Chemistry in context (V изд.). Walton-on-Thames: Nelson Thornes. стр. 40. ISBN 978-0-17-448276-5.
- Day, M. C. Jr.; Selbin, J. (1969). Theoretical inorganic chemistry (II изд.). New York: Nostrand-Rienhold Book Corporation. стр. 103. ISBN 978-0-7637-7833-0.
- Bagnall, K. W. (1967). „Recent advances in actinide and lanthanide chemistry”. Ур.: Fields, P. R.; Moeller, T. Advances in chemistry, Lanthanide/Actinide chemistry. Advances in Chemistry. 71. American Chemical Society. стр. 1—12. ISBN 978-0-8412-0072-2. doi:10.1021/ba-1967-0071.
- Messler, R. W. (2010). The essence of materials for engineers. Sudbury, MA: Jones & Bartlett Publishers. стр. 32. ISBN 978-0-7637-7833-0.
- Silva, Robert J. (2006). „Fermium, Mendelevium, Nobelium and Lawrencium”. Ур.: Morss, L. R.; Edelstein, N. M.; Fuger, J. The Chemistry of the Actinide and Transactinide Elements (III изд.). Dordrecht, The Netherlands: Springer Science+Business Media. ISBN 978-1-4020-3555-5.
- Emsley, J. (2011). Nature's Building Blocks: An A–Z Guide to the Elements (New изд.). New York, NY: Oxford University Press. ISBN 978-0-19-960563-7.
- Dayah, M. „Dynamic/Interactive Periodic Table”. Ptable. Архивирано из оригинала 16. 3. 2016. г. Приступљено 19. 4. 2016.
- Haran, B. „The Periodic Table of Videos”. University of Nottingham. Архивирано из оригинала 4. 3. 2016. г. Приступљено 19. 4. 2016.
- Winter, M. „WebElements: The Periodic Table on the Web”. University of Sheffield. Архивирано из оригинала 11. 4. 2016. г. Приступљено 19. 4. 2016.
- Leach, M. R. „The Internet Database of Periodic Tables”. Meta-Synthesis. Архивирано из оригинала 24. 03. 2016. г. Приступљено 19. 4. 2016.
Спољашње везе[уреди | уреди извор]
- Периодни систем хемијских елемената IUPAC-а на званичном веб-сајту
- Пројекти IUPAC-а на званичном веб-сајту
- 10 чињеница о периодном систему елемената Архивирано на сајту Wayback Machine (25. април 2016)
- Песма о периодном систему [AsapSCIENCE]
- 108 хемијских елемената анимираних у занимљиве ликове [CHEEZburger]
- Списак речи на енглеском језику састављених од симбола хемијских елемената периодног система [ScienceNotes]
- PDF верзија периодног система на српском језику и ћириличком писму
- PDF верзија периодног система на српском језику и латиничком писму






