Хемијски елемент
 | |
 | |
  | |
  | |
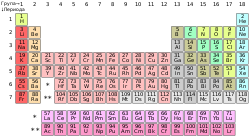
| горе: Периодни систем хемијских елемената. испод: примери одређених хемијских елемената. Слева надесно: водоник, баријум, бакар, уранијум, бром и хелијум. |
Хемијски елемент је врста чисте хемијске супстанце која се не може поделити на две или више чисте супстанце обичним хемијским методама.[1] Хемијски елементи се састоје од само једне врсте атома, који се разликују по свом атомском броју, тј. броју протона у атомском језгру. [2] Елементи се деле на метале, металоиде и неметале. Најпознатији примери хемијских елемената су угљеник, азот, кисеоник, силицијум, арсен, алуминијум, гвожђе, бакар, злато, жива и олово.
Најлакши хемијски елементи, међу којима су водоник, хелијум и мање количине литијума, берилијума и бора, настали су различитим космичким процесима током Великог праска и деловањем космичких зрака. Настанак тежих елемената, почев од угљеника до најтежих елемената, десио се путем нуклеосинтезе у звездама, а при настанку Сунчевог система и формирањем његовог планетарног система из планетарних маглина и супернова, које су избацивале ове елементе у свемир.[3][4]
Велика распрострањеност кисеоника, силицијума и гвожђа за Земљи одаје њихово заједничко порекло у таквим звездама. Док је већина елемената углавном стабилно, постоји мали број природних нуклеарних трансформација из једног елемента у други, а које се такође дешавају при распаду радиоактивних елемената као и у другим природним нуклеарним процесима.[5]
Данас је познато 118 елемената, од чега се 91 хемијски елемент може наћи у природи, а остали су произведени у лабораторији. У хемији, сваки елемент има свој јединствени хемијски симбол. Он се састоји из једног или два слова, обично изведена из имена тог елемента. На пример симбол за угљеник (карбон) је C, док је симбол за алуминијум Al. Понекад су симболи изведени из латинских имена елемената или из неког његовог једињења.[6]
Дељењем материје (у идеалном случају) дошли би до атома тог хемијског елемента.
Историја открића[уреди | уреди извор]
Појам хемијског елемента настао је током 17. века, након што је све више постајало јасно, да појам елемента из алхемије није погодан за научно објашњење разноврсности особина супстанци и њихових реакција.[7] Један значајан искорак учинио је Етиенне де Клав који је 1641. дао дефиницију елемената као најједноставнијих супстанци од чијих су мешавина састављена једињења и чија се једињења могу поновно разложити на те супстанце. Роберт Бојл је 1661. објавио рад под насловом The Sceptical Chymist врло утицајну критику недостатака алхемије. Осим тога, даље је навео да под појмом хемијског елемента треба подразумевати примитивне супстанце, које нису настале из других супстанци или једни из других, већ чине основне састојке из којих се састоје мешане супстанце.
Оба научника су се тако поставила насупрот тада владајућег учења алхемичара о четири елемента, по којем су све супстанце заправо настале различитим мешањем ватре, воде, ваздуха и земље, те су тако учиниле појам елемента опште ближим експерименталном научном истраживању. Међутим и поред напредног размишљања, и даље су остали „верни“ алхемији, јер су сматрали да такви елементи у природи не постоје, јер је истовремено свака реална супстанца истовремено и мешавина одређених елемената. Бојле је изражавао сумњу да таквих елемената уопште има. Потпуно у духу тада важеће механике, он је заузимао став да супстанце које наоко изгледају монолитно, заправо се састоје из много сићушних истоврсних делића (корпускула), а које се даље опет могу делити на још ситније. Такође је објашњавао разноврсност супстанци и њихових реакција преко безбројних начина у којима ови сићушни делићи могу спајати карактеристично различито за сваку супстанцу. Као резултат таквог мишљења, сматрао је могућом такозвану трансмутацију у алхемији којом би се такви делићи супстанце могли пресложити из једног елемента (нпр. олова) у други (нпр. злато).
Ипак, Бојл је на тај начин припремио пут за истраживања Лавоазјеа, који је одбацио теорију делића (корпускула) као метафизичку спекулацију, али је већ 1789. у своју дефиницију хемијског елемента уградио њихову особину да се они не могу разложити у друге супстанце. Прецизније, сви материјали би требало да буду сврстани у елементе, осим ако не постоји откривена метода за даље одвајање појединих компоненти.[8]
На основу ове дефиниције, Лавоазје је започео изузетно прецизна посматрања хемијских и физичких трансформација материјала у модерној хемији. Посебно се истиче његово откриће закона о очувању укупне масе свих трансформација супстанци и утврдио тачан масени однос у којем чисти елементи реагирају један с другим. Тако је и Џон Далтон извео и закон о умноженим пропорцијама, те 1803. научно могао потврдити постојање непромењивих и неуништивих најмањих честица материје, атома. Према Далтону, елемент је дефинисан као униформни скуп истоврсних атома који се могу спајати са другим атомима према сталним, непромењивим правилима. Различито понашање елемената је објашњавано чињеницом да се атоми разликују по својој маси, величини и могућности спајања са другим атомима. Из тога је произашла могућност да се одреде атомске масе различитих елемената (барем однос једних према другим), те су атоми по први пут постали предмет проучавања експерименталне науке.
Открића елемената[уреди | уреди извор]


Од античких времена па све до средњег века људи су живели у уверењу, да се свет састоји из четири елемента: земље, воде, ваздуха и ватре.
Од елемената у данашњем смислу те речи у антици је било познато само њих неколико у чистом облику, који су се добијали истопљени из руда или су пронађени самородни: угљеник, сумпор, гвожђе, бакар, цинк, сребро, калај, злато, жива и олово.
У току средњовјековне историје рударства, нарочито у немачким Рудним горама, пронађене су руде које су садржавале мале примесе до тад непознатих метала а који су добили имена по духовима из рудника: кобалт, никл и волфрам. Хениг Бранд открио је 1669. фосфор чиме је започело доба откривања већине елемената, те закључно са 1789. годину када је Клапрот открио уранијум у руди ураниту.
Од 1751. били су познати следећи прелазни елементи: гвожђе, кобалт, никл, бакар, цинк, сребро, платина, злато и жива, те елементи главне групе периодног система угљеник, фосфор, сумпор, арсен, калај, антимон, олово и бизмут.[9]
Након 1751. па све до 1800. пронађени су и водоник, титанијум, хром, манган, итријум, цирконијум, молибден, волфрам, уранијум, а касније и азот, кисеоник, хлор и телур.[10]
У периоду од 1800. до 1830. откривена су укупно 22 нова елементе и то из споредне групе елемената: ванадијум, тантал, родијум, паладијум, кадмијум, осмијум, иридијум те метал из групе ретких земаља торијум, као и елементи из главне групе: литијум, берилијум, натријум, магнезијум, калијум, калцијум, стронцијум, баријум, бор, алуминијум, силицијум, селен, јод и бром.[11]
Даљних 11 елемената откривено је у периоду између 1830. и 1869. године. Они су такође били и одређена прекретница у техничко-научном стању развоја, којом је постигнуто откриће и опис неких врло ретких елемената које је до тада било врло тешко или готово немогуће наћи. Били су то хелијум, рубидијум, цезијум, индијум, талијум, ниобијум, рутенијум, као и лантан, церијум, тербијум и ербијум.[12]
Подела елемената[уреди | уреди извор]
Елементи се могу подјелити на метале и неметале. Метали су обично сјајне чврсте материје које проводе електрицитет. Већина метала се топи на високим температурама. Метали су ковни, што значи да се ковањем могу обликовати у различите облике. Многи су такође истегљиви, што значи да се могу растезати без ломова. Гвожђе, бакар, цинк и уранијум су примери метала. Уз изузетак графита - облика угљеника - неметали не проводе електрицитет. Неметали у чврстом стању, као што су сумпор и фосфор, крти су (код удараца се распадају на делове). Многи се неметали топе код много нижих температура од метала; многи су на собној температури у плиновитом стању. Хлор, водоник и кисеоник су неметали. У природи постоје 92 елемента. Изузев хелијума и неона, сви се могу с другим елементима спајати у једињења. За растављање хемијских једињења и ослобађање елемената које садржавају се користе хемијске реакције.
Називи и ознаке[уреди | уреди извор]
За означавање елемената хемичари користе ознаке састављене од једног или двају слова. Прво је слово увек велико, а друго слово је увек мало. На пример, ознаке за водоник и цинк су H и Zn. Елементи који су откривени пре 1800-те године често су називани латинским именима. Римљани су олово звали плумбум, а користили су га за израду цеви за воду. Од латинског имена долази ознака Pb и такође показује корене енглеских речi plumber (водоинсталатер) и plumbing (водоинсталатерство). Елементи из групе метала који су откривени накнадно, и често имају имена која завршавају на -иум. На пример плутонијум је откривен је 1940.
Атомски број и маса[уреди | уреди извор]
Атомски број елемента, Z, је једнак броју протона у елементу. На пример, угљеник, елемент са атомским бројем 6, садржи 6 протона у свом језгру (нуклеусу). Сви атоми датог елемента имају исти атомски број и садрже исти број протона. Ипак, атоми истог елемента могу имати различит број неутрона, и зову се изотопи тог елемента. Атомска маса елемента, A, се мери у јединицама атомске масе (amu) и отприлике је једнака збиру протона и неутрона датог елемента. Неки елементи су радиоактивни и подлежу радиоактивном распаду, мењајући се у други елемент.[13]
Периодни систем[уреди | уреди извор]
Има 118 познатих елемената, од којих се само 94 јавља у природи. Осталих 24 је направио човек; први такав елемент је техницијум, откривен 1937. Сви елементи које је човек направио су радиоактивни са кратким временом полураспада тако да ако је неки од њих и постојао при настанку Земље, давно се распао.
Постоје спискови елемената по имену, по симболу, и по атомском броју. Ипак, најзгодније представљање елемената је путем периодног система елемената, који групише елементе са сличним хемијским својствима.
Званична имена хемијских елемената додељује Међународна унија за чисту и примењену хемију (IUPAC - ајупак), која обично прихвата име које изабере проналазач. Ово може да доведе до контроверзних питања о томе која је истраживачка група стварно открила елемент, што је за релативно дуго времена одложило додељивање имена елементима са атомским бројем 104 и више. (види контроверза о именима хемијских елемената) Хемијским елементима се такође додељује јединствени хемијски симбол, базиран на имену елемента на латинском језику. (На пример, хемијски симбол угљеника има симбол C (лат. carboneum), а натријум има хемијски симбол Na од лат. natrium). Хемијски симболи важе свуда у свету иако се имена елемената често преводе. Прво слово хемијског симбола је увек велико, као у датим примерима.
Изотопи[уреди | уреди извор]
Атоми истог елемента чија језгра садрже различит број неутрона су различити изотопи тог елемента. Чист елемент може постојати у моноатомским јединицама, у двоатомским или полиатомским јединицама које садржавају исту врсту атома. Ове јединице се зову алотропи, без обзира на стање.
Вештачки елементи[уреди | уреди извор]
Свемир се састоји углавном од водоника (90%) и хелијума (9%). Огромни притисци и температуре у унутрашњости звезда као што је нпр. Сунце узрокују нуклеарне реакције које претварају водоник у хелијум. Даље нуклеарне реакције спајају водоник и хелијум заједно уз формирање тежих елемената. Земља је настала од тих елемената када су се одвојили делови Сунца. Научници користе нуклеарне реакције за производњу тешких, вештачких елемената из природних елемената. Ови вештачки елементи су толико нестабилни да се распадају или раздвајају, често у минутима или чак секундама.
Једињења и легуре[уреди | уреди извор]
Елементи могу да се комбинују (да реагују) стварајући чиста једињења (као на пример воду, со, оксиде и органска једињења). У многим случајевима ова једињења имају есенцијално један фиксиран стехиометријски састав, своју структуру и својства.
Неки елементи, поготово метали, се комбинују, стварајући нове структуре променљивијих састава (нпр. металне легуре). У тим случајевима је боље говорити о фазама него о једињењима.
Списак 118 познатих хемијских елемената[уреди | уреди извор]
Следећа табела садржи 118 познатих хемијских елемената.
- Атомски број, име, и симбол служе независно као јединствени идентификатори.
- Имена су она која су прихваћена од стране IUPAC; провизиона имена за недавно произведене елементе који нису формално именовани су дата у заградама.
- Група, периода, и блок се односе на позицију елемента у периодном систему. Бројеви група су у тренутно званично прихваћеној нотацији; за старије алтернативне нотације погледајте Група периодног система елемената.
- Stanje materije (Čvrsto, tečno, ili gasovito) se odnosi na standardne uslove temperature i pritiska (STP).
- Pojavljivanje pravi razliku između elemenata koji se javljaju u prirodi, kategorisane kao bilo Praiskonski ili Prolazni (u smislu raspada), i Sintetički elementi koji su proizvedeni tehnološkim putem, i nisu prirodno poznati.
- Opis sumira svojstva elementa koristeći opširne kategorije koje su prisutne u periodnom sistemu: aktinoid, alkalni metal, zemnoalkalni metal, halogen, lantanoid, metal, metaloid, plemeniti gas, nemetal, i prelazni metal.
| Атомски бр. |
Име | Симбол | Група | Периода | Блок | Стање при СТП |
Појављивање | Опис |
|---|---|---|---|---|---|---|---|---|
| 1 | Водоник | H | 1 | 1 | s | Гас | Праисконски | Неметал |
| 2 | Хелијум | He | 18 | 1 | s | Гас | Праисконски | Племенити гас |
| 3 | Литијум | Li | 1 | 2 | s | Чврст | Праисконски | Алкални метал |
| 4 | Берилијум | Be | 2 | 2 | s | Чврст | Праисконски | Земноалкални метал |
| 5 | Бор | B | 13 | 2 | p | Чврст | Праисконски | Металоид |
| 6 | Угљеник | C | 14 | 2 | p | Чврст | Праисконски | Неметал |
| 7 | Азот | N | 15 | 2 | p | Гас | Праисконски | Неметал |
| 8 | Кисеоник | O | 16 | 2 | p | Гас | Праисконски | Неметал |
| 9 | Флуор | F | 17 | 2 | p | Гас | Праисконски | Халоген |
| 10 | Неон | Ne | 18 | 2 | p | Гас | Праисконски | Племенити гас |
| 11 | Натријум | Na | 1 | 3 | s | Чврст | Праисконски | Алкални метал |
| 12 | Магнезијум | Mg | 2 | 3 | s | Чврст | Праисконски | Земноалкални метал |
| 13 | Алуминијум | Al | 13 | 3 | p | Чврст | Праисконски | Метал |
| 14 | Силицијум | Si | 14 | 3 | p | Чврст | Праисконски | Металоид |
| 15 | Фосфор | P | 15 | 3 | p | Чврст | Праисконски | Неметал |
| 16 | Сумпор | S | 16 | 3 | p | Чврст | Праисконски | Неметал |
| 17 | Хлор | Cl | 17 | 3 | p | Гас | Праисконски | Халоген |
| 18 | Аргон | Ar | 18 | 3 | p | Гас | Праисконски | Племенити гас |
| 19 | Калијум | K | 1 | 4 | s | Чврст | Праисконски | Алкални метал |
| 20 | Калцијум | Ca | 2 | 4 | s | Чврст | Праисконски | Земноалкални метал |
| 21 | Скандијум | Sc | 3 | 4 | d | Чврст | Праисконски | Прелазни метал |
| 22 | Титанијум | Ti | 4 | 4 | d | Чврст | Праисконски | Прелазни метал |
| 23 | Ванадијум | V | 5 | 4 | d | Чврст | Праисконски | Прелазни метал |
| 24 | Хром | Cr | 6 | 4 | d | Чврст | Праисконски | Прелазни метал |
| 25 | Манган | Mn | 7 | 4 | d | Чврст | Праисконски | Прелазни метал |
| 26 | Гвожђе | Fe | 8 | 4 | d | Чврст | Праисконски | Прелазни метал |
| 27 | Кобалт | Co | 9 | 4 | d | Чврст | Праисконски | Прелазни метал |
| 28 | Никал | Ni | 10 | 4 | d | Чврст | Праисконски | Прелазни метал |
| 29 | Бакар | Cu | 11 | 4 | d | Чврст | Праисконски | Прелазни метал |
| 30 | Цинк | Zn | 12 | 4 | d | Чврст | Праисконски | Прелазни метал |
| 31 | Галијум | Ga | 13 | 4 | p | Чврст | Праисконски | Метал |
| 32 | Германијум | Ge | 14 | 4 | p | Чврст | Праисконски | Металоид |
| 33 | Арсен | As | 15 | 4 | p | Чврст | Праисконски | Металоид |
| 34 | Селен | Se | 16 | 4 | p | Чврст | Праисконски | Неметал |
| 35 | Бром | Br | 17 | 4 | p | Течност | Праисконски | Халоген |
| 36 | Криптон | Kr | 18 | 4 | p | Гас | Праисконски | Племенити гас |
| 37 | Рубидијум | Rb | 1 | 5 | s | Чврст | Праисконски | Алкални метал |
| 38 | Стронцијум | Sr | 2 | 5 | s | Чврст | Праисконски | Земноалкални метал |
| 39 | Итријум | Y | 3 | 5 | d | Чврст | Праисконски | Прелазни метал |
| 40 | Цирконијум | Zr | 4 | 5 | d | Чврст | Праисконски | Прелазни метал |
| 41 | Ниобијум | Nb | 5 | 5 | d | Чврст | Праисконски | Прелазни метал |
| 42 | Молибден | Mo | 6 | 5 | d | Чврст | Праисконски | Прелазни метал |
| 43 | Технецијум | Tc | 7 | 5 | d | Чврст | Пролазан | Прелазни метал |
| 44 | Рутенијум | Ru | 8 | 5 | d | Чврст | Праисконски | Прелазни метал |
| 45 | Родијум | Rh | 9 | 5 | d | Чврст | Праисконски | Прелазни метал |
| 46 | Паладијум | Pd | 10 | 5 | d | Чврст | Праисконски | Прелазни метал |
| 47 | Сребро | Ag | 11 | 5 | d | Чврст | Праисконски | Прелазни метал |
| 48 | Кадмијум | Cd | 12 | 5 | d | Чврст | Праисконски | Прелазни метал |
| 49 | Индијум | In | 13 | 5 | p | Чврст | Праисконски | Метал |
| 50 | Калај | Sn | 14 | 5 | p | Чврст | Праисконски | Метал |
| 51 | Антимон | Sb | 15 | 5 | p | Чврст | Праисконски | Металоид |
| 52 | Телур | Te | 16 | 5 | p | Чврст | Праисконски | Металоид |
| 53 | Јод | I | 17 | 5 | p | Чврст | Праисконски | Халоген |
| 54 | Ксенон | Xe | 18 | 5 | p | Гас | Праисконски | Племенити гас |
| 55 | Цезијум | Cs | 1 | 6 | s | Чврст | Праисконски | Алкални метал |
| 56 | Баријум | Ba | 2 | 6 | s | Чврст | Праисконски | Земноалкални метал |
| 57 | Лантан | La | 3 | 6 | f | Чврст | Праисконски | Лантаноид |
| 58 | Церијум | Ce | 3 | 6 | f | Чврст | Праисконски | Лантаноид |
| 59 | Празеодијум | Pr | 3 | 6 | f | Чврст | Праисконски | Лантаноид |
| 60 | Неодијум | Nd | 3 | 6 | f | Чврст | Праисконски | Лантаноид |
| 61 | Прометијум | Pm | 3 | 6 | f | Чврст | Пролазан | Лантаноид |
| 62 | Самаријум | Sm | 3 | 6 | f | Чврст | Праисконски | Лантаноид |
| 63 | Еуропијум | Eu | 3 | 6 | f | Чврст | Праисконски | Лантаноид |
| 64 | Гадолинијум | Gd | 3 | 6 | f | Чврст | Праисконски | Лантаноид |
| 65 | Тербијум | Tb | 3 | 6 | f | Чврст | Праисконски | Лантаноид |
| 66 | Диспрозијум | Dy | 3 | 6 | f | Чврст | Праисконски | Лантаноид |
| 67 | Холмијум | Ho | 3 | 6 | f | Чврст | Праисконски | Лантаноид |
| 68 | Ербијум | Er | 3 | 6 | f | Чврст | Праисконски | Лантаноид |
| 69 | Тулијум | Tm | 3 | 6 | f | Чврст | Праисконски | Лантаноид |
| 70 | Итербијум | Yb | 3 | 6 | f | Чврст | Праисконски | Лантаноид |
| 71 | Лутецијум | Lu | 3 | 6 | d | Чврст | Праисконски | Лантаноид |
| 72 | Хафнијум | Hf | 4 | 6 | d | Чврст | Праисконски | Прелазни метал |
| 73 | Тантал | Ta | 5 | 6 | d | Чврст | Праисконски | Прелазни метал |
| 74 | Волфрам | W | 6 | 6 | d | Чврст | Праисконски | Прелазни метал |
| 75 | Ренијум | Re | 7 | 6 | d | Чврст | Праисконски | Прелазни метал |
| 76 | Осмијум | Os | 8 | 6 | d | Чврст | Праисконски | Прелазни метал |
| 77 | Иридијум | Ir | 9 | 6 | d | Чврст | Праисконски | Прелазни метал |
| 78 | Платина | Pt | 10 | 6 | d | Чврст | Праисконски | Прелазни метал |
| 79 | Злато | Au | 11 | 6 | d | Чврст | Праисконски | Прелазни метал |
| 80 | Жива | Hg | 12 | 6 | d | Течност | Праисконски | Прелазни метал |
| 81 | Талијум | Tl | 13 | 6 | p | Чврст | Праисконски | Метал |
| 82 | Олово | Pb | 14 | 6 | p | Чврст | Праисконски | Метал |
| 83 | Бизмут | Bi | 15 | 6 | p | Чврст | Праисконски | Метал |
| 84 | Полонијум | Po | 16 | 6 | p | Чврст | Пролазан | Метал |
| 85 | Астат | At | 17 | 6 | p | Чврст | Пролазан | Халоген |
| 86 | Радон | Rn | 18 | 6 | p | Гас | Пролазан | Племенити гас |
| 87 | Францијум | Fr | 1 | 7 | s | Чврст | Пролазан | Алкални метал |
| 88 | Радијум | Ra | 2 | 7 | s | Чврст | Пролазан | Земноалкални метал |
| 89 | Актинијум | Ac | 3 | 7 | f | Чврст | Пролазан | Актиноид |
| 90 | Торијум | Th | 3 | 7 | f | Чврст | Праисконски | Актиноид |
| 91 | Протактинијум | Pa | 3 | 7 | f | Чврст | Пролазан | Актиноид |
| 92 | Уранијум | U | 3 | 7 | f | Чврст | Праисконски | Актиноид |
| 93 | Нептунијум | Np | 3 | 7 | f | Чврст | Пролазан | Актиноид |
| 94 | Плутонијум | Pu | 3 | 7 | f | Чврст | Праисконски | Актиноид |
| 95 | Америцијум | Am | 3 | 7 | f | Чврст | Пролазан | Актиноид |
| 96 | Киријум | Cm | 3 | 7 | f | Чврст | Пролазан | Актиноид |
| 97 | Берклијум | Bk | 3 | 7 | f | Чврст | Пролазан | Актиноид |
| 98 | Калифорнијум | Cf | 3 | 7 | f | Чврст | Пролазан | Актиноид |
| 99 | Ајнштајнијум | Es | 3 | 7 | f | Чврст | Синтетички | Актиноид |
| 100 | Фермијум | Fm | 3 | 7 | f | Синтетички | Актиноид | |
| 101 | Мендељевијум | Md | 3 | 7 | f | Синтетички | Актиноид | |
| 102 | Нобелијум | No | 3 | 7 | f | Синтетички | Актиноид | |
| 103 | Лоренцијум | Lr | 3 | 7 | d | Синтетички | Актиноид | |
| 104 | Радерфордијум | Rf | 4 | 7 | d | Синтетички | Прелазни метал | |
| 105 | Дубнијум | Db | 5 | 7 | d | Синтетички | Прелазни метал | |
| 106 | Сиборгијум | Sg | 6 | 7 | d | Синтетички | Прелазни метал | |
| 107 | Боријум | Bh | 7 | 7 | d | Синтетички | Прелазни метал | |
| 108 | Хасијум | Hs | 8 | 7 | d | Синтетички | Прелазни метал | |
| 109 | Мајтнеријум | Mt | 9 | 7 | d | Синтетички | ||
| 110 | Дармштатијум | Ds | 10 | 7 | d | Синтетички | ||
| 111 | Рентгенијум | Rg | 11 | 7 | d | Синтетички | ||
| 112 | Коперницијум | Cn | 12 | 7 | d | Синтетички | Прелазни метал | |
| 113 | Нихонијум | Nh | 13 | 7 | p | Синтетички | ||
| 114 | Флеровијум | Fl | 14 | 7 | p | Синтетички | ||
| 115 | Московијум | Mc | 15 | 7 | p | Синтетички | ||
| 116 | Ливерморијум | Lv | 16 | 7 | p | Синтетички | ||
| 117 | Тенесин | Ts | 17 | 7 | p | Синтетички | ||
| 118 | Оганесон | Og | 18 | 7 | p | Синтетички |
Види још[уреди | уреди извор]
- Открића хемијских елемената
- Распрострањеност хемијских елемената
- Хемијски елементи названи по људима
- Хемијски елементи названи по местима
- Једињење
- Хемијски симбол
- Периодни систем елемената
Референце[уреди | уреди извор]
- ^ William L. Masterton, Cecile N. Hurley, Edward J. Neth : Chemistry: Principles and Reactions, 7. izd., Brooks/Cole, Cengage Learning. Masterton, William L.; Hurley, Cecile N.; Neth, Edward (2012). Chemistry: Principles and Reactions. Cengage Learning. стр. 2. ISBN 978-1-111-42710-8.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Burbidge, E. M.; Burbidge, G. R.; Fowler, W. A.; Hoyle, F. (1957). „Synthesis of the Elements in Stars”. Reviews of ModernPhysics. 29 (4): 547—650.}
- ^ Burbidge, E. M.; Burbidge, G. R.; Fowler, W. A.; Hoyle, F. (1957). „Synthesis of the Elements in Stars”. Reviews of Modern Physics. 29 (4): 547—650. Bibcode:1957RvMP...29..547B. doi:10.1103/RevModPhys.29.547.
- ^ Oerter 2006, стр. 223.
- ^ Los Alamos National Laboratory (2011). „Periodic Table of Elements: Oxygen”. Los Alamos, New Mexico: Los Alamos National Security, LLC. Приступљено 7. 5. 2011.
- ^ Boas 1958
- ^ William H. Brock: Viewegs Geschichte der Chemie. Vieweg, Braunschweig 1992.
- ^ Grafički prikaz periodnog sistema sa elementima poznatim prije 1751.
- ^ Grafički prikaz periodnog sistema sa elementima poznatim do 1800.
- ^ Grafički prikaz periodnog sistema sa elementima poznatim do 1830.
- ^ Grafički prikaz periodnog sistema sa elementima poznatim do 1869.
- ^ Pauling, Linus (1988). General chemistry. Mineola, NY: Dover Publications, Inc. ISBN 978-0-486-65622-9.
Литература[уреди | уреди извор]
- Boas, Marie (1958). Robert Boyle and the seventeenth century chemistry. Cambridge: Cambridge University Press. ISBN 978-0527092504.
- Oerter, Robert (2006). The Theory of Almost Everything: The Standard Model, the Unsung Triumph of Modern Physics. Penguin. стр. 223. ISBN 978-0-452-28786-0.
- Ball, P (2004). The Elements: A Very Short Introduction. Oxford University Press. ISBN 978-0-19-284099-8.
- Emsley, J (2003). Nature's Building Blocks: An A-Z Guide to the Elements. Oxford University Press. ISBN 978-0-19-850340-8.
- Gray, T (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe. Black Dog & Leventhal Publishers Inc. ISBN 978-1-57912-814-2.
- Pauling, Linus (1988). General chemistry. Mineola, NY: Dover Publications, Inc. ISBN 978-0-486-65622-9.
- Scerri, ER (2007). The Periodic Table, Its Story and Its Significance. Oxford University Press.
- Strathern, P (2000). Mendeleyev's Dream: The Quest for the Elements. Hamish Hamilton Ltd. ISBN 978-0-241-14065-9.
- Kean, Sam (2011). The Disappearing Spoon: And Other True Tales of Madness, Love, and the History of the World from the Periodic Table of the Elements. Back Bay Books. ISBN 9780316051637.
- Gray, Theodore (2009). Die Elemente: Bausteine unserer Welt. Köln: Fackelträger-Verlag. ISBN 978-3771644352.
- Rauchhaupt, Ulf von (2009). Die Ordnung der Stoffe: Ein Streifzug durch die Welt der chemischen Elemente. Frankfurt am Main: Fischer-Taschenbuch-Verlag. ISBN 978-3-596-18590-0.
- Lucien F. Trueb: Die chemischen Elemente – Ein Streifzug durch das Periodensystem. . Die chemischen Elemente: Ein Streifzug durch das Periodensystem. Stuttgart: S. Hirzel Verlag. 2005. ISBN 978-3-7776-1356-7.
- Binder, Harry H. (1999). Lexikon der chemischen Elemente: Das Periodensystem in Fakten, Zahlen und Daten. Stuttgart: S. Hirzel Verlag. ISBN 978-3-7776-0736-8.
- Alexander C. Wimmer: Die chemischen Elemente.. SMT, Leoben. Wimmer, Alexander C. (2011). Die chemischen Elemente. ISBN 978-3-2000-2434-2.
- Менделеев Д. И.,. Элементы химические // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- Чернобельская Г. М. Методика обучения химии в средней школе. — М.: Гуманитарный издательский центр ВЛАДОС, — 336 с. 2000. ISBN 5-691-00492-.
Спољашње везе[уреди | уреди извор]
- Елементимологија & Мултидикт елемената историја речи и речник језика
- Videos for each element by the University of Nottingham
- www.chemieseite.de enthält ausführliche Beschreibungen der Hauptelemente
- www.pse-mendelejew.de enthält viele Fotografien von reinen Elementen
- Umfangreiche Übersicht
